Jmjd3和Ezh2酶活性抑制劑對人間充質干細胞成脂分化的影響及機制研究
武曉慧 李蓉 黃振鵬 楊帆 陳佳琪

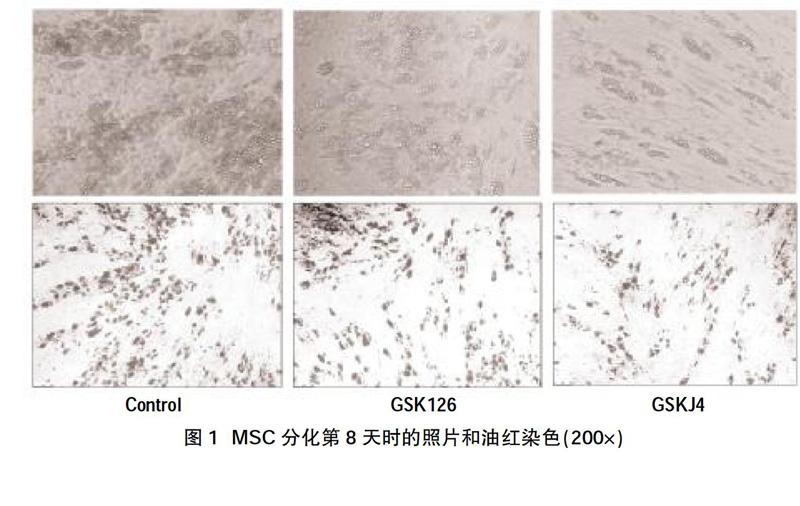
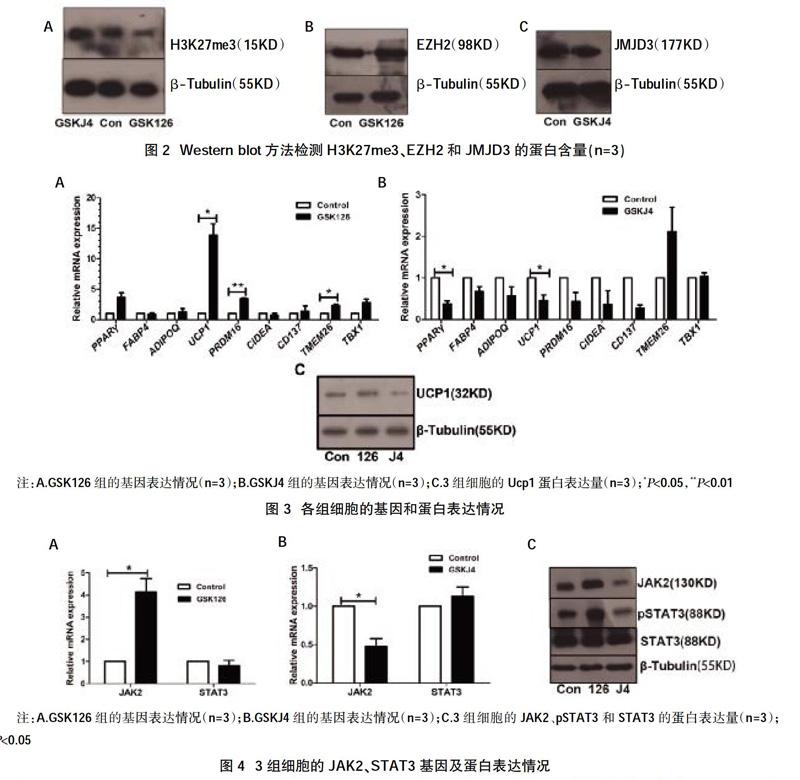
摘要:目的? 研究EZH2和JMJD3對人脂肪間充質干細胞成脂分化的影響及可能機制。方法? 體外培養人脂肪來源間充質干細胞并進行誘導分化。分化過程中分別加入EZH2酶活性抑制劑GSK126(6 μM)和JMJD3酶活性抑制劑GSKJ4(20 μM),對照組加入DMSO。采用Realtime PCR方法檢測脂肪細胞分化基因PPARγ、FABP4和ADIPOQ;棕色化標志基因UCP1、PRDM16和CIDEA,以及米色脂肪獨有的標志基因CD137、TMEM26和TBX1,并計算各組與對照組的相對表達量。采用Western Blot法檢測H3K27me3、UCP1、JAK2、STAT3和pSTST3的蛋白表達量。結果? GSK126組的脂滴形成略減少,GSKJ4組的脂滴形成明顯減少。GSK126組的H3K27me3含量減少,GSKJ4組的H3K27me3含量增加;GSK126組的UCP1、PRDM16、TMEM26和JAK2基因表達均明顯增加(P<0.05);GSKJ4組的PPARγ、UCP1和JAK2的基因表達量均明顯降低(P<0.05);GSK126組的UCP1蛋白表達增加而GSKJ4組UCP1蛋白表達減少。GSK126組的JAK2和pSTST3均增加,GSKJ4組的JAK2和pSTST3蛋白表達均減少。結論? EZH2酶活性抑制劑GSK126促進人MSC向棕色或米色脂肪細胞分化。JMJD3酶活性抑制劑GSKJ4抑制人MSC向棕色或米色脂肪細胞分化;EZH2和JMJD3的酶活性影響H3K27的三甲基化修飾,可能通過JAK2-STAT信號通路,發揮調控人脂肪細胞分化的作用。
關鍵詞:間充質干細胞;分化;EZH2;JMJD3;UCP1;JAK2c
中圖分類號:R364.2? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標識碼:A? ? ? ? ? ? ? ? ? ? ? ? ? ? ? DOI:10.3969/j.issn.1006-1959.2019.02.020
文章編號:1006-1959(2019)02-0063-06
肥胖是當今世界最常見的慢性非傳染性疾病之一[1],我國的肥胖人數已達世界之最,2010年的調查結果顯示,有41.7%以上的人群處于超重或者肥胖狀態[2]。肥胖可以引發多種疾病,如胰島素抵抗、2型糖尿病、心腦血管疾病、骨關節炎、部分癌癥等[3,4]。多項研究表明,嚙齒動物和人體內的棕色和米色脂肪細胞可以通過產熱消耗能量,對抗肥胖和胰島素抵抗,因而這兩類脂肪細胞的分化成為肥胖治療領域的研究熱點[5]。
目前對于脂肪細胞分化的研究已由針對單個基因功能的研究轉為基因表達調控的研究,如表觀遺傳學調控機制。組蛋白修飾是表觀遺傳調控基因表達的方式之一,研究發現,組蛋白H3K27me3去甲基化酶jmjd3可以促進小鼠棕色脂肪細胞的分化[6],而H3K27me3甲基轉移酶Ezh2可以在體外促進小鼠白色和棕色脂肪細胞的分化[7],但在人體細胞尚無相關報道,其調控機制亦尚不清楚。研究發現,JAK2可通過JAK2/STAT途徑調控脂肪細胞分化[8]。本實驗擬以人脂肪來源間充質干細胞(mesenchymal stem cells,MSC)為研究對象,在誘導分化過程中使用EZH2酶活性抑制劑GSK126或JMJD3酶活性抑制劑GSKJ4處理細胞,觀察細胞成脂分化情況,并檢測JAK2及STAT3的表達,揭示Jmjd3和Ezh2對人間充質干細胞向脂肪細胞分化過程的影響及可能機制。
1材料與方法
1.1主要試劑? 人脂肪來源間充質干細胞(中科院上海細胞庫);間充質干細胞培養液(MSCM,7501,美國Sciencell);DMEM培養液(美國Sigma);胎牛血清(四季青);人用生物合成短效胰島素(諾和靈R,諾和諾德);3-異丁基-1-甲基黃嘌呤(IBMX)(美國Sigma);地塞米松(美國Sigma);三碘甲腺原氨酸(T3,上海麥克林);羅格列酮(麥克林)。用于western blot的一抗:兔Ezh2 抗體(1∶1000;CST);兔Jmjd3抗體(1∶1000,Abcam);兔H3K27me3抗體(1∶1000;Abcam);兔JAK2抗體(1∶1000;Abcam);兔STAT3抗體(1∶1000;Abcam);兔磷酸化STAT3抗體(1∶1000;Abcam);小鼠β-Tubulin(1∶1000;天津三箭)。二抗:HRP-羊抗兔IgG、HRP-羊抗鼠IgG(1∶5000;北京中杉金橋)。全蛋白提取試劑盒、BCA蛋白濃度測定試劑盒(碧云天)。用于Realtime PCR的RNA提取試劑盒、反轉錄試劑盒、Syber Green Master Mix(日本Takara)。小分子抑制劑GSK126、GSKJ4(美國MCE);油紅0粉末(Sigma)。
1.2細胞的分化方法? 實驗設3個組,分別為對照組,GSK126組和GSKJ4組,將細胞種于12孔板內,每個組設3個復孔。細胞擴增達100%匯合時出現接觸抑制,細胞停止分裂進入分化階段(G0期),設為分化第2天。接觸抑制2 d后,開始分化,為分化第0天。每孔加入分化液,并且按照設計分別加入GSK126、GSKJ4或DMSO;分化液培養2 d后換用維持培養液培養,每隔2 d換液1次,換液后根據分組加入GSK126或GSKJ4,對照組加入等體積DMSO。分化第8天時,對照組已經全部出現脂滴,此時結束分化。
1.3分化液的配制
1.3.1分化液的成份? 經摸索實驗條件,MSC的擴增培養和傳代使用MSCM培養液,分化時換用DMEM培養液分化更好。分化液的配制:在50 ml DMEM完全培養液中加入胰島素、IBMX、地塞米松、羅格列酮和T3;維持液的配制:在50 ml DMEM完全培養液中加入胰島素、羅格列酮和T3。所有藥品加入后0.22 μm濾器過濾于新的滅菌50 ml離心管,4 ℃保存。
1.3.2分化用藥品的配制? 短效胰島素:50 ml培養液中加入60 μl。IBMX的工作濃度為0.5 mM,稱取IBMX粉劑 222.2 mg,溶于2 ml DMSO,配成1000×母液,用時50 ml培養液中加入IBMX母液50 μl。地塞米松工作濃度為5 μm,稱取3.92 mg地塞米松,加入1 ml DMSO,配成10000×母液,用時在50 ml培養液中加入地塞米松母液5 μl。羅格列酮的工作濃度為1 μm,稱取0.357 mg羅格列酮,加入1 ml DMSO,配成1000×母液,用時在50 ml培養液中加入羅格列酮母液5 μl;T3工作濃度為1 nm,稱取0.0651 mg T3,加入10 ml DMSO,配成10000×母液。用時在50 ml培養液中加入T3母液 5 μl。
1.3.3 GSK126及GSKJ4儲存液的配制及使用? GSK126的分子量為526.6 g/mol。稱取GSK126粉劑1.05 mg,加入DMSO 1 ml,0.22 μm微孔濾膜過濾,工作濃度為6 μm,用時每1 ml培養液加3 μl母液。GSK J4的分子量為417.5 g/mol。稱取GSKJ4粉劑2.8 mg,加入DMSO 1 ml,充分溶解后,0.22 μm微孔濾膜過濾,工作濃度為20 μm,用時每1 ml培養液加3 μl母液。因培養液中DMSO>1‰,為排除影響,對照組每1 ml培養液加3 μl DMSO。
1.4細胞的油紅染色? 配制油紅O染液:稱取油紅O 粉末0.5 g,溶于100 ml異丙醇,濾紙過濾,避光4℃保存。使用時配制工作液,用時現配:取6 ml儲存液加ddH2O 4 ml,混勻后靜置10 min,用濾紙過濾。染色時,細胞用預冷的4%甲醛固定10 min,PBS緩沖液洗1次。油紅O工作液避光染色30 min;60%異丙醇浸洗1~2次,除去多余的油紅O染液。PBS浸洗2次,在吸水紙上拍干,滴加50%甘油封片劑(甘油:PBS緩沖液體積比=1∶1),在倒置顯微鏡下觀察并照相。
1.5 Realtime PCR檢測mRNA的表達? Trizol法提取總RNA。將總RNA反轉錄為cDNA后進行Realtime PCR反應。實驗所需引物由大連寶生公司設計并合成,序列信息見表1。以小鼠β-actin為內參。反應體系為20 μl。反應程序為:95 ℃預變性30 s,隨后42個循環:95 ℃變性5 s,56 ℃退火及延伸30 s。每個基因設3個復孔,采用2-△△Ct法計算基因的相對表達量。實驗重復3次,采用Graphpad prism 5軟件繪制成柱狀圖。
1.6 Western blot 法檢測蛋白表達? 倒掉培養液,向培養皿中加入RIPA裂解液(已經加入PMSF),冰上放置裂解30 min;細胞刮刀刮下細胞,并吸出液體至1.5 ml離心管,13000 rpm 4 ℃離心5 min。將離心后的上清轉移至新的1.5 ml的離心管中,上清液取5 μl采用BCA法做蛋白濃度測定,其余按照體積加入5×loading Buffer上樣緩沖液(內含β-巰基乙醇),混勻,95 ℃金屬浴10 min,-20 ℃保存備用。根據待測蛋白的分子量配制不同濃度的SDS-Page分離凝膠,蛋白上樣量為20~50 μg,電泳完成后100 V 1 h濕轉至PVDF膜,5%脫脂奶粉封閉后4 ℃孵育一抗過夜,相應的二抗室溫孵育1 h,ECL發光液發光。
1.7統計學方法? 數據用SPSS 20.0 統計軟件處理,所有數據采用(x±s)表示,組間比較采用獨立樣本均數t檢驗,以P<0.05為統計學意義顯著,P<0.01為統計學意義極顯著。
2結果
2.1 GSK126對人MSC成脂分化影響較小,GSKJ4明顯減少MSC的成脂分化? 實驗設置3個組,分別是GSK126組,GSKJ4組和溶劑對照組(DMSO)。我們在培養液中根據文獻提供的濃度,在分化誘導和維持期持續加入GSK126和GSKJ4。分化8 d后進行拍照,發現加入抑制劑后,細胞分化仍可進行,但脂滴形成有差異。GSK126組脂滴形成略減少,GSKJ4組脂滴形成明顯減少,見圖1(上)。經油紅染色證實,對照組脂滴較多,GSK126組的脂滴形成略減少,GSKJ4組脂滴形成明顯減少,見圖1(下)。
2.2抑制劑改變了H3K27me3甲基化修飾水平? 經Western Blot檢測,發現給藥組H3K27me3的含量出現相應的改變,GSKJ4組該蛋白含量增加,H3K27三甲基化修飾水平增高;GSK126組該蛋白含量減少,H3K27三甲基化修飾水平降低,見圖2A。接著我們測定了H3K27me3的甲基轉移酶Ezh2和去甲基化酶Jmjd3的蛋白表達情況,結果顯示,加入酶活性抑制劑后Ezh2和Jmjd3的蛋白表達均無明顯改變,表明在酶蛋白含量無明顯改變的情況下,兩種蛋白的酶活性被部分抑制,見圖2B,圖2C。
2.3 GSK126組棕色脂肪標志基因表達增加,GSKJ4組的脂肪分化基因和棕色脂肪標志基因表達減少? 我們檢測了三組細胞的脂肪細胞分化基因PPARγ、FABP4和ADIPOQ;棕色化標志基因UCP1、PRDM16和CIDEA,以及米色脂肪特有的標志基因CD137、TMEM26和TBX1,并計算各組與對照組的相對表達量。結果顯示,GSK126組的脂肪細胞分化基因沒有明顯改變,而GSKJ4組的PPARγ表達明顯減少(P<0.05),見圖3B。GSK126組的UCP1和PRDM16的表達明顯升高(P<0.05,P<0.01),見圖3A。GSK J4組的Ucp1表達明顯減少(P<0.05),見圖3B。另外,GSK126組的米色脂肪特有基因TMEM26的表達明顯升高(P<0.05),見圖3A。經Western blot檢測,GSK126組的Ucp1表達升高,而GSKJ4組的Ucp1表達降低,見圖3C。這些結果表明,GSK126促進了人MSC向棕色脂肪方向的分化,而GSKJ4抑制了MSC向棕色脂肪方向分化。
綜上所述,H3K27me3的甲基化修飾在體外對于人脂肪來源間充質干細胞的成脂分化發揮了重要的調控作用:EZH2催化的H3K27me3修飾增加抑制MSC向棕色和米色脂肪細胞分化;JMJD3催化的H3K27me3修飾減少促進MSC向棕色和米色脂肪細胞分化。這些效應可能通過JAK2-STAT3信號通路發揮作用。
參考文獻:
[1]Winik CL,Bonham CE.Implementation of a screening and management of overweight and obesity clinical practice guideline in an ambulatory care setting[J].Mil Med,2018,183(1-2):32-39.
[2]王醴湘,呂筠,郭彧,等.中國慢性病前瞻性研究:10個項目地區成年人超重/肥胖現況分析[J].中華流行病學雜志,2015,36(11):1190-1194.
[3]Gustafson B,Hedjazifar S,Gogg S,et al.Insulin resistance and impaired adipogenesis[J].Trends Endocrinol Metab,2015,26(4):193-200.
[4]Akinyemiju T,Moore JX,Pisu M,et al.A prospective study of obesity, metabolic health, and cancer mortality[J].Obesity,2018,26(1):193-201.
[5]Gonzalez-Hurtado E,Lee J,Choi J,et al.Fatty acid oxidation is required for active and quiescent brown adipose tissue maintenance and thermogenic programing[J].Molecular Metabolism,2018(7):45-56.
[6]Pan D,Huang L,Zhu LJ,et al.Jmjd3-mediated h3k27me3 dynamics orchestrate brown fat development and regulate white fat plasticity[J].Dev Cell,2015,35(5):568-583.
[7]Wang L,Jin Q,Lee JE,et al.Histone h3k27 methyltransferase ezh2 represses wnt genes to facilitate adipogenesis[J].Proc Natl Acad Sci USA,2010,107(16):7317-7322.
[8]Shi SY,Zhang W,Luk CT,et al.Jak2 promotes brown adipose tissue function and is required for diet- and cold-induced thermogenesis in mice[J].Diabetologia,2016,59(1):187-196.
[9]Gathirua-Mwangi WG,Song Y,Monahan PO,et al.Associations of metabolic syndrome and c-reactive protein with mortality from total cancer, obesity-linked cancers and breast cancer among women in nhanes iii[J].International Journal of Cancer,2018,143(3):535-542.
[10]Ishibashi J,Seale P.Medicine. Beige can be slimming[J].Science,2010,328(5982):1113-1114.
[11]Jaksic VP.Adipose tissue as an endocrine organ[J].Molecular & Cellular Endocrinology,2014,316(2):129-139.
[12]Cypess AM,Lehman S,Williams G,et al.Identification and importance of brown adipose tissue in adult humans[J].N Engl J Med,2009,360(15):1509-1517.
[13]Lidell ME,Betz MJ,Dahlqvist Leinhard O,et al.Evidence for two types of brown adipose tissue in humans[J].Nat Med,2013,19(5):631-634.
[14]湯其群.生物化學與分子生物學[M].上海:復旦大學出版社,2015:149-157.
[15]Ohno H,Shinoda K,Ohyama K,et al.Ehmt1 controls brown adipose cell fate and thermogenesis through the prdm16 complex[J].Nature,2013,504(7478):163-167.
[16]Harms MJ,Ishibashi J,Wang W,et al.Prdm16 is required for the maintenance of brown adipocyte identity and function in adult mice[J].Cell Metab,2014,19(4):593-604.
[17]Garcia RA,Roemmich JN,Claycombe KJ.Evaluation of markers of beige adipocytes in white adipose tissue of the mouse[J].Nutr Metab,2016,13(1):24-37.
[18]Cypess AM,Lehman S,Williams G,et al.Identification and importance of brown adipose tissue in adult humans[J].New England Journal of Medicine,2009,360(15):1509-1517.
[19]Asano H,Kanamori Y,Higurashi S,et al.Induction of beige-like adipocytes in 3t3-L1 cells[J].J Vet Med Sci,2014,76(1):57-64.
[20]Krone WJA,Stegehuis F,Koningstein G,et al.Ppar gamma agonists induce a white-to-brown fat conversion through stabilization of prdm16 protein[J].Cell Metab,2012,15(3):395-404.
[21]Sharp LZ,Shinoda K,Ohno H,et al.Human BAT Possesses Molecular Signatures That Resemble Beige/Brite Cells[J].PLOs One,2012,7(11):49452-49462.
[22]Wu J,Bostrom P,Sparks LM,et al.Beige adipocytes are a distinct type of thermogenic fat cell in mouse and human[J].Cell,2012,150(2):366-376.
[23]Unno Y,Yamamoto H,Takatsuki S,et al.Palmitoyl lactic acid induces adipogenesis and a brown fat-like phenotype in 3t3-l1 preadipocytes[J].Biochim Biophys Acta Mol Cell Biol Lipids,2018,1863(7):772-782.
[24]Han DH,Nolte LA,Ju JS,et al.Ucp-mediated energy depletion in skeletal muscle increases glucose transport despite lipid accumulation and mitochondrial dysfunction[J].American Journal of Physiology Endocrinology & Metabolism,2004,286(3):347-353.
[25]Shi SY,Luk CT,Brunt JJ,et al.Adipocyte-specific deficiency of janus kinase (jak) 2 in mice impairs lipolysis and increases body weight, and leads to insulin resistance with ageing[J].Diabetologia,2014,57(5):1016-1026.
收稿日期:2018-11-3;修回日期:2018-11-13
編輯/楊倩

