U0126對谷氨酸神經毒性損傷模型大鼠的腦保護作用
趙精咪,孫莉,梁浩,程焱
興奮性氨基酸(EAA)是存在于人體中樞神經系統的興奮性神經遞質。其中谷氨酸是最重要的EAA之一,對神經元的生長、存活,突觸的連接及適應性生長都有著重要作用。約1/3 的中樞神經系統神經元的信息傳遞需要谷氨酸及其受體的參與,這些神經元主要分布在大腦皮質和海馬,參與學習、行為、記憶等多種重要神經功能[1]。正常生理環境下,谷氨酸通過三羧酸循環、谷氨酸-谷氨酰胺循環等途徑完成生成、釋放、攝取和失活過程,可避免神經元暴露于高濃度谷氨酸而造成神經損傷[2]。當機體受到代謝、免疫、缺血等方面損傷時,谷氨酸平衡被破壞,大量谷氨酸堆積造成神經毒性損傷。近年來研究發現,許多神經系統疾病,如阿爾茨海默病(AD)[3]、帕金森病(PD)[4]、肌萎縮側索硬化(ALS)[5-6]、多發性硬化(MS)[7]、亨廷頓病(HD)[8]、精神分裂癥[9]、癲癇[10]、重度抑郁及雙相障礙[11]等都與谷氨酸神經毒性損傷因素有關。MAPK/ERK1/2(mitogen-activated protein kinase/extracellular signal-regulated kinase 1/2)是介導細胞增殖分化的重要信號通路,在維持細胞正常形態、組織結構和增殖方面具有重要作用。然而,在某些損傷條件下,MAPK/ERK1/2 信號通路也可被激活,參與細胞損傷。已有研究顯示,谷氨酸興奮毒性損傷可引起MAPK/ERK1/2激活,但目前對于MAPK/ERK1/2 抑制劑在谷氨酸神經興奮性毒性損傷中的作用尚存在爭議[12-14],且這些研究結果多來源于體外研究,鮮有體內相關研究。基于此,本研究通過開展大鼠體內的谷氨酸興奮性毒性研究,以期明確MAPK/ERK1/2 抑制劑對谷氨酸毒性損傷的保護作用。
1 材料與方法
1.1 實驗動物 成年健康雄性SD 大鼠50 只,體質量260~280 g,由北京華阜康生物科技股份有限公司提供。分籠飼養于室溫、自然光環境下晝夜循環,自由飲水,標準飼料喂養。所有動物實驗前適應性喂養至少3 d。
1.2 試劑與儀器 N-甲基-D-天冬氨酸(NMDA)購自Sigma公司,MAPK/ERK1/2抑制劑U0126購自Merck millipore公司;小鼠抗總ERK1/2 抗體、小鼠抗p-ERK1/2 抗體、小鼠抗Caspase-3(活化形式)抗體、小鼠抗環氧合酶-2(COX-2)抗體均購自Santa cruz 公司;兔抗誘導型一氧化氮合酶(iNOS)購自ABclonal 公司;免疫熒光染色一抗及兔抗NeuN 抗體購自Abcam公司;蛋白質印跡實驗及免疫熒光染色實驗二抗均購自北京中杉金橋生物技術有限公司。石蠟切片機購自日本Shandon 公司;低溫高速離心機購自美國Kendro 公司;Western blot電泳與轉膜系統購自美國Bio-Rad公司;凝膠成像儀購自美國Syngene公司。
1.3 谷氨酸神經毒性損傷模型建立 大鼠術前禁食水6 h,10%水合氯醛(0.35 mL/100 g)腹腔注射麻醉。麻醉成功后使大鼠呈俯臥位,將頭部固定于立體定位儀。頭頂皮膚剃毛、消毒,正中位切口,逐層分離肌肉、筋膜,暴露前囟。以前囟為0點,坐標為AP+0.5 mm,L 3.5 mm,墨水標記,用牙科鉆于標記處鉆開顱骨,垂直進針,進針深度為1.2 mm,予以藥物注射(1μL)。注射完成后每5 min拔針0.5 mm,直至完全退針。縫合頭皮切口并再次消毒。(1)NMDA 最佳作用濃度篩選。實驗設正常組(單純手術處理)、對照組(開顱后注射1μL生理鹽水)和不同濃度(50、100、200 mmol/L)NMDA處理組。(2)最佳作用時間篩選。選取最優的NMDA處理濃度,注射后觀察3、6、12、24 h,實驗另設正常組和對照組。
1.4 分組及處理 根據已選定的最佳條件,實驗設對照組,U0126(2 g/L)單獨處理組、NMDA 單獨處理組、不同濃度(0.5、1、2 g/L)的U0126與NMDA聯合處理組。對照組皮層注射1μL生理鹽水,單純U0126處理組注射1μL的U0126(2 g/L),U0126+NMDA 組于NMDA 注射前30 min 分別注射1 μL 0.5、1、2 g/L的U0126,各組均處理24 h。
1.5 HE 染色 將造模完成后的大鼠水合氯醛腹腔注射麻醉,打開胸腔,從心尖部插入至升主動脈,灌注預冷的磷酸鹽緩沖液(PBS)150 mL,斷頭法處死后剝取完整腦組織于4%多聚甲醛中固定15 h。將腦組織置于大鼠腦模具中,以針刺點為中心,前后各切2 mm,然后取腦組織。將4 mm厚腦組織切片分別經梯度乙醇脫水、二甲苯透明后浸蠟包埋,切片。將切片組織脫蠟、脫水后蘇木精染色2 min,伊紅染色1 min,后再次經梯度乙醇脫水脫色、二甲苯梯度透明后中性樹膠封片,然后于顯微鏡下觀察組織細胞形態變化。
1.6 組織免疫熒光染色 將低溫冰凍切片室溫下復溫15 min后于冰丙酮中固定10 min,PBS洗滌3遍,0.3%Triton X-100 破膜15 min,PBS 洗滌3 遍,5%BSA 室溫封閉1 h 后滴加NeuN(1∶1 000)、p-ERK1/2(1∶50)一抗混合液于4 ℃過夜。次日PBS 洗滌3 遍后滴加相應種屬二抗(1∶120)混合液常溫避光孵育1 h,PBS洗滌3遍后滴加DAPI,封片后于熒光顯微鏡下觀察。
1.7 蛋白質免疫印跡實驗 取距入針部位前后左右各3 mm的正方形腦皮層組織,組織剪剪碎后每100 mg腦組織加入1 mL 裂解液于冰上超聲勻漿、裂解30 min。4 ℃,13 000 r/min離心15 min 取上清。BCA 法測定蛋白濃度,各組取50μg 蛋白,經10%SDS-PAGE 凝膠電泳(80 V,30 min 后120 V,50 min),電轉法將蛋白轉至PVDF 膜(100 V,70 min),5%脫脂奶粉封閉1 h,選擇相應一抗4 ℃孵育過夜[小鼠抗GAPDH抗體、小鼠抗總ERK1/2抗體、小鼠抗磷酸化-ERK1/2(p-ERK1/2)抗體、小鼠抗Caspase-3(活化形式)抗體、小鼠抗COX-2抗體稀釋比例均為1∶200,兔抗iNOS抗體稀釋比例為1∶1 000]。室溫下將膜與相應HRP標記二抗(1∶5 000)孵育1 h,之后進行ECL化學顯影。使用Image J軟件進行條帶灰度值測定。
1.8 統計學方法 采用GraphPad Prism 6.0統計軟件進行統計分析。符合正態分布的計量資料以均數±標準差()表示,對照組與正常組比較用獨立樣本t檢驗,NMDA不同濃度及不同時間組分別與對照組相比用單因素方差分析;U0126處理中,U0126組與正常組比較用獨立樣本t檢驗,NMDA 組與U0126 不同濃度處理組之間的比較用單因素方差分析。P<0.05表示差異有統計學意義。
2 結果
2.1 NMDA 引起大鼠皮層興奮毒性損傷 50、100、200 mmol/L的NMDA注入大鼠皮層后24 h,其炎癥、凋亡相關指標COX-2、iNOS、Caspase-3(活化形式)均明顯增高(P<0.05),且具有NMDA 濃度依賴性,選200 mmol/L NMDA 作后續實驗;同時,200 mmol/L的NMDA 皮層注射3、6、12、24 h 后,COX-2、iNOS、Caspase-3(活化形式)隨時間增加而明顯增高(P<0.05),見圖1。HE染色結果顯示,與對照組相比,給予NMDA(200 mmol/L)處理24 h 后,低倍鏡下可見皮層有明顯損傷灶,高倍鏡下可見核固縮,胞質濃縮,細胞體積減小,細胞排列紊亂,見圖2。
2.2 NMDA 激活MAPK/ERK1/2 信號通路 與NMDA 致皮層興奮毒性損傷的結果相似,大鼠p-ERK1/2 的表達水平也隨NMDA 處理濃度和處理時間的延長而升高,呈現濃度和時間依賴性,但總ERK1/2 表達未見明顯變化,見圖3。同時進行p-ERK1/2 與神經元標記物NeuN 免疫熒光雙染色顯示,與對照組相比,200 mmol/L NMDA 組p-ERK1/2熒光信號明顯增加,且大部分可與NeuN 信號疊加,提示p-ERK1/2主要表達于神經元細胞中,見圖4。
2.3 U0126保護大腦皮層興奮毒性損傷 與NMDA組相比,U0126單獨處理時COX-2、iNOS、Caspase-3(活化形式)及p-ERK1/2 表達均明顯降低(P<0.05);同時0.5、1、2 g/L 的U0126 與NMDA(200 mmol/L)聯合處理的結果顯示,隨著U0126濃度的增加,COX-2、iNOS、Caspase-3(活化形式)及p-ERK1/2表達均明顯降低(P<0.05),總ERK1/2表達未見明顯變化(P>0.05),見圖5、6。HE染色可見U0126單獨處理組與NMDA 組相比,相同解剖層面的損傷面積明顯減小,見圖7。
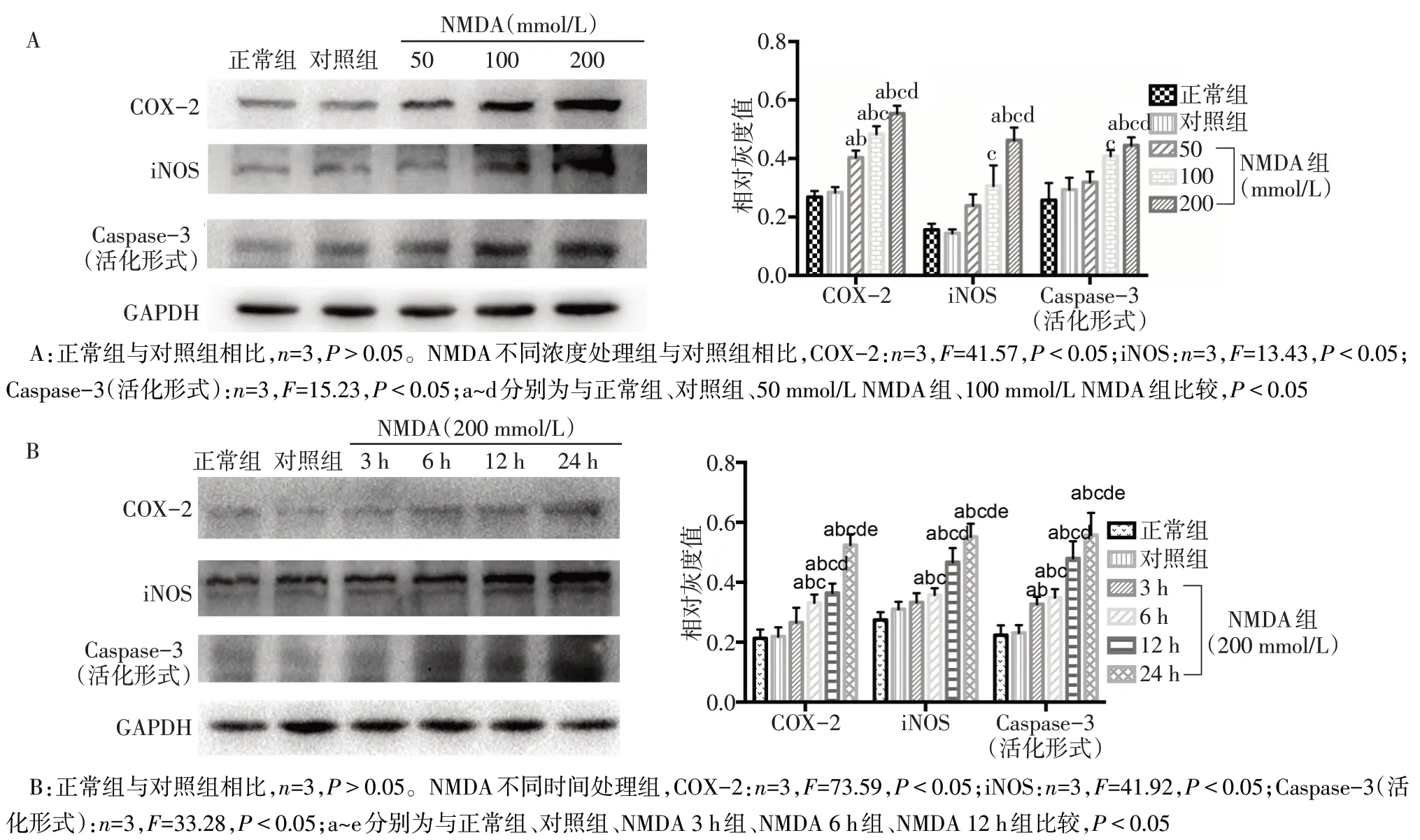
Fig.1 Effects of NMDA with different time points and different concentrations on the expressions of COX-2,iNOS and Caspase-3(active form)proteins圖1 NMDA不同時間及不同濃度處理對COX-2、iNOS、Caspase-3(活化形式)蛋白表達的影響
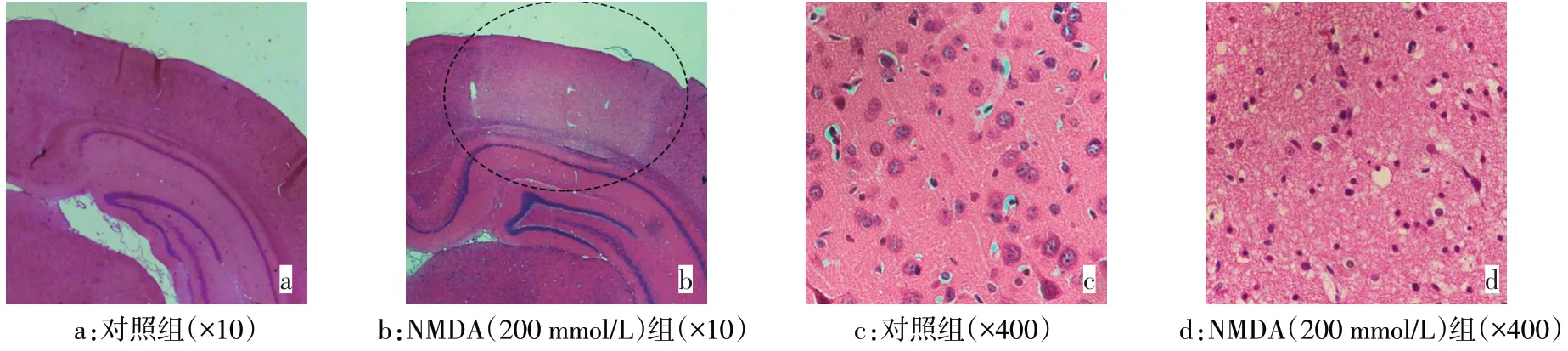
Fig.2 Cortical damage induced by NMDA treatment in rats(HE staining)圖2 NMDA處理引起大鼠皮層損傷(HE染色)
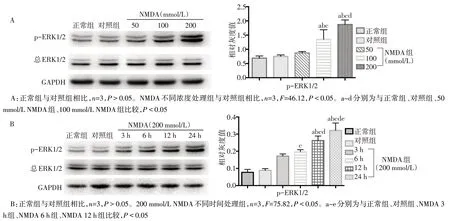
Fig.3 Effects of NMDA with different time points and different concentrations on the expression of p-ERK1/2圖3 NMDA不同時間及不同濃度處理對p-ERK1/2表達的影響
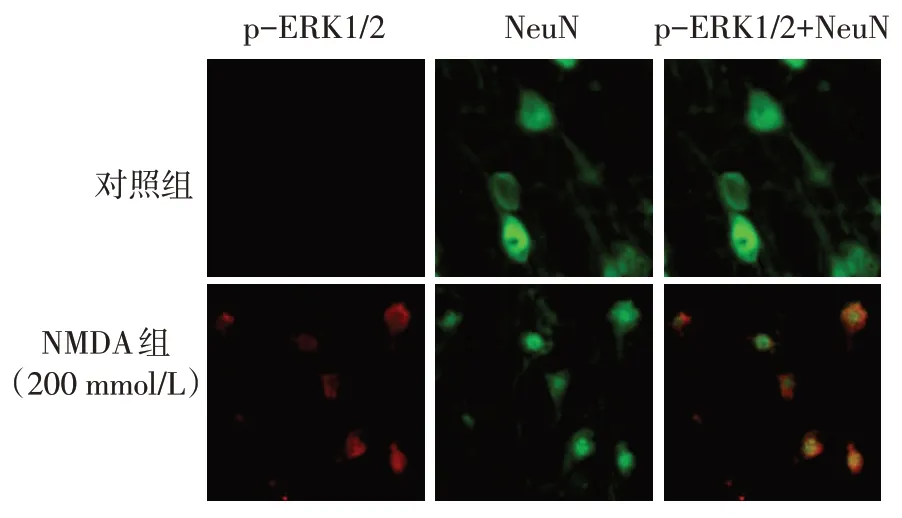
Fig.4 The effect of NMDA on p-ERK1/2 expression(Immunofluorescence staining,×400)圖4 NMDA對p-ERK1/2表達的影響(免疫熒光染色,×400)
3 討論
谷氨酸受體是中樞神經系統最主要的興奮性神經遞質受體,已知約1/3 的中樞神經系統神經元的信息傳遞需要谷氨酸及其受體的參與,這些神經元主要分布在大腦皮質和海馬。根據其作用方式、功能不同可被分為兩大類——代謝型受體和離子通道型受體。代謝型谷氨酸受體屬于G 蛋白偶聯受體,可參與調控細胞神經興奮、突觸的形成以及神經變性的信號轉導過程。離子型受體是配體介導的通道型受體,包括NMDA受體、α-氨基-3-羥基-5-甲基-4-異惡唑丙酸(AMPA)受體和紅藻氨酸(KA)受體,它們可與鈉、鉀、鈣等離子通道偶聯,形成受體離子通道復合物,從而介導細胞間快信號的傳導。已有文獻證明谷氨酸的神經毒性主要通過NMDA受體介導[15-17],有很少部分通過AMPA 及KA 受體,其原理為大量鈣離子內流造成鈣超載,觸發下游通路,導致活性氧的產生和線粒體功能障礙,繼而造成神經元損傷[18-19]。因此,筆者選用NMDA 大腦皮層微量注射來制作谷氨酸神經毒性損傷模型。

Fig.5 The inhibitory effect of U0126 treatment on NMDA-induced expressions of COX-2,Caspase-3(activated form)and iNOS圖5 U0126處理對NMDA誘導的COX-2、Caspase-3(活化形式)、iNOS表達的抑制作用

Fig.6 The inhibitory effect of U0126 treatment on NMDA-induced the expression of p-ERK1/2圖6 U0126處理對NMDA誘導的p-ERK1/2表達的抑制作用

Fig.7 The protective effect of U0126 on NMDA damage(HE staining,×10)圖7 U0126處理對NMDA損傷的保護作用(HE染色,×10)
MAPK/ERK1/2 是存在于細胞內的絲氨酸和蘇氨酸蛋白激酶,其可使蛋白質磷酸化修飾,是多種信號的交匯點。其上游激酶MEK1/2通過引起MAPK/ERK1/2磷酸化而對其具有激活作用。MAPK/ERK1/2激活后,p-ERK1/2可轉位入核,對一些核轉錄因子的反應基因進行表達調控。U0126通過特異性抑制MEK1/2,從而在體內和體外抑制ERK1/2 的激活[20-21]。本研究中,NMDA 處理3 h 即可引起p-ERK1/2 表達增加,該作用一直持續至24 h,由此提示,NMDA處理可引起大腦皮層ERK1/2大量激活。
已有文獻證明ERK1/2 激活參與了谷氨酸興奮毒性損傷的多種信號途徑。例如,ERK1/2激活可介導炎性因子IL-1、IL-6、TNF-α的表達[22];ERK1/2激活可引起NADPH 氧化酶關鍵催化亞基gp91phox 的表達增加[23];另外,ERK1/2 激活還可介導與細胞凋亡有關的NF-κB 的表達增加[24]。筆者也觀察到NMDA 在引起腦組織損傷的同時,濃度依賴性地誘導炎性、凋亡相關因子COX-2、iNOS 及活化的Caspase-3 表達。同時,給予ERK1/2 抑制劑U0126后,隨著U0126 濃度的增加,NMDA 引起的ERK1/2活化被顯著抑制,且大腦皮層損傷面積減小,COX-2、iNOS 及活化的Caspase-3 表達明顯降低。由此,筆者推測U0126通過阻斷MAPK/ERK1/2途徑,抑制細胞的炎性反應及凋亡,減少大腦皮層興奮毒性損傷。另外,與單純抗炎、抗氧化或抑制細胞凋亡相比,由于ERK1/2激活參與介導了NMDA引起的多種損傷途徑,ERK1/2抑制劑對這些途徑能夠同時具有抑制作用,因此可能具有更好的保護效果。
盡管ERK1/2的早期激活介導了一系列炎癥、凋亡反應,但同時它的激活也參與了晚期組織細胞的修復再生。有文獻證實ERK1/2通過促進上皮細胞、成纖維細胞的增殖參與了損傷后上皮細胞的修復和損傷后纖維化,同時ERK1/2參與了Egr-1基因對生長因子表達的調控,從而參與新生血管的形成[25-27]。因此,推測ERK1/2抑制劑(U0126等)需要在谷氨酸興奮毒性損傷早期給予,這樣既可抑制ERK1/2的激活及其介導的損傷反應,也可避免干擾晚期ERK1/2激活介導的腦組織自我修復及再生。U0126 及PD98059 等為第一代ERK1/2 抑制劑,新型ERK1/2抑制劑,如SCH772984 和已經應用于臨床的維羅非尼(Vemurafenib)等目前只是應用于部分腫瘤患者的治療及研究[28-29],期待更多開展新型ERK1/2抑制劑對谷氨酸興奮毒性損傷的相關研究。
綜上所述,ERK1/2抑制劑U0126對于谷氨酸引起的神經毒性損傷具有明顯的保護作用,其機制可能與抑制ERK1/2激活及其下游的炎癥、凋亡信號途徑有關。

