艾煙可吸入物對大鼠神經細胞氧化損傷的影響
李丹 俞云 李圓君 惠鑫 王昊 韓麗 王晶 趙百孝
摘要:目的? 探討艾煙可吸入物(PM10)對大鼠神經細胞氧化損傷的影響及PI3K/Akt信號通路在其中的作用。方法? 采用24 h內新生SD大鼠乳鼠前額葉皮質及海馬組織體外培養原代神經細胞,H2O2誘導建立氧化損傷細胞模型;隨機分為空白組、氧化損傷組、氧化損傷+PM10組、氧化損傷+PM10+抑制劑組、PM10組。采用TUNEL和DAPI染色觀察神經細胞凋亡形態;MTT法及Western blot分別檢測細胞存活率及目的蛋白表達,并用PI3K/Akt通路抑制劑LY294002驗證作用通路。結果? MTT檢測顯示,200 μmol/L H2O2能降低神經細胞50%存活率(P<0.001),0.1、0.5 ng/mL艾煙PM10能明顯抑制H2O2誘導氧化損傷的神經細胞凋亡(P<0.001);TUNEL和DAPI染色顯示,0.5 μg/mL艾煙PM10能拮抗H2O2誘導氧化損傷神經細胞凋亡的形態學變化(P<0.001);Western blot檢測顯示,H2O2及LY294002能降低p-Akt、Bcl-2的表達(P<0.05,P<0.001),上調active-Caspase-3的表達(P<0.01,P<0.001),而艾煙PM10作用相反(P<0.01,P<0.001)。結論? 艾煙PM10能減少神經細胞氧化應激的凋亡,其機制可能是激活PI3K/Akt信號通路并調控下游凋亡蛋白Bcl-2、active-Caspase-3的表達,拮抗細胞凋亡。
關鍵詞:艾煙PM10;過氧化氫;細胞凋亡;PI3K/Akt信號通路;大鼠
中圖分類號:R245? ? 文獻標識碼:A? ? 文章編號:1005-5304(2019)04-0042-05
氧化應激是指活性氧簇(ROS)的生成和清除失平衡狀態,這一病理過程與許多疾病發生發展密切相關。艾煙可吸入物(PM10)是傳統中醫灸法的燃燒產物,含有多種生物活性成分[1-2],具有抗氧化應激、抗自由基、殺菌等作用[3-8]。近年研究表明,艾煙能激活PI3K/Akt信號轉導通路,從而產生作用[9]。相關研究表明,激活PI3K/Akt信號轉導通路可抑制H2O2引起的氧化損傷,從而延緩疾病的發生發展[10]。本實驗采用H2O2誘導建立原代神經元氧化損傷模型,予艾煙PM10預處理,觀察其對H2O2介導神經元損傷的保護作用,并通過加入PI3K/Akt信號通路阻斷抑制劑LY294002闡明其作用機制。
1? 實驗材料
1.1? 動物
新生1日齡SD大鼠乳鼠3只,北京大學醫學部實驗動物中心提供,動物許可證號SCXK(京)2016-0006。所有乳鼠飼養于SPF級動物室,室溫20~25 ℃,相對濕度60%~80%,保持通風,定時換氣,每日光照12 h。
1.2? 主要試劑與儀器
MTT、DAPI、多聚賴氨酸溶液(美國Sigma公司),TUNEL試劑盒(美國CST公司),MEM EARLES(美國Invitrogen公司),谷氨酰胺、B27(美國Invitrogen公司),阿糖胞苷(美國Sigma公司),胎牛血清、馬血清、胰蛋白酶(美國Invitrogen公司),Bcl-2抗體、active-Caspace-3抗體(美國Invitrogen公司),p-Akt和T-Akt抗體(美國Invitrogen公司),LY294002(美國CST公司)。CKX41-倒置顯微鏡(日本Olympus公司),5417R高速冷凍離心機(德國Eppendodf公司),熒光/吸收光酶標儀(美國Therm公司),Tanon4200化學發光成像儀(上海天能)。
2? 實驗方法
2.1? 艾煙可吸入物制備
實驗用艾條為南陽漢醫艾絨有限責任公司三年蘄艾條。將艾絨置于玻璃箱中點燃,將Mini VolTM PM10便攜式采樣器置于玻璃箱中采集煙霧,吸附在劍橋濾片上。采樣前后劍橋濾片的質量差即為采集的艾燃燒產物的質量。用DMSO溶解PM10制成終濃度為100 mg/mL的艾燃燒生成物原溶液,除菌過濾并避光存儲于-80 ℃冰箱備用。每次實驗前用培養液稀釋至所需濃度(DMSO濃度≤1%)。
2.2? 分組和造模
實驗隨機分為空白對照組、氧化損傷組、氧化損傷+PM10組、氧化損傷+抑制劑+PM10組、PM10組。原代神經元培養:從新生SD大鼠分離海馬及前額葉腦組織,0.25%胰蛋白酶消化、離心細胞并重新懸浮。將細胞鋪覆在用多聚賴氨酸涂覆的板上,培養2~4 h,2%馬血清、2%B27和1%GlutaMAX MEM EARLES繼續培養,3 d后10 nmol/L阿糖胞苷處理細胞抑制膠質細胞生長。用前細胞培養7~8 d。
2.3? 干預
培養7 d后,不同濃度PM10(自制)加入到原代神經細胞培養基24 h,或用200 μmol/L H2O2處理神經元24 h構建神經細胞氧化應激損傷模型。在研究藥物作用通路的實驗中,用Akt抑制劑LY294002(終濃度10 μmol/L)提前處理細胞30 min。再用PM10處理細胞。
2.4? 指標檢測
2.4.1? MTT法檢測細胞存活率
給藥后繼續孵育細胞24 h,之后每孔加入MTT(終濃度0.5 ng/mL),于37 ℃、5%CO2培養箱中避光繼續孵育24 h,吸去培養液,每孔加入150 μL DMSO液,待孔內顆粒完全溶解后,酶標儀570 nm處測定各孔吸光度,計算各組細胞存活率[細胞吸光度-空白孔吸光度)÷(對照組細胞吸光度-空白孔吸光度)×100%]。
2.4.2? TUNEL法檢測細胞凋亡
4%PFA和4%蔗糖在PBS中固定細胞30 min,PBS洗滌后,加入0.1%Triton X-100和0.1%檸檬酸鈉的PBS冰育2 min。用PBS洗滌2次后加適量TUNEL檢測液,37 ℃避光孵育60 min,PBS洗滌后加適量DAPI,37 ℃避光孵育60 min,PBS洗滌3次。用抗熒光淬滅封片液封片后熒光顯微鏡下觀察。TUNEL染色細胞凋亡的細胞核為綠色熒光,DAPI染色細胞核為藍色熒光。細胞凋亡百分率通過計算比值來確定。TUNEL陽性細胞數在1個計數中共100個細胞。取5個計數的平均值為神經元細胞死亡的百分比。
2.4.3? Western blot檢測蛋白表達
各組按實驗設計給藥后繼續孵育細胞24 h,洗滌后裂解細胞,冰上反應30 min,離心,取上清液。BCA法測定各組蛋自濃度,將每個樣品蛋白濃度調成一致,10%SDS-PAGE分離蛋自質,PVDF轉膜后奶粉封閉30 min,一抗(1∶1000)孵育過夜(4 ℃),TBST洗3~5次,二抗(1∶1000)室溫孵育1 h,TBST漂洗,化學發光成像儀檢測蛋白表達量。
3? 統計學方法
采用SPSS17.0統計軟件進行分析。實驗數據以x(—)±s表示,兩組間進行獨立本t檢驗。檢驗水準α=0.05。
4? 結果
4.1? MTT檢測結果
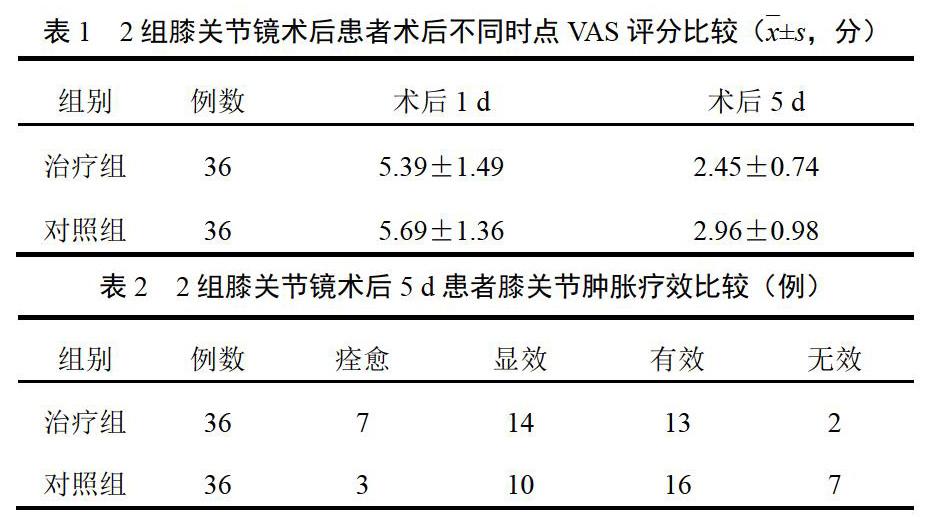
與空白對照組比較,氧化損傷組細胞存活率明顯降低(P<0.001),表明造模成功。加入0.1、0.5 ng/mL PM10能提高氧化損傷細胞的存活率,與氧化損傷組比較差異有統計學意義(P<0.01,P<0.001)。另外,相同濃度PM10組較空白對照組細胞存活率略高(P<0.05),表現出一定濃度PM10對細胞凋亡的保護作用。提示PM10對H2O2誘導神經細胞的氧化應激損傷具有抑制作用。結果見圖1。
4.2? TUNEL和DAPI染色結果
相近細胞數目情況下,氧化損傷組較空白對照組細胞凋亡率明顯增加(P<0.01)。氧化損傷+PM10組較氧化損傷組細胞凋亡率下降(P<0.001)。提示PM10對H2O2誘導神經細胞凋亡損傷有抑制作用。結果見圖2、圖3。
4.3? Western blot檢測結果
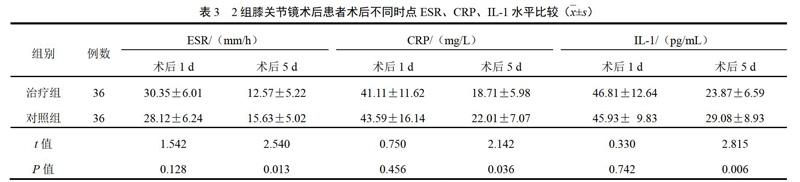
與空白對照組比較,氧化損傷組細胞p-Akt蛋白表達量明顯下降(P<0.001);與氧化損傷組比較,氧化損傷+PM10組神經細胞p-Akt蛋白表達量明顯增加(P<0.01);加入PI3K/Akt通路抑制劑LY294002后,與氧化損傷+PM10組比較,PM10這種拮抗作用消失(P<0.05),提示PI3K/Akt信號通路參與了PM10拮抗H2O2誘導的神經細胞損傷的保護作用。結果見圖4。
與氧化損傷組比較,氧化損傷+PM10組細胞Bcl-2表達明顯增加(P<0.001),而加入PI3K/Akt通路抑制劑LY294002后,與氧化損傷+0.5 ng/mL PM10組比較,PM10拮抗作用消失(P<0.05),提示PI3K/Akt信號通路及其調控的凋亡蛋白Bcl-2參與了PM10拮抗H2O2誘導的神經細胞損傷的保護作用。結果見圖5。
與氧化損傷組比較,氧化損傷+PM10組神經細胞active-Caspase-3表達量下調(P<0.01),而加入PI3K/Akt通路抑制劑LY294002后,與氧化損傷+0.5 ng/mLPM10組比較,PM10拮抗作用明顯減弱(P<0.01),提示PI3K/Akt信號通路及其調控的凋亡蛋白active-Caspase-3參與了PM10拮抗H2O2誘導的神經細胞損傷的保護作用。結果見圖6。
5? 討論
氧化應激是指細胞暴露于高濃度氧分子或氧的化學衍生物而引起的細胞損傷。生理條件下的ROS物質能刺激細胞生長,抗氧化系統與其抗衡,當平衡狀態被破壞,自由基等大量聚集,引起人體脂質過氧化及蛋白質等變性,導致細胞膜的流動性和通透性發生改變,最終導致細胞結構和功能改變[11]。
H2O2是一種易于獲得的重要ROS,性質相對穩定,極易透過細胞膜,與細胞內鐵離子通過FENTON反應形成高活性的自由基,導致一系列反應,已成為研究各類細胞氧化損傷的重要工具[12]。故本實驗選擇H2O2處理神經細胞建立氧化應激損傷模型,并通過MTT檢測細胞存活率來驗證造模是否成功。
氧化應激是許多疾病的誘發因素和病理過程[12],與心腦血管疾病的發生發展息息相關,是阿爾茨海默病的病因假說。因此,緩解細胞組織的氧化應激損傷無疑成為一種有效防治這類疾病的潛在方案。目前許多在體實驗已經證實艾煙能減緩阿爾茨海默病氧化應激損傷,從而防治其發生發展[13-15]。本實驗采用神經元原代培養方法,采用MTT、DAPI和TUNEL方法檢測細胞損傷情況,Western blot驗證作用通路相關蛋白,實驗結果顯示終濃度為200 μmol/L H2O2處理組細胞存活率為50%左右,與正常對照組比較,差異有統計學意義(P<0.01,P<0.001)。0.5 ng/mL PM10預先干預氧化損傷細胞,可顯著減少細胞凋亡,與氧化損傷組比較,差異有統計學意義(P<0.001),與Western blot結果一致。實驗發現PM10作用于氧化損傷細胞,激活PI3K/Akt信號通路,增加p-Akt、Bcl-2下游蛋白表達,并抑制active-Caspase3的表達(P<0.01,P<0.001),當加入Akt通路阻斷劑LY294002后,各相關蛋白結果相反,證實了其作為通路之一為PI3K/Akt信號通路的假設。
艾灸已被用于治療各種類型的疾病,但仍無足夠的證據直接證明其有效性。本實驗首次證明了PM10對神經細胞氧化誘導凋亡的保護作用,特別是對阿爾茨海默病相關細胞的影響,結果可作為證明艾灸有效性的證據之一,其中艾煙也被驗證成為艾灸起效的關鍵因素,同時為治療阿爾茨海默病提供潛在防治方案,而PM10起效濃度、混合物的純化及相關研究仍需進一步深入完善。
參考文獻:
[1] ZHOU C L, FENG X M, WANG J H, et al. Research advance on moxa smoke[J]. Journal of Acupuncture and Tuina Science,2011,9(2):67-72.
[2] YU M, JIN R, ZHAO B, et al. SPME-GC-MS determination of phenol in the smoke of moxa[J]. Chinese Journal of Pharmaceutical Analysis,2012,32(10):1870-1873.
[3] XU H, ZHAO B, CUI Y, et al. Effects of moxa smoke on monoamine neurotransmitters in SAMP8 mice[J]. Evid Based Complement Alternat Med,2013,2013:178067.
[4] HUANG J, LIN M Y, ZHAO B, et al. PM10 mass concentration and oxidative capacity of moxa smoke.[J]. Qjm,2015,108(9):705-710.
[5] HITOSUGI N, OHNO R, HATSUKARI I, et al. Diverse biological activity of Moxa extract and smoke[J]. Vivo,2001,15(3):249-254.
[6] SAKAGAMI H, MATSUMOTO H, SATOH K, et al. Cytotoxicity and radical modulating activity of Moxa smoke[J]. Vivo,2005,19(2):391-397.
[7] MATSUMOTO H, SHIMADA J, NAGASAKA H, et al. Inhibition by Moxa smoke of NO production and iNOS expression in mouse macrophage- like cells Raw 264.7[J]. Vivo,2005,19(2):471.
[8] MENG X N, HUAN-FANG X U, CUI Y X. Effect of moxa products after burning on SOD, MDA and GSH-Px in the brain of senescence accelerated mice[J]. Global Traditional Chinese Medicine,2011, 4(6):413-415.
[9] 劉耀萌,劉鈞天,黃暢,等.不同艾灸因素對阿爾茨海默小鼠PI3K/AKT通路與皮質β淀粉樣蛋白沉淀的影響[J].世界中醫藥,2016,11(8):1395-1400.
[10] 蘇倩.Akt信號通路通過激活TFEB而抑制氧化應激誘導的神經細胞凋亡[D].石家莊:河北醫科大學,2017.
[11] 朱若岑,蔣維維,譚柱良,等.動物體內活性氧、氧化應激與細胞凋亡以及抗氧化劑研究進展[J].中獸醫醫藥雜志,2015,34(3):21-25.
[12] 塔依爾·吐爾松,買吾拉尼江·依孜布拉,努爾買買提·艾買提.神經退行性疾病的抗氧化研究進展[J].新疆醫科大學學報,2017,40(6):725-729.
[13] 劉鈞天,黃暢,劉耀萌,等.艾灸各因素對APP/PS-1雙轉基因AD小鼠腦中DNA、蛋白質、脂質氧化應激的影響[J].中華中醫藥雜志,2015, 40(5):1375-1379.
[14] 蔡虹,鄔繼紅,趙百孝,等.艾煙冷凝物對大鼠肺泡巨噬細胞NR8383活性和吞噬功能的影響[J].北京中醫藥大學學報,2013,36(7):501- 504.
[15] 黃暢,崔瑩雪,劉鈞天,等.艾灸及艾煙對載脂蛋白E基因敲除小鼠血清MDA、SOD水平的影響[J].世界中醫藥,2016,11(8):1407-1409,1413.
(收稿日期:2018-11-14)
(修回日期:2018-12-01;編輯:華強)

