反相高效液相色譜法測定 人血漿中卡馬西平濃度及其臨床應用
謝燕如 黃 璞 和 凡 楊紅梅 莫小蘭 陳怡祿*
卡馬西平(CBZ)是臨床上常用的情感穩定劑之一[1],結構式見圖1。CBZ 對精神運動性發作最佳,應用于局限性大發作和混合型發作治療效果顯著[2],是臨床治療兒童神經運動性發作時首選用藥[3]。此外CBZ 也可用于脊髓癆和多發性硬化、糖尿病性周圍性神經痛、患肢痛和外傷后神經痛以及皰疹發作神經痛。口服CBZ 在人體內吸收緩慢并且不規則,個體差異較大,1~2 周內基本達到穩態血藥濃度[4]。CBZ 的療效和不良反應與血藥濃度成正相關,單純依靠臨床觀察,很難判定療效或毒性[5-6]。患者個體 生理特性、病理狀況和CBZ 代謝酶活性等方面的差異也會導致藥動學參數如表觀分布容積(Vd)、峰濃度(Cmax)及達峰時間(Tmax)、清除速率(CL)和藥-時曲線下面積(AUC)等不同[7-8]。同時CBZ 為肝藥酶誘導劑,能發生自身誘導作用,長期使用其半衰期(t1/2)下降,導致藥效減弱和耐藥性增加;并且CBZ 治療窗較窄,有效血藥濃度為4~12 μg/ml[4]。因此為了方便評價CBZ 療效和制訂個體化給藥方案,對CBZ 進行治療藥物監測(therapeutic drug monitoring,TDM),保障患者用藥安全和有效具有積極的臨床參考價值[2]。本研究參照已發表的文獻[2-10],建立了一種可靠、穩定、快速和準確的方法測定人血漿中CBZ 濃度,以應用于臨床血藥濃度監測。CBZ 在286 nm 處有較佳紫外吸光度。見圖2。
圖1 CBZ 結構式

圖2 CBZ 在190~400 nm 范圍內DAD(UV)掃描圖譜
1 儀器與試劑
1.1 儀器
高效液相色譜儀(Agilent 1260),包括四通道脫氣機G1366A、四通道自動調配器G1366C、定量環為1~100 μl 自動進樣器G1339B、溫度控制模塊G1336B、二極管陣列紫外檢測器(DAD)G4216C、可調柱溫恒溫箱G1316B 和Agilent 色譜化學分析工作站。其他相關配置儀器:普通離心機(上海醫科大學儀器廠);高速離心機(15000 r/min 美國EPPENDORF);旋渦混合振蕩器(河北安新儀器廠);真空干燥箱(中德合資MMM-GROUP);電子天平(精確度為十萬分之一,德國SARTORIUS);小型超純水儀(法國MILLIPORE);超聲清洗儀(河北安新儀器廠)。
1.2 實驗用對照品
CBZ 對照品(Sigma 生物制品公司,批號:SL136523803,規格:99%);內標對照品多潘立酮(Sigma 生物制品公司,批號:CF132726915,規格:>99%)。
1.3 試劑與試藥
色譜級甲醇(德國默克股份兩合公司,批號:10947807815);色譜級乙腈(德國默克股份兩合公司,批號:10965807832);色譜級提取劑乙酸乙酯(德國默克股份兩合公司,批號:10953267213);水為超純水儀處理后的去離子水,2 ml 和1.5 ml 的EP 離心管(浙江拱東醫療科技有限公司),其他試劑均為色譜級。
2 方法與結果
2.1 對照品和內標物的稱量及工作液的配制
用電子分析天平精密稱取CBZ 10.0 mg,置于10 ml 棕色容量瓶中,加3 ml 甲醇振蕩溶解后再加甲醇定容至10.0 ml 刻度線,得到1.0 mg/ml 對照品工作母液,放置-20℃冰箱保存。用電子分析天平精密稱取內標物多潘立酮10.0 mg,置于10 ml 棕色容量瓶中,加3 ml 甲醇振蕩溶解后再加甲醇定容至10.0 ml 刻度線,得到1.0 mg/ml 內標物工作母液,放置-20℃冰箱保存,使用時用甲醇稀釋成濃度為200.0 μg/ml 的內標液。
2.2 色譜條件
色譜柱:ZORBAX Eclipse Plus-C18 反相色譜柱(150 mm×4.6 mm,5 μm);流動相:去離子水∶乙腈∶甲醇(30∶10∶60);流速:1.0 ml/min;柱溫:35 ℃;檢測波長:288 nm;步進值2 nm,帶寬4 nm;儀器靈敏度:0.01 AUFS;色譜柱柱效參數:理論塔板數12600。
2.3 血漿樣品前處理
吸取0.4 ml 含CBZ 血漿加至2 ml EP 離心管中,精確加入200.0 μg/ml 內標液20 μl,置振蕩器上渦旋數十秒。再加提取劑乙酸乙酯1.5 ml 左右,密塞,渦旋振蕩3 min,置于高速離心機(15000 r/min)內離心5 min。將上清液移取至1.5 ml EP 離心管內,最后放進干燥箱,35 ℃真空抽干。檢測時吸取100 μl流動相復溶提取物,置于高速離心機內離心2 min,吸上清復溶物進樣,設置進樣體積為10 μl。
2.4 色譜分離效果
在“2.2 和2.3”實驗條件下,空白血漿樣品、空白血漿加CBZ 對照品和內標物以及患者服用CBZ達穩態時血漿樣品,經HPLC 測定,得到一系列色譜圖(圖3)。圖A 是空白血漿按“2.3”項下操作后所得到的色譜圖;圖B 是空白血漿加內標和CBZ 對照品按“2.3”項下(濃度均為10.0 μg/ml)處理后所獲得的色譜圖;最后圖C 是1 例患者服用CBZ(300 mg/d)達穩態時血清樣品處理后的色譜圖。從圖3可看到,內標物和CBZ 的色譜峰可以完全分離(分離度R>1.5),沒有其他雜質峰干擾,由此可見本方法具有較好的專屬性。內標和CBZ 保留時間分別為3.758、5.836 min。
2.5 干擾性試驗
臨床上CBZ 通常與其他情感穩定劑合用治療癲癇或情感障礙患者,本實驗取與CBZ 常聯合使用的藥物拉莫三嗪、丙戊酸鈉、乙酰唑胺、氯氮平、奧氮平、地西泮、氯硝西泮等適量,依照上述色譜條件下進行色譜分析,結果顯示上述藥物的色譜峰均不干擾CBZ 與內標物的分離。
2.6 校正曲線的設計和線性關系
在7 個2 ml EP 離心管中分別加入不同濃度、體積相同的CBZ 對照品工作液20.0 μl,置于干燥箱內,35 ℃真空抽干后加空白血漿0.4 ml,旋渦振蕩數十秒,配置成分別相當于1.0、2.0、4.0,8.0、16.0、32.0、48.0 μg/ml 的血漿CBZ 濃度,然后按“2.3”方法處理。經HPLC 分析后,將檢測得到CBZ 峰面積與內標物峰面積的比值(F)為縱坐標,以血漿樣品相對應各點CBZ 濃度(C)為橫坐標擬合校正曲線。應用加權最小二乘法對數據進行線性回歸,權重W =1/χ2,使用權重可以減小低濃度的誤差[11]。處 理數據后得到CBZ 1.0~48.0 μg/ml 的校正曲線;線性方程為:C =40.538F-0.018,相關系數(r)=0.9998,可見CBZ 在此濃度范圍線性關系優良(見圖4)。當 信號與躁音比值(信躁比)等于3 時,CBZ 的檢測限可達到0.5 μg/ml。
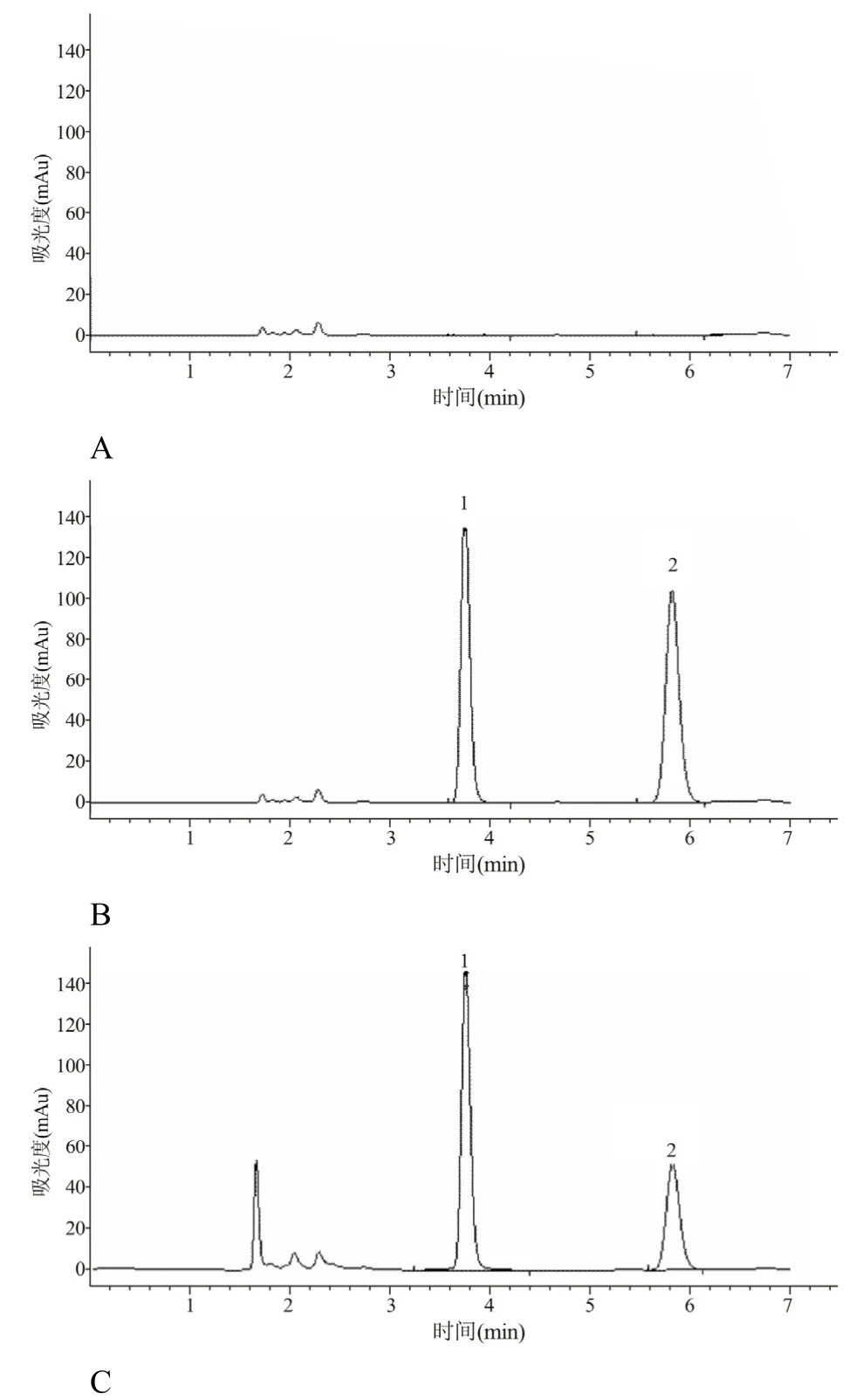
圖3 CBZ 的高效液相色譜圖

圖4 CBZ 的校正曲線
2.7 回收率和精密度實驗
按“校正曲線設計”方法配制CBZ 低、中、高不同質量濃度(2.0、8.0、32.0 μg/ml)的血漿樣品,按“2.3”方法處理后,經色譜檢測后進行分析。以經過血漿基質提取后的峰面積與同濃度對照品直接進樣的峰面積比較,計算提取回收率[12];而CBZ 低、中、高不同質量濃度(2.0、8.0、32.0 μg/ml)的峰面積與其在校正曲線上所得峰面積比較計算相對回收率[12]。計算結果顯示相對回收率接近100%;提取回收率在75%以上。而精密度則是在1 天之內反復5 次和1 周內反復5 次測定其質量濃度,計算批內、批間精密度和方法回收率[12]。結果顯示,本實驗方法符合中國藥典關于人體內“生物樣品定量分析方法驗證指導原則”的要求[12](表1)。
2.8 CBZ 血樣穩定性考察
按“校正曲線設計”方法分別配制低、中、高3 個不同質量濃度(2.0、8.0、32.0 μg/ml)的血漿樣品36 個,每個濃度各12 個。首先室溫放置0、12 h 后檢測,然后在-20℃冰箱凍存24 h、72 h 后進行測定,最后在-20℃冰箱凍存1 周和3 周后再進行色譜分析,統計結果發現RSD 均小于10%(表2),CBZ室溫和凍存樣品的藥物降解符合中國藥典關于人體內藥物分析的要求[11]。
2.9 CBZ 血漿樣品質量控制(quality control,QC)
按“校正曲線設計”方法分別配制低、中、高3 個不同質量濃度(2.0、8.0、32.0 μg/ml)36 個含藥血漿樣品,每個濃度各12 個,置于-20℃的低溫冰箱 凍存,定為質控(QC)樣品。每次進行血樣標本檢測時,標本和QC 樣品的處理都采用平行操作原則,檢測時將QC 樣品均勻分散在待測樣品中間,測定結束后先對6 個QC 樣品進行分析,6 個QC 樣品中只允許2 個不符合要求,且同一濃度的2 個QC 不能同時失控,計算結果的偏差符合中國藥典關于體內藥物分析的要求,則可認定本次檢測結果正常有效[11];相反如果QC 結果偏差超出中國藥典要求,則此次檢測為失控,所得數據不準使用[11]。在實驗操作步驟和儀器性能都正常的情況下,待測標本和QC 樣品需重新處理進行檢測,直到QC 結果符合要求所測數據才可正常使用。
2.10 臨床應用
臨床實例檢測13 例使用CBZ 患者,患者來自本院門診或住院部,口服CBZ 普通片劑(北京諾華制藥集團有限公司,批號:X13282,規格:200 mg/片)。患者服用劑量從每天100 mg 起,臨床根據病情需要調整使用量,待患者病情控制穩定且用藥時間超過一周時,早上用藥前采血檢測其CBZ 穩態血藥谷濃度,所得結果見表3。
3 討論
3.1 建立檢測方法的意義
隨著國家經濟快速發展和人們生活水平不斷提高,以及互聯網的高速發展,患者/或家屬對藥品的認知越來越專業。而醫院方面對患者用藥安全也日益重視,以TDM 方向的藥學保障服務成為臨床藥學重點之一,實驗室開展TDM,改變了醫師單憑感覺或經驗用藥的方法及藥物治療理念[13]。另外由于抗癲癇藥物使用時間較長、毒副反應較強、安全治療窗小、個體間差異大,臨床上單憑過往經驗用藥很難達到理想的治療效果[13],有時甚至會出現藥物過量或中毒情況。因此患者在服用CBZ 等抗癲癇藥時進行定期的TDM 很有必要,根據監測結果來調整給藥方案,既保障患者用藥安全又大大減少臨床用藥的盲目性,因此開展TDM 來制定個體化用藥方案,提高合理用藥水平具有很好的現實意義和臨床意義。
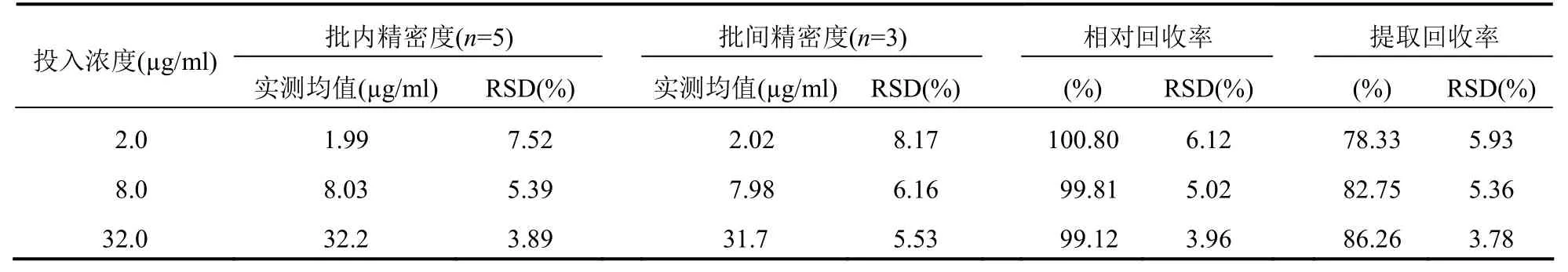
表1 不同質量濃度CBZ 的精密度與回收率

表2 不同質量濃度CBZ 在人血漿中的穩定性(n=5)

表3 13 例患者服用CBZ 后穩態血藥谷濃度
3.2 本實驗方法的優點
CBZ 結構式中有二個苯環,有很強紫外吸收。CBZ 在286 nm 處有較佳紫外吸收,因此本實驗檢測波長定為286 nm,目的是提高定量下限(Lower limit of quantitation LLOQ)的響應值和減小LLOQ 的偏差,對校正曲線的擬合(線性關系)有積極影響。其次關于CBZ 的測定,相關報道有酶聯免疫法(EMIT)、熒光偏振免疫法(FPIA)[6],這些方法需要使用試劑盒,檢測成本高,不便普及;也有蛋白沉淀方法[6],而此雖然操作簡單,但血漿組份內源性雜質多,檢測干擾大。有報道采用外標法,由于基質效應影響,準確度不穩定,偏差較大,難于達到實驗要求[6]。本實驗選擇液-液提取法,具有操作簡單、方法可靠、快速檢測(7 min 內完成色譜分離)以及成本低廉、結果準確、精密度和回收率高等亮點;平均相對回收率接近100%,提取回收率在75%以上,而且校正曲線線性關系優良,專屬性高,批內、批間精密度和穩定性考察結果的RSD 均<10%,符合臨床生物樣品檢測分析方法的基本要求[11]。
3.3 校正曲線的范圍的確定和提取劑的選擇
CBZ 治療窗僅為4~12 μg/ml[3],因此本實驗方法設計的校正曲線符合CBZ 的常規監測。另外本實驗過程中曾分別使用乙醚、正已烷、乙酸乙酯和氯仿為提取劑,發現乙酸乙酯的提取率最理想,且對人體毒性小。采用此提取劑只需一次提取便可達到檢測要求,用流動相復溶后再進行離心,目的是為了減少提取物中的雜質對色譜柱的影響,對延長色譜柱的使用壽命有積極影響,同時所取血漿只需0.4 ml,進樣量10 μl 便可達到檢測要求,大幅度減少了樣品雜質峰的干擾。

