高良姜素通過PI3K/Akt及p38-MAPK信號通路增強胃癌SGC-7901細胞對阿帕替尼的敏感性
賀文煜,張海明,袁昌勁
胃癌是全世界最常見的惡性腫瘤之一,全球胃癌一半以上均發生在中國,其發病率和死亡率僅次于肺癌,居第2位[1]。由于絕大多數胃癌確診時已是中晚期[2],化療成為中晚期和進展期胃癌主要的治療手段。但是傳統化療效果并不理想,超過70%患者總體生存率低于1年,5年生存率低于5%[3]。針對血管內皮生長因子受體2(VEGFR2)的小分子抑制劑阿帕替尼,可以特異性阻斷VEGFR2的ATP結合位點,從而抑制腫瘤血管的生成和細胞的增殖[4]。研究顯示,阿帕替尼可以顯著提高中晚期胃癌患者生存率,對二線化療失敗的患者依然展現了明顯的優勢[5]。但是隨著阿帕替尼的廣泛使用,部分患者會出現阿帕替尼原發性耐藥或繼發性耐藥,進而影響中晚期胃癌的療效。
高良姜素(Galangin,GLA)是從姜科植物高良姜中提取的一種黃酮類化合物,藥理學證實其具有抗氧化、抗菌、抗炎等多種生物活性[6],在乳腺癌、結腸癌、肝癌、胃癌等多種惡性腫瘤中展現出顯著的抗癌活性[7]。但是GLA聯合阿帕替尼對腫瘤細胞的抑制作用尚少見報道。本研究擬從細胞生物學行為角度出發,探討GLA能否增強阿帕替尼對胃癌細胞的抑制作用以及相關機制。
1 材料與方法
1.1材料與試劑 人胃癌SGC-7901細胞株購自中國科學院上海細胞生物所;RPMI-1640培養基購自美國Gibco公司;阿帕替尼購自江蘇恒瑞醫藥股份有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(MTT)、凋亡檢測試劑盒購自索萊寶生物科技有限公司;Matrigel膠和Transwell小室購自美國BD公司;BCA蛋白定量試劑盒、胰蛋白酶(0.25%)、RIPA裂解液購自上海碧云天生物技術有限公司;兔抗人磷酸化蛋白激酶B(Akt)、磷酸化絲裂原活化蛋白激酶(p-Akt)、Bcl-2相關X蛋白(Bax)、B淋巴細胞瘤-2(Bcl-2)單克隆抗體購自武漢博士德生物工程公司;兔抗人p38、p-p38、GAPDH單克隆抗體購自美國Sigma公司。
1.2實驗前處理 細胞培養傳代于含10%胎牛血清、1%雙抗(青霉素+鏈霉素)的RPMI-1640培養基中,置于5%CO2、37℃培養箱。每隔24~48 h更換1次培養液,培養48~72 h傳代1次。將GLA溶于DMSO溶液,配制成終濃度為0、10、20、40、80、160 mg/L的溶液;將阿帕替尼溶于DMSO溶液,配制成終濃度為0、5、10、15、20、25、30 mg/L的溶液;配制好的溶液置于4℃冰箱保存用于后續實驗(0 mg/L溶液為空白對照組,不加任何藥物,僅加等體積DMSO溶液)。
1.3MTT法檢測細胞增殖 收集對數生長期細胞,接種于96孔板(4×103個/孔),再加入RPMI-1640完全培養基使之終體積為100μL。繼續培養24 h,分別加入終濃度為0、100、200、300、400、500、600 mg/L GLA溶液和終濃度為0、5、10、15、20、25、30 mg/L阿帕替尼溶液。每組設置4個復孔,藥物作用48 h后向每孔中加入10μL MTT溶液,37℃孵育1.5 h后終止實驗,利用酶標儀檢測各孔490 nm處的吸光度(A)值。
1.4流式細胞術檢測細胞凋亡 取對數生長期細胞,接種于6孔板,待細胞75%融合時,棄去培養基,加入相應濃度的高良姜素和阿帕替尼,繼續培養24 h。收集上清液,PBS沖洗3遍,加入胰蛋白酶消化細胞;再將消化的細胞和貼壁細胞一并收集,加入冰PBS沖洗3遍,再加入500μL結合緩沖液重懸細胞。加入5μL Annexin-V-FITC,避光室溫孵育15 min,再加入5μL PI孵育5 min,于1 h內上機檢測。
1.5細胞劃痕實驗檢測細胞遷移 將胃癌SGC-7901細胞接種于12孔板,待細胞60%~70%融合時,棄去培養基饑餓12 h,用200μL移液槍槍頭在培養板下劃痕,PBS沖洗3遍,再加入適宜濃度的高良姜素、阿帕替尼和新鮮培養基,分別于劃痕時和培養24 h時對劃痕線拍照,并計算細胞遷移率。細胞遷移率=(0時邊緣距離-24 h時邊緣距離)/0時邊緣距離×100%。
1.6Transwell小室檢測細胞侵襲能力 用不含血清的RPMI-1640培養基按照1∶20稀釋Matrigel膠,向Transwell上室中加入60μL稀釋后Matrigel膠,37℃培養箱放置6 h。首先用不含血清的培養基水化上室1 h,細胞接種于不含血清的RPMI-1640培養基,再加入相應濃度的高良姜素和阿帕替尼。將細胞鋪于上室(1×104個細胞),使之終體積為200μL,下室中加入600μL RPMI-1640培養基。37℃培養24 h,下室棄去培養液,PBS沖洗2遍,加入4%多聚甲醛,室溫靜置30 min固定,再加入0.5%結晶紫靜置10 min,蒸餾水沖洗,棉簽輕輕拭去表面細胞。隨機選擇5個視野拍照,并對細胞計數。
1.7Western blot檢測細胞凋亡及PI3K/Akt及p38-MAPK信號通路相關蛋白表達 取對數生長期細胞,接種于6 cm2的培養瓶,待細胞60%~70%融合時棄去培養基,加入含有相應濃度高良姜素和阿帕替尼的培養液,置于5%CO2、37℃培養箱孵育36 h。加入RIPA裂解液提取總蛋白,BCA試劑盒定量。再加入適量的蛋白緩沖液,沸水高溫變性,取40μg蛋白,進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDSPAGE),轉膜,加入胎牛血清封閉30 min,加入一抗,4℃孵育12 h,包括Ak(t1∶1 000)、p-Ak(t1∶500)、p38(1∶200)、p-p38(1∶500)、Bax(1∶200)、Bcl-2(1∶200)、GAPDH(1∶1 000);然后TBST洗膜,加入辣根過氧化物酶標記的羊抗兔IgG二抗,孵育1.5 h,化學發光儀曝光顯影,以GAPDH為內參,計算目的蛋白的相對表達量。
1.8統計學方法 使用SPSS 19.0和GraphPad Prism 7.0軟件進行數據處理。計量資料用±s表示,多組間比較采用單因素方差分析(組間多重比較采用LSD-t法)或兩因素析因設計資料方差分析。P<0.05為差異有統計學意義。
2 結果
2.1阿帕替尼聯合GLA對SGC-7901細胞增殖的影響 MTT結果顯示,加藥48 h后,阿帕替尼和高良姜素呈濃度依賴性地抑制胃癌SGC-7901細胞活性;與空白對照組相比,20 mg/L阿帕替尼和400 mg/L高良姜素對胃癌SGC-7901細胞呈現明顯抑制作用(P<0.05),見圖1A、B。為進一步探討高良姜素對阿帕替尼的增效作用,選擇20 mg/L阿帕替尼聯合100、200、300、400、500、600 mg/L的高良姜素作用48 h。結果顯示,20 mg/L阿帕替尼聯合300 mg/L高良姜素對胃癌SGC-7901細胞的抑制作用明顯高于單獨應用20 mg/L阿帕替尼(P<0.05),見圖1C。因此,本研究選擇20 mg/L阿帕替尼聯合300 mg/L高良姜素進行后續實驗。
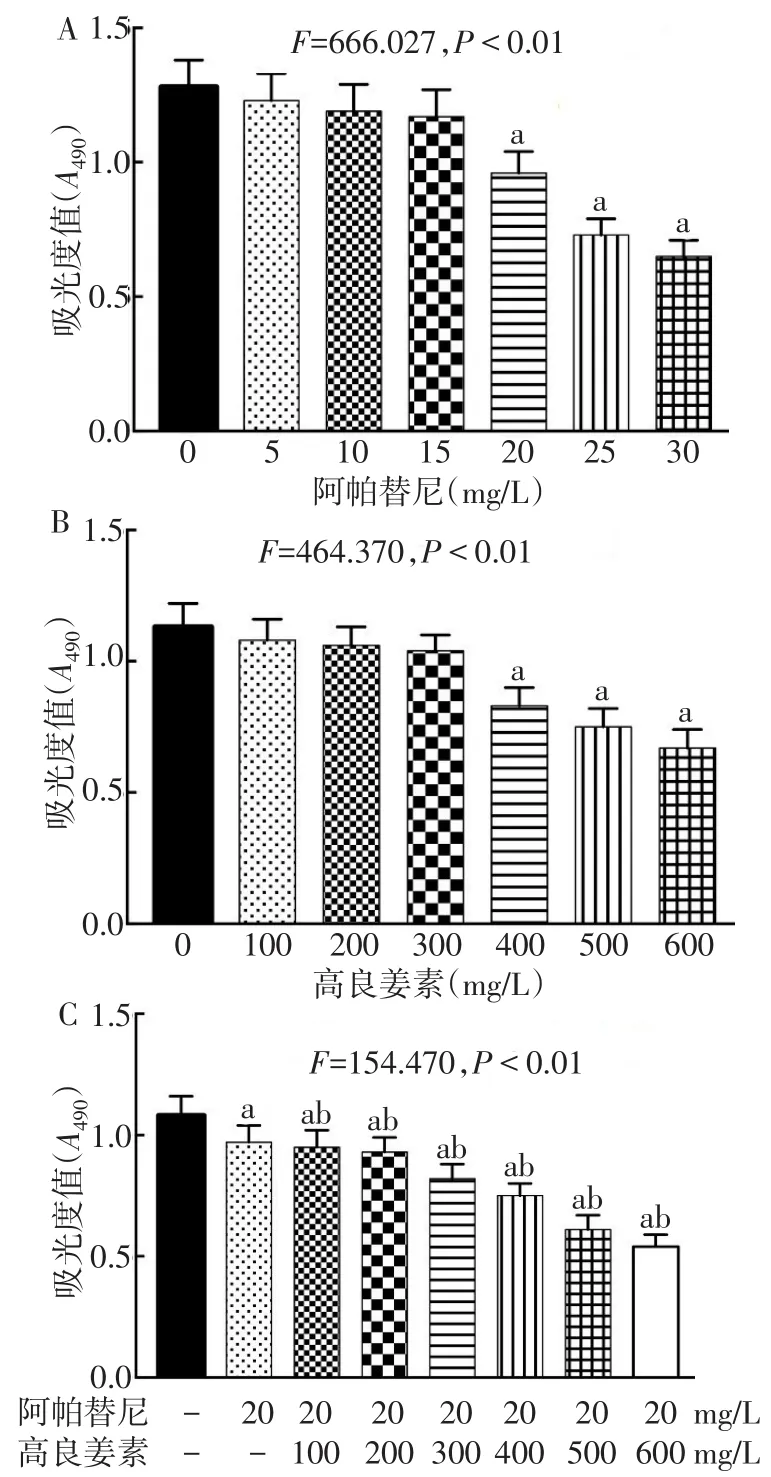
Fig.1 The inhibitory effect of apatinib combined with galangin ongastric cancer SGC-7901 cells圖1 阿帕替尼聯合高良姜素對胃癌SGC-7901細胞的抑制作用
2.2阿帕替尼聯合GLA對SGC-7901細胞遷移的影響 單獨使用20 mg/L阿帕替尼和300 mg/L高良姜素均明顯抑制SGC-7901細胞遷移(P<0.01);20 mg/L阿帕替尼聯合300 mg/L高良姜素對SGC-7901細胞遷移的抑制作用更加明顯(P<0.05),見圖2、表1。

Fig.2 The inhibitory effect of apatinib combined with galangin on gastric cancer SGC-7901 cells圖2 阿帕替尼聯合高良姜素對胃癌SGC-7901細胞的抑制作用
Tab.1 The effect of apatinib combined with galangin on migration,invasion and apoptosis of gastric cancer SGC-7901 cells表1 阿帕替尼聯合GLA對SGC-7901細胞遷移、侵襲和凋亡的影響 (n=3,±s)
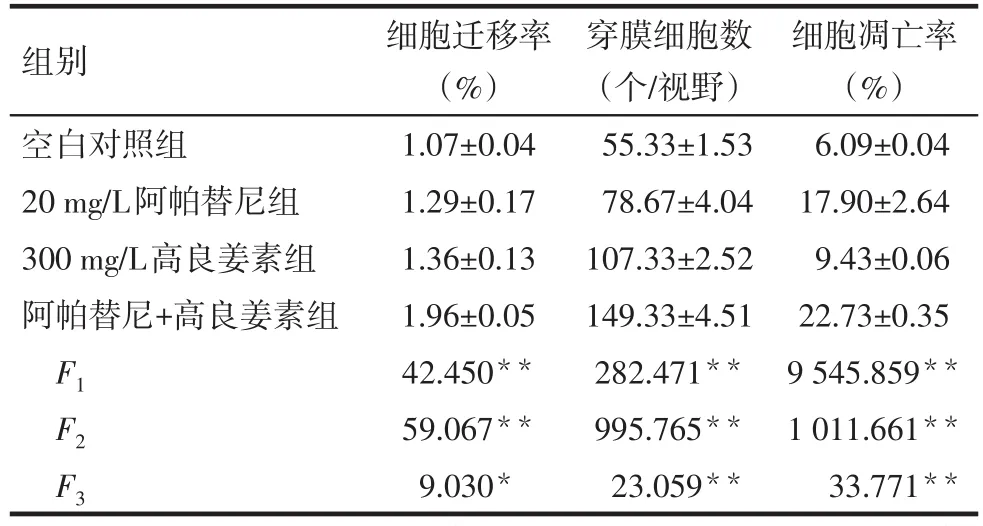
Tab.1 The effect of apatinib combined with galangin on migration,invasion and apoptosis of gastric cancer SGC-7901 cells表1 阿帕替尼聯合GLA對SGC-7901細胞遷移、侵襲和凋亡的影響 (n=3,±s)
*P<0.05,**P<0.01:F1為單獨20 mg/L阿帕替尼主效應的F值,F2為單獨300 mg/L高良姜素主效應的F值,F3為20 mg/L阿帕替尼聯合300 mg/L高良姜素主效應的F值
組別空白對照組20 mg/L阿帕替尼組300 mg/L高良姜素組阿帕替尼+高良姜素組F1F2F3細胞遷移率(%)1.07±0.04 1.29±0.17 1.36±0.13 1.96±0.05 42.450**59.067**9.030*穿膜細胞數(個/視野)55.33±1.53 78.67±4.04 107.33±2.52 149.33±4.51 282.471**995.765**23.059**細胞凋亡率(%)6.09±0.04 17.90±2.64 9.43±0.06 22.73±0.35 9 545.859**1 011.661**33.771**
2.3阿帕替尼聯合GLA對SGC-7901細胞侵襲的影響 單獨使用20 mg/L阿帕替尼和300 mg/L高良姜素均明顯抑制SGC-7901細胞侵襲(P<0.01);20 mg/L阿帕替尼聯合300 mg/L高良姜素對SGC-7901細胞遷移的侵襲作用更加明顯(P<0.01),見圖3,表1。
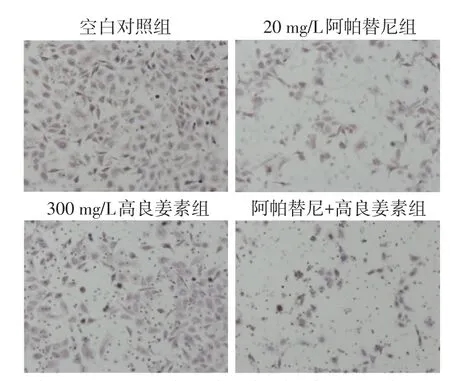
Fig.3 The effect of apatinib combined with galangin on the invasion of gastric cancer SGC-7901 cells圖3 阿帕替尼聯合高良姜素對胃癌SGC-7901細胞的遷移作用
2.4阿帕替尼聯合GLA對SGC-7901細胞凋亡的影響 單獨使用20 mg/L阿帕替尼和300 mg/L高良姜素均明顯誘導SGC-7901細胞凋亡(P<0.01);20 mg/L阿帕替尼聯合300 mg/L高良姜素對SGC-7901細胞凋亡的誘導作用更加明顯(P<0.01),見圖4、表1。
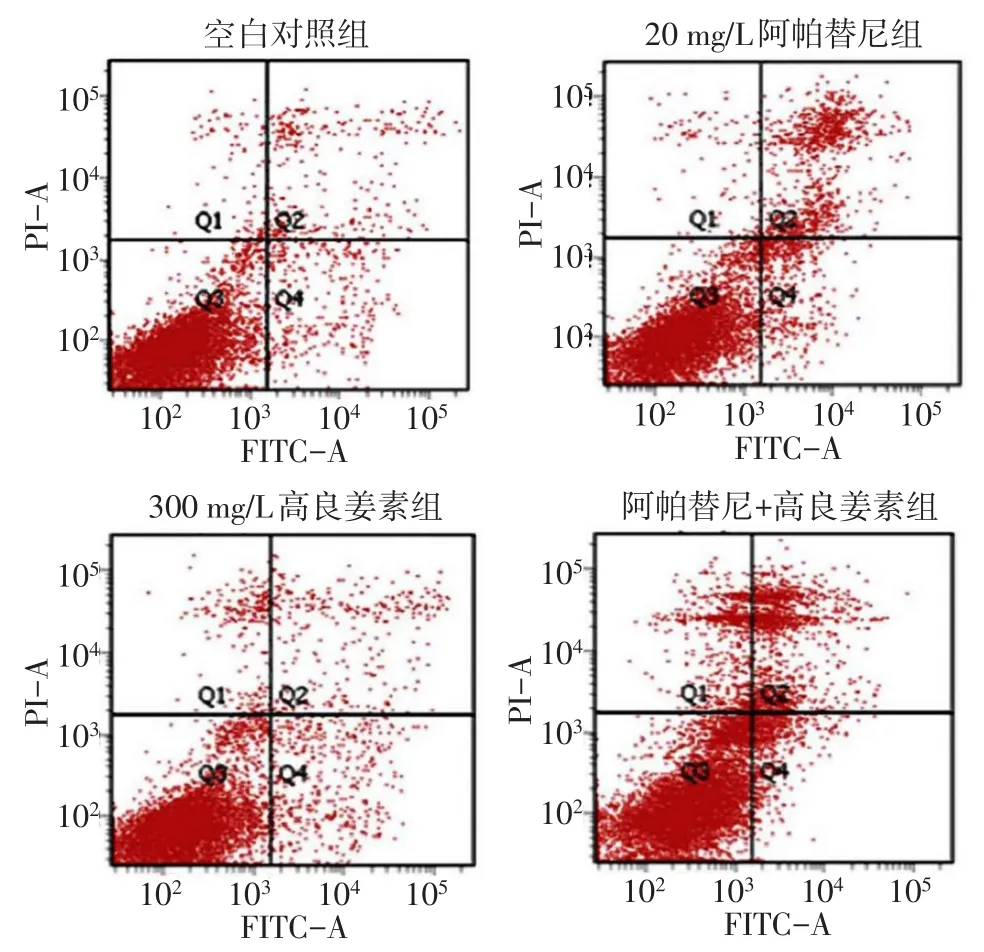
Fig.4 The effect of apatinib combined with galangin on the apoptosis of gastric cancer SGC-7901 cells圖4 阿帕替尼聯合高良姜素對胃癌SGC-7901細胞的凋亡作用
2.5阿帕替尼聯合GLA對SGC-7901細胞凋亡相關蛋白表達的影響 與空白對照組比較,20 mg/L阿帕替尼組和300 mg/L高良姜素組Bcl-2蛋白表達明顯下調,Bax蛋白表達明顯上調(P<0.05);與單用阿帕替尼比較,高良姜素聯合阿帕替尼組Bcl-2蛋白下調更明顯,Bax蛋白表達上調更明顯(P<0.05),見圖5A。與空白對照組比較,20 mg/L阿帕替尼組和300 mg/L高良姜素組p-Akt蛋白表達明顯下調,p-p38蛋白表達明顯上調(P<0.05);與單用阿帕替尼比較,高良姜素聯合阿帕替尼組p-Akt蛋白下調更明顯,p-p38蛋白表達上調更明顯(P<0.05),見圖5B。
3 討論
3.1GLA研究現狀 阿帕替尼屬于VEGFR2特異性抑制劑,是全世界第一個被證實對晚期胃癌有效的小分子靶向藥物。阿帕替尼對晚期胃癌及轉移性胃癌的療效已獲得充分肯定,但是隨著其廣泛使用,多數患者會發生耐藥[8],給晚期胃癌患者的治療帶來極大挑戰。阿帕替尼上市時間較晚(2014年SFDA批準上市),對于其耐藥性的發生機制尚缺乏相關報道。GLA屬于黃酮類化合物,在姜科植物高良姜根部含量豐富。GLA具有多種藥理作用,特別在惡性腫瘤方面表現出明顯的活性。Xu等[9]證實GLA能誘導胃癌SGC-7901細胞凋亡,其作用機制可能與降低線粒體膜電位有關。GLA不僅自身具有抑制腫瘤細胞的作用,還能增加腫瘤細胞對化療的敏感性,提示其是一種潛在的化療增敏劑。但其能否提高胃癌細胞對阿帕替尼的敏感性尚鮮見報道。
3.2阿帕替尼聯合GLA對胃癌SGC-7901細胞的遷移、侵襲作用 本研究發現,單獨使用20 mg/L阿帕替尼和300 mg/L高良姜素均可以明顯抑制胃癌細胞的增殖,與Wu等[10]報道一致,說明高良姜素單藥也具有抗胃癌的藥理活性。進一步研究發現,經過活性篩選的300 mg/L高良姜素聯合20 mg/L阿帕替尼對胃癌細胞增殖的抑制作用明顯優于20 mg/L阿帕替尼單藥處理,提示高良姜素增強了阿帕替尼對胃癌細胞的增殖抑制作用。Yu等[11]研究顯示GLA聯合順鉑可以呈劑量依賴性地抑制人肺癌細胞增殖,同時GLA單藥可以抑制肺癌順鉑耐藥細胞抗凋亡蛋白Bcl-2表達,并誘導細胞凋亡。本研究也證實,GLA聯合阿帕替尼可以明顯增強對胃癌細胞的凋亡誘導作用,提示其可以增強胃癌細胞對阿帕替尼的敏感性。遷移和侵襲是惡性腫瘤細胞發生遠處轉移的主要原因,轉移性胃癌患者預后極差,且治療選擇有限。一項隨機、雙盲、安慰劑對照的Ⅱ期臨床試驗結果顯示,阿帕替尼可以明顯改善轉移性胃癌的總生存期,研究者認為這可能與阿帕替尼抑制胃癌細胞遷移和侵襲表型有關[12]。本研究顯示,GLA聯合阿帕替尼對胃癌細胞遷移和侵襲的抑制作用明顯優于單用阿帕替尼,說明GLA增強了阿帕替尼對胃癌細胞遷移和侵襲的抑制。Tolomeo等[13]也證實GLA可以增強伊馬替尼對慢性髓樣白血病細胞KCL22的毒性作用,并部分逆轉KCL22細胞對伊馬替尼的耐藥性。
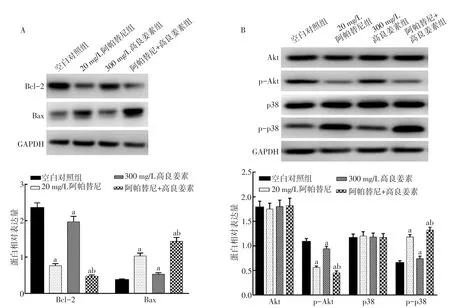
Fig.5 The effect of apatinib combine with galangin on expression levels of apoptosis and PI3K/Akt,MAPK related proteins of in gastric cancer SGC-7901 cells圖5 阿帕替尼聯合高良姜素對胃癌SGC-7901細胞凋亡及PI3K/Akt、MAPK通路相關蛋白表達的影響
3.3阿帕替尼聯合GLA對胃癌SGC-7901細胞的凋亡及作用機制 PI3K/Akt通路是調控腫瘤細胞增殖、遷移、侵襲和化療耐藥的主要途徑,其中Akt是PI3K/Akt通路的關鍵調控因子。Akt磷酸化后會激活一氧化氮合酶(NOS),并通過調控血管內皮生長因子(VEGF)介導腫瘤局部微血管形成。研究證實,包括胃癌在內的多數惡性腫瘤的發生、進展和耐藥均與PI3K/Akt通路異常活化有關[14]。本研究發現,GLA聯合阿帕替尼可以明顯下調p-Akt蛋白表達,提示其增強胃癌細胞對阿帕替尼敏感性可能與抑制PI3K/Akt信號通路有關。絲裂原活化蛋白激酶(MAPK)通路是近年來發現的與腫瘤細胞凋亡有關的信號轉導通路,包括JNK、ERK、p38等關鍵調控因子;其中p38受細胞因子、藥物、輻射等刺激而產生相應作用,參與腫瘤細胞的發生和進展。Zheng等[15]研究顯示p38表達異常與腫瘤患者生存期顯著相關。活化的p38可以抑制Bcl-2活化和誘導Bax轉位,并通過誘導線粒體凋亡途徑促進腫瘤細胞凋亡。本研究發現,GLA聯合阿帕替尼可明顯上調pp38表達,并抑制Bcl-2蛋白表達和誘導Bax表達,提示其可能通過激活p38 MAPK通路增強阿帕替尼對胃癌細胞的凋亡誘導作用。
3.4總結 GLA聯合阿帕替尼可以抑制胃癌SGC-7901細胞增殖、遷移和侵襲,并誘導細胞凋亡。本研究同時發現GLA可能通過抑制PI3K/Akt通路和激活p38 MAPK通路增強阿帕替尼對胃癌的抑制作用。今后我們將建立裸鼠荷瘤模型,進一步在體內驗證GLA聯合阿帕替尼的抗胃癌作用。

