Hcy水平與頸動脈粥樣斑塊穩定性的Meta分析
王釔丹 左鳳梅 劉雅文
【摘要】 目的:探討血同型半胱氨酸(Hcy)水平是否為影響頸動脈粥樣斑塊穩定性的危險因素。方法:計算機檢索萬方數據庫(Wanfang data)、中國知網(CNKI)、維普數據庫(VIP)、Pubmed英文數據庫,收集國內外公開發表的關于同型半胱氨酸與頸動脈斑塊穩定性的相關研究,發表時間截止到2018年5月31日。由2名研究者獨自根據納入與排除標準對相關文獻進行篩選,并對文獻進行質量評價與數據提取。所有亞組分析、發表偏倚檢測及敏感性分析均采用Stata 12.0軟件。結果:研究最終納入6篇橫斷面研究,4篇病例對照研究。采用隨機效應模型對血Hcy水平與頸動脈斑塊穩定性的關系進行Meta分析,結果顯示,血Hcy水平與斑塊穩定性相關[OR=3.317,95%CI(2.163,5.085),P=0.013]。結論:高水平Hcy與頸動脈斑塊穩定性密切相關,提示高Hcy可能為頸動脈不穩定斑塊發生的危險因素,在臨床實踐中具有指導意義。
【關鍵詞】 同型半胱氨酸; 頸動脈斑塊; Meta分析
【Abstract】 Objective:To investigate whether the level of blood homocysteine(Hcy)is a risk factor for the stability of carotid atherosclerotic plaque.Method:Wanfang data,CNKI,VIP and Pubmed English database were searched by computer to collect the published studies on the relationship between homocysteine and carotid artery plaque stability at home and abroad,the publication time was up to May 31,2018.Two researchers independently screened relevant literature according to inclusion and exclusion criteria,and conducted quality evaluation and data extraction for the literature.Stata 12.0 software was used for all subgroup analyses,publication bias detection,and sensitivity analysis.Result:Six cross-sectional studies and four cases control studies satisfied the eligibility criteria.The relationship between the level of blood Hcy and the stability of carotid artery plaques was Meta analyzed using the random effect model.The results showed that the level of blood Hcy was correlated with the stability of carotid artery plaques[OR=3.317,95%CI(2.163,5.085),P=0.013].Conclusion:High homocysteine level is associated with carotid plaque stability and may be a risk factor for the occurrence of carotid unstable plaques,which has guiding significance in clinical practice.
【Key words】 Homocysteine; Carotid plaque; Meta analysis
First-authors address:College of Medical Imaging,Xuzhou Medical University,Xuzhou 221004,China
doi:10.3969/j.issn.1674-4985.2019.17.039、
心血管疾病是非傳染性疾病中最常見的死亡原因[1]。腦血管疾病以其顯著的發病率和死亡率為特征,已成為最常見的威脅生命的疾病[2]。心、腦血管動脈粥樣硬化(atherosclerosis,AS)是心腦血管疾病的主要發病機制[3],頸動脈粥樣硬化斑塊(carotid atherosclerostic plaque)的出現與心腦血管疾病的發生密切相關。頸動脈粥樣硬化性狹窄和斑塊不穩定脫落是造成死亡的主要原因,因而斑塊的穩定性成為預測心腦血管事件發展的重要因素[4-5]。同型半胱氨酸(homocysteine,Hcy)是一種含硫的血管損傷性氨基酸,在體內是甲硫氨酸循環的代謝產物,也是許多甲基化反應及能量代謝過程中一種重要的中間產物。Hcy可通過氧化應激、內質網應激等機制,導致血管內皮功能障礙,還可以增加血小板的聚集率和黏附性,導致血栓形成,促進動脈粥樣硬化的發展[6]。近年來,已有國外學者研究證實,高同型半胱氨酸血癥是頸動脈內膜增厚和粥樣斑塊形成的獨立危險因素[7],然而對于血同型半胱氨酸水平與頸動脈粥樣斑塊的穩定性的相關性缺少薈萃分析,故本研究對Hcy水平與頸動脈粥樣硬化斑塊穩定性的相關研究報道中的結果進行了Meta分析,探討Hcy水平與頸動脈斑塊穩定性之間的關系,為預防和控制心腦血管疾病提供依據。
1 資料與方法
1.1 文獻檢索 以“半胱氨酸”“粥樣斑塊”“穩定性”“高同型半胱氨酸血癥”等為主題詞,檢索萬方數據庫(Wanfang data)、中國知網(CNKI)、維普數據庫(VIP);以“homocysteine”“carotid plaque”“stability”“vulnerable”“homocysteinemia”等為主題詞,檢索Pubmed英文數據庫。收集國內外公開發表的關于同型半胱氨酸與頸動脈斑塊穩定性的相關研究,發表時間截止到2018年5月31日。文獻類型不限,語言限定為中文和英文。同時在檢索到的原始研究文獻和綜述的參考文獻中查找相關研究文獻。
1.2 文獻納入與排除標準 納入標準:(1)2012年1月-2018年5月國內外公開發表的關于血Hcy水平與頸動脈斑塊穩定性的中英文研究。(2)研究設計為橫斷面研究和病例對照研究。(3)頸動脈斑塊穩定性診斷明確,有診斷報告作為診斷依據。排除標準:(1)會議摘要、動物實驗、綜述或無法提供有效數據進行分析的文獻。(2)重復報道、數據不全的研究。(3)未描述Hcy檢測方法或測定過程描述不清的研究。(4)低質量研究,質量評價得分低于標準。(5)試驗組與對照組基本資料不相匹配,差異有統計學意義的研究。
1.3 文獻篩選及數據提取 由2名研究者獨自根據納入與排除標準對相關文獻進行篩選、提取文章數據和信息并交叉核對,如遇分歧則進行討論,并由第三方進行裁決。通過制定完善的信息表對文獻信息進行匯總。匯總的信息內容如下:第一作者、發表年份、研究類型、高Hcy診斷界值、Hcy檢測方法、試驗組與對照組樣本量等,比較核對相關數據。
1.4 文獻質量評價 本研究對納入的橫斷面研究采用美國衛生保健質量和研究機構(agency for healthcare research and quality,AHRQ)推薦的橫斷面研究質量評價標準進行評估[8]。該量表共分為11個條目,分別做出“是”“否”和“不清楚”的評價,“是”得1分,“否”或“不清楚”得0分,文章質量評價0~3分為低質量研究,4~7分為中等質量研究,8~11分為高質量研究[8];對納入的病例對照研究采用紐卡斯-渥太華量表(Newcastle-Ottawa Quality Scale,NOS)評價納入的研究,包括8項條目,合計9分,NOS評分為5~9分表明文獻質量較好,NOS評分<5分表明文獻質量較差[9]。質量評價由2名研究者同時獨立進行,產生分歧時經討論后由第三方進行裁決。
1.5 統計學處理 數據由第3名研究者利用Stata 12.0進行分析。先用字2檢驗及I2對各研究間異質性進行分析,若P<0.1或I2>50%則認為各研究間存在異質性,采用隨機效應模型進行分析,反之則采用固定效應模型進行分析。出現異質性時進行亞組分析和敏感性分析尋找異質性來源。發表偏倚用漏斗圖和Egger法檢驗,若存在,則采用剪補法校正結果。以P<0.1為差異有統計學意義。
2 結果
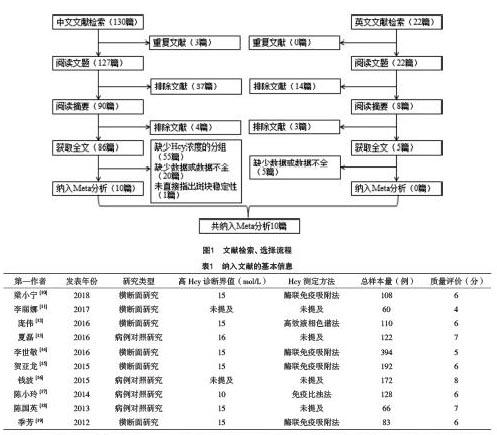
2.1 文獻檢索結果及質量評價 通過數據庫檢索,初步篩選出相關文獻152篇,按照研究制定的納入、排除標準對其進行篩選,共納入10篇文獻,見圖1。納入研究文獻的基本情況及質量評價結果,見表1。
2.2 Meta分析
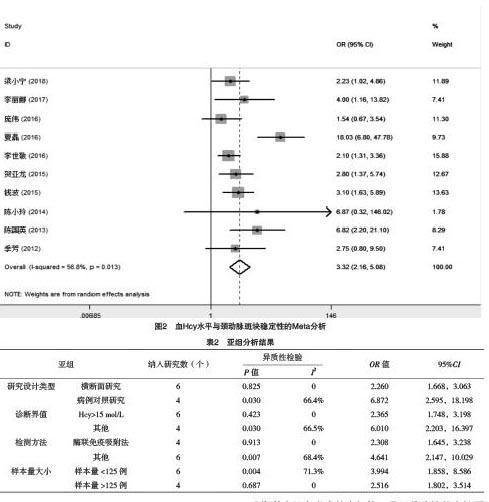
2.2.1 異質性檢驗 被納入的10篇研究異質性檢驗結果顯示存在異質性(I2=56.8%,P<0.01),故使用隨機效應模型進行合并分析,結果顯示,高Hcy水平組與正常Hcy水平組不穩定斑塊發生比較,差異有統計學意義[OR=3.317,95%CI(2.163,5.085),P=0.013],高Hcy水平組不穩定斑塊的發生數顯著多于正常Hcy水平組,見圖2。
2.2.2 亞組分析 由于納入的研究結果之間存在異質性,故根據各研究的特征,按照研究設計的類型、高Hcy診斷界值、Hcy檢測方法、樣本量大小進行亞組分析[20],對每個亞組均進行異質性檢驗,見表2,可知所有研究指標進行分層后,異質性發生變化。按研究設計類型分類,結果顯示橫斷面研究組提示Hcy水平與斑塊穩定性相關。按Hcy診斷界值分類,結果顯示以Hcy>15 mol/L為診斷界值的組提示Hcy水平與斑塊穩定性相關。按檢測方法分類,結果顯示使用酶聯免疫吸附法的組提示Hcy水平與斑塊穩定性相關。按研究樣本量大小分類,結果顯示樣本量大的組提示Hcy水平與斑塊穩定性相關。曾有研究報道,調脂類藥物可能與Hcy水平成負相關[21],由于部分文獻提供信息不全,本研究現有資料未能完成基于服用藥物的亞組分析。
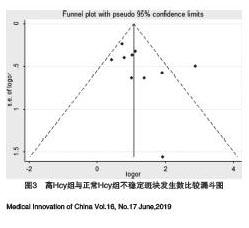
2.2.3 發表偏倚與敏感性分析 納入文獻發表偏倚用漏斗圖檢驗顯示沒有明顯的發表偏倚,用Egger法進行檢驗,P>0.1,提示不存在發表偏倚。在逐一剔除每一篇原始文獻后,Meta分析的結果方向并未發生改變,見圖3。
3 討論
本研究以公開發表的病例對照研究和橫斷面研究為基礎進行Meta分析,結果顯示高Hcy組與正常Hcy水平組不穩定斑塊發生情況比較,差異有統計學意義,據此可以推斷Hcy水平增高與不穩定斑塊之間有著密不可分的聯系。進一步的亞組分析結果顯示異質性發生明顯改變,橫斷面研究組、以Hcy>15 mol/L為診斷界值組、使用酶聯免疫吸附法組及樣本量較大組異質性消失。參照AHRQ標準和NOS標準,最終入選的10項研究總體為中等質量,分別用漏斗圖、Egger法檢驗均提示沒有發表偏倚。
動脈粥樣硬化是心腦血管疾病發生的主要原因,而頸動脈是人體全身動脈粥樣硬化常累及的部位,故頸動脈粥樣硬化是心腦血管疾病發生的早期征象。頸動脈不穩定斑塊形成后,斑塊容易破裂、脫落,導致栓子形成,并跟隨血流流向遠端。從病理生理學的觀點來看,穩定到不穩定的粥樣硬化斑塊的轉變是復雜的分子和細胞機制的結果,不穩定斑塊易破裂,主要以大的脂質壞死核心及被薄纖維帽覆蓋為特征[22]。同型半胱氨酸是半胱氨酸和蛋氨酸代謝途徑中形成的中間體,是目前公認的炎性因子之一,在血管平滑肌細胞中引發炎癥反應。正常情況下,Hcy在體內被分解代謝,濃度維持在較低水平,但當其水平升高時會對血管內皮細胞產生毒性作用,破壞血管壁彈力層和膠原纖維,引起內皮細胞損傷,加快血管平滑肌細胞的增殖,最終損傷血管[23-25]。
本研究仍然存在不足之處:(1)檢索文獻的語種局限于中文和英文,可能會漏檢其他語種的相關文獻。(2)研究中納入的文獻大部分樣本量小于200,可靠性不夠。(3)研究中納入的文獻數量不足,在證明因果聯系上缺乏足夠的說服力,只能說明Hcy水平的升高與不穩定斑塊的發生相關,但無法反映兩者之間的因果關系。
綜上所述,血Hcy水平的升高與頸動脈不穩定性斑塊的發生相關,由于病例對照研究和橫斷面研究不能揭示Hcy水平與頸動脈不穩定斑塊之間的因果關系,闡明血Hcy水平與頸動脈不穩定斑塊發生的確切關聯還需要來自更多人群、更多樣本的前瞻性研究。
致謝:感謝董長鴻對本文研究工作的辛勤付出,謹此致謝!
參考文獻
[1] Kendir C,van den Akker M,Vos R,et al.Cardiovascular disease patients have increased risk for comorbidity:a cross-sectional study in the Netherlands[J].Eur J Gen Pract,2018,24(1):45-50.
[2] Wang J,Zhang L,Liu B,et al.Systematic investigation of the Erigeron breviscapus mechanism for treating cerebrovascular disease[J].J Ethnopharmacol,2018,224:429-440.
[3] Maki K C,Davidson M H,Dicklin M R,et al.Predictors of anterior and posterior wall carotid intima media thickness progression in men and women at moderate risk of coronary heart disease[J].J Clin Lipidol,2011,5(3):141-151.
[4] Parker B L,Thaysen-Andersen M,Fazakerley D J,et al.
Terminal Galactosylation and Sialylation Switching on Membrane Glycoproteins upon TNF-Alpha-Induced Insulin Resistance in Adipocytes[J].Mol Cell Proteomics,2016,15(1):141-153.
[5] Sevuk U,Bahadir M V,Altindag R,et al.Relationship between thyroid function and carotid artery plaque ulceration[J].Acta Neurol Belg,2015,115(4):581-587.
[6] Kwon S W,Kim J Y,Suh Y J,et al.Prognostic Value of Elevated Homocysteine Levels in Korean Patients with Coronary Artery Disease:A Propensity Score Matched Analysis[J].Korean Circ J,2016,46(2):154-160.
[7] Ansari R,Mahta A,Mallack E,et al.Hyperhomocysteinemia and neurologic disorders:a review[J].J Clin Neurol,2014,10(4):281-288.
[8] Hu J,Dong Y,Chen X,et al.Prevalence of suicide attempts among Chinese adolescents:a meta-analysis of cross-sectional studies[J].Compr Psychiatry,2015,61:78-89.
[9] Lo C K,Mertz D,Loeb M.Newcastle-Ottawa Scale:comparing reviewers' to authors' assessments[J].BMC Med Res Methodol,2014,14(1):45.
[10]梁小寧.血漿同型半胱氨酸與缺血性腦血管病患者頸動脈粥樣硬化斑塊的關系[J].臨床醫學研究與實踐,2018,3(9):38-39.
[11]李麗娜.頸動脈粥樣硬化斑塊的穩定性與缺血性腦血管疾病危險因素的相關研究[J/OL].中西醫結合心血管病電子雜志,2017,5(13):133,135.
[12]龐偉,周琛,陳艷.急性腦梗死患者血尿酸、同型半胱氨酸水平與頸動脈斑塊穩定性的相關性分析[J].中國當代醫藥,2016,23(7):58-60.
[13]夏磊,徐格林,何曉軍,等.腦梗死患者頸動脈粥樣硬化的相關因素分析[J].現代生物醫學進展,2016,16(16):3158-3163.
[14]李世敬,金亞娟,趙玉燕.血漿同型半胱氨酸水平與缺血性腦血管病患者頸動脈粥樣硬化斑塊的相關性研究[J].湖南師范大學學報(醫學版),2016,13(1):119-121.
[15]賀亞龍.血漿同型半胱氨酸與缺血性腦血管病患者頸動脈粥樣硬化斑塊的關系[J].中國實用神經疾病雜志,2015,18(19):18-20.
[16]錢波.高同型半胱氨酸血癥與頸動脈粥樣硬化的相關性研究[J].中外女性健康研究,2015(19):190,197.
[17]陳小玲,許勇,范元杰,等.血清同型半胱氨酸對急性心肌梗死的評估和預測價值[J].實用醫院臨床雜志,2014,11(2):116-118.
[18]陳國英.高血壓患者血漿同型半胱氨酸水平與頸動脈斑塊的關系[J].中國現代醫生,2013,51(28):57-59.
[19]季芳,李蕾,戚筠.急性腦梗死患者血清同型半胱氨酸水平與下肢動脈粥樣硬化程度的關系[J].中國神經精神疾病雜志,2012,38(7):397-401.
[20] Araki A.Homocysteine and diabetic macroangiopathy[J].Nihon Rinsho,2006,64(11):2153-2158.
[21] Drewes Y M,Poortvliet R K,Blom J W,et al.Homocysteine levels and treatment effect in the PROspective Study of Pravastatin in the Elderly at Risk[J].J Am Geriatr Soc,2014,62(2):213-221.
[22] Mono M L,Karameshev A,Slotboom J,et al.Plaque characteristics of asymptomatic carotid stenosis and risk of stroke[J].Cerebrovasc Dis,2012,34(5-6):343-350.
[23] Li Y,Wang L,Zhang W,et al.No association between elevated homocysteine levels and carotid atherosclerosis in a rural population in China[J].Stroke Vasc Neurol,2016,1(4):154-160.
[24] Basu A,Jenkins A J,Stoner J A,et al.Plasma total homocysteine and carotid intima-media thickness in type 1 diabetes:a prospective study[J].Atherosclerosis,2014,236(1):188-195.
[25] Kim J,Song T J,Song D,et al.Nonrelevant cerebral atherosclerosis is a strong prognostic factor in acute cerebral infarction[J].Stroke,2013,44(7):2013-2015.
(收稿日期:2019-04-10) (本文編輯:張爽)

