三葉青不同萃取部位抗氧化活性
何文,李瀚鑫,王晰雯,葉春林
浙江科技學院生物與化學工程學院,浙江省農產品化學與生物加工技術重點實驗室(杭州 310023)
三葉青(Tetrastigmatis hemsleyani)又名石猴子、石抱子、石老鼠、蛇附子、絲線吊金鐘、金線吊馬鈴薯等,為葡萄科崖爬藤屬植物三葉崖爬藤(Tetrastigmatis hemsleyani Diels et Gilg)[1-2]。它主要分布于我國浙江、安徽、西藏、江西、湖南等地[3]。據記載,三葉青味微苦、性平,具有清熱解毒、活血散瘀、祛風化痰的功效[4-5]。內服主治白喉、痢疾、病毒性腦膜炎、病毒性肺炎、支氣管炎及肝炎,外用主治跌打損傷、扁桃體炎、淋巴結結核、子宮頸炎,還可用于毒蛇咬傷[6]。研究表明,三葉青具有廣泛的生物活性,比如具有抗炎、抗氧化、抗腫瘤及抗病毒等功效[3],有著“植物抗生素”的美譽,近幾年逐漸受到國內外學者的關注。
機體在代謝過程中能夠源源不斷地產生自由基,同時自由基也能夠不斷地被清除。在正常情況下,這兩種過程維持在一個動態平衡的狀態,這種狀態能夠使機體保持平衡穩定的自由基含量[7]。自由基含量過多,會導致機體的正常細胞和組織受到非特異性氧化損傷,從而引發多種惡性疾病,如心血管病、糖尿病、早老性癡呆、關節炎、癌癥等[8],幾乎被認為與機體自由基含量失衡有關。中藥中富含天然的抗氧化劑,其包含的活性成分能夠抑制自由基的產生,或者直接參與對抗自由基對人體細胞及組織的傷害[9]。
基于此,試驗通過測定三葉青三個萃取部位對DPPH自由基、超氧陰離子自由基、羥自由基的清除能力以及對鐵離子的還原能力,來評價三葉青三個萃取部位的抗氧化活性,并通過測定三個萃取部位中總酚和總黃酮含量以及分析總酚、總黃酮含量與抗氧化活性的相關性,初步判斷其抗氧化作用的物質基礎,為中藥三葉青的進一步開發與利用提供一定的理論基礎。
1 材料、試劑與儀器
1.1 材料與試劑
三葉青塊根(浙江麗水三葉青珍稀植物研究所);三羥甲基氨基甲烷、亞硝酸鈉、硝酸鋁、氫氧化鈉、FeSO4·7H2O(天津市大茂化學試劑廠);鄰苯三酚、磷酸氫二鈉、磷酸二氫鈉(國藥集團化學試劑有限公司);鹽酸、鐵氰化鉀、三氯化鐵、沒食子酸、蘆丁、水楊酸、福林酚、碳酸鈉(上海凌峰化學試劑有限公司);1, 1-二苯基苦基苯肼(DPPH,北京冬歌生物科技有限公司);三氯乙酸、無水乙醇(永華化學科技有限公司);30% H2O2溶液(杭州高晶精細化工有限公司)。
1.2 儀器與設備
CS-700高速多功能粉碎機(永康市天祺盛世工貿有限公司);BS224S型電子天平(北京賽多利斯儀器系統有限公司);SHZ-DⅢ型循環水式真空泵(鞏義市予華儀器有限公司);DKS-24型電熱恒溫水浴鍋(杭州藍天化驗儀器廠);752紫外可見分光光度計(上海菁華科技儀器有限公司);BCD-212型冰箱(博西華家用電器有限公司);9070MBE型數顯鼓風干燥箱(上海博迅實業有限公司醫療設備廠)。
2 試驗方法
2.1 三葉青不同萃取部位樣品的制備
用70%甲醇浸泡三葉青塊根粉末,得到三葉青甲醇提取物,經減壓濃縮后得到浸膏,系統溶劑萃取法對浸膏依次進行萃取,得到各個萃取部位。分別稱取500 mg各極性部位,石油醚部位、乙酸乙酯部位用無水乙醇溶解,正丁醇部位用去離子水溶解,定容于100 mL容量瓶中,配成終濃度為5.0 mg/mL的母液,再分別稀釋成不同濃度梯度的溶液,作樣品液;配制相同濃度的VC溶液,備用。
2.2 總酚含量的測定
將每個萃取部位配制成2.0 mg/mL的溶液,從中取出0.5 mL,采用福林酚比色法[10]測定三葉青不同萃取部位總酚含量。
2.3 總黃酮含量的測定
將每個萃取部位配制成2.0 mg/mL的溶液,從中取出0.5 mL,采用亞硝酸鈉-硝酸鋁-氫氧化鈉比色法[11]測定三葉青不同萃取部位總黃酮含量。
2.4 三葉青不同萃取部位抗氧化活性測定
2.4.1 DPPH自由基清除率測定
分別吸取2.0 mL系列質量濃度樣品溶液,加入2.0 mL 0.04 mg/mL DPPH溶液,混合均勻,常溫下在暗處放置30 min。無水乙醇調零,測定溶液在517 nm波長處的吸光度A1;然后用無水乙醇替代樣品溶液后測定吸光度A0,替代DPPH標準液后測定吸光度A2。VC作對照,每個樣品重復3次,按式(1)計算DPPH自由基清除率[12]。
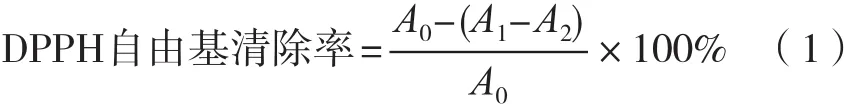
式中:A0表示DPPH標準溶液+無水乙醇的吸光度;A1表示DPPH標準溶液+樣品液的吸光度;A2表示無水乙醇+樣品液的吸光度。
2.4.2 超氧陰離子清除率測定
在10 mL試管中依次加入1.0 mL不同質量濃度的樣品液、4.0 mL 50 mmol/L pH 8.2 Tris-HCl緩沖液,在25 ℃下恒溫水浴10 min,再加入0.1 mL 20 mmol/L的鄰苯三酚,混勻保溫4 min后,立即加入2滴濃鹽酸(12 mol/L)終止反應,在325 nm波長下測定溶液的吸光度A1,用0.1 mL去離子水替代鄰苯三酚后測定吸光度A2,1.0 mL去離子水替代樣品溶液后測定吸光度A0,以VC作為對照,平行試驗3次,取平均值,按照式(2)計算超氧陰離子自由基清除率[13]。

式中:A0表示去離子水+Tris-HCl緩沖液+鄰苯三酚的吸光度;A1表示樣品液+Tris-HCl緩沖液+鄰苯三酚的吸光度;A2表示樣品液+Tris-HCl緩沖液+去離子水的吸光度。
2.4.3 羥自由基清除率測定
移取1.0 mL 6.0 mmol/L FeSO4于10 mL的試管中,加入1.0 mL 6.0 mmol/L水楊酸乙醇溶液、1.0 mL不同質量濃度的樣品液,最后加入1.0 mL 8.8 mmol/L H2O2溶液啟動反應,在37 ℃恒溫水浴反應30 min,在510 nm波長處測吸光度Ai,去離子水替代H2O2溶液測定吸光度Aj,去離子水替代樣品液測定吸光度A0。VC作為陽性對照,每個樣品重復3次,取平均值,按照式(3)計算羥自由基清除率[14]。

式中:Ai表示1.0 mL FeSO4+1 mL水楊酸乙醇溶液+1 mL樣品液+1 mL H2O2的吸光度;Aj表示1 mL FeSO4+1 mL水楊酸乙醇溶液+1 mL樣品液+1 mL去離子水的吸光度;A0表示1 mL FeSO4+1 mL水楊酸乙醇溶液+1 mL去離子水+1 mL H2O2的吸光度。
2.4.4 鐵離子還原能力測定
取2 mL各質量濃度的樣品液,分別依次加入2 mL 0.2 mol/L pH 6.6的磷酸鹽緩沖液和2 mL 1%的鐵氰化鉀溶液,混勻后50 ℃恒溫反應20 min,急速冷卻,加2 mL 10%的三氯乙酸,混勻后4 000 r/min離心10 min。取2 mL上清液,分別加2 mL去離子水和0.4 mL 0.1%三氯化鐵溶液,混勻,靜置10 min 后,去離子水調零,在700 nm波長處測定吸光度。VC溶液為陽性對照,每個樣品重復測3次,取平均值[15]。
2.5 數據統計分析
所有結果均以X±S表示。采用SPSS 19.0進行單因素方差分析,并結合Duncan法檢驗各數據間的差異顯著性,p<0.05表示差異顯著。利用Pearson correlation test法進行各數據間的相關性分析。
3 結果與分析
3.1 沒食子酸、蘆丁標準曲線
以質量濃度為橫坐標X(μg/mL),吸光度為縱坐標Y,得到沒食子酸標準曲線方程:Y=0.093 1X+0.068,R2=0.999 4。蘆丁標準曲線方程為:Y=0.007 7X+0.009 4,R2=0.999 3。
3.2 三葉青不同萃取部位中的總酚、總黃酮含量分析
由表1可知,總酚和總黃酮含量在三葉青不同萃取部位中具有明顯的差異:其中乙酸乙酯部位的總酚、總黃酮含量最高,石油醚部位次之,正丁醇部位總酚、總黃酮含量最低。利用單因素方差分析和Duncan法檢驗這三種萃取部位總酚、總黃酮含量間差異的顯著性。結果顯示,任意兩種部位之間的總酚、總黃酮含量均具有顯著性差異(p<0.05),三個部位中總酚、總黃酮含量的大小順序一致,均為乙酸乙酯部位>石油醚部位>正丁醇部位,可以認為三葉青中的酚類物質和黃酮類化合物基本富集在乙酸乙酯部位和石油醚部位,通過分步萃取,已初步提取出三葉青中的酚類物質和黃酮類物質。
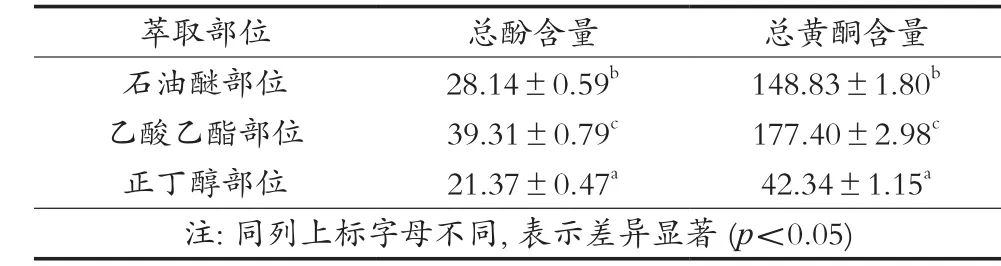
表1 三葉青不同萃取部位中的總酚、總黃酮含量(X±S,n=3) mg/g
3.3 DPPH自由基清除能力分析
如圖1所示,三葉青不同萃取部位及VC對DPPH自由基表現出不同程度的清除能力。在0.2~1.2 mg/mL質量濃度范圍內,三葉青不同萃取部位對DPPH自由基的清除率均隨其質量濃度的增大而增大,但均小于VC對DPPH自由基的清除率。由表2可知,三種不同萃取部位對DPPH自由基的半抑制濃度(IC50)由小到大的順序為乙酸乙酯部位<石油醚部位<正丁醇部位,三者之間具有顯著性差異(p<0.05)。在試驗濃度范圍內,VC對DPPH自由基的清除率均在90%以上,無法求出其IC50值。故三葉青的三種不同萃取部位對DPPH自由基的清除能力為乙酸乙酯部位>石油醚部位>正丁醇部位,但均不及VC。
3.4 超氧陰離子清除能力分析
如圖2所示,三葉青不同萃取部位及VC對超氧陰離子自由基的清除能力差異很大。在0.2~1.2 mg/mL質量濃度范圍內,三葉青石油醚和乙酸乙酯部位對超氧陰離子自由基的清除率均隨其質量濃度的增大而顯著增大。正丁醇部位的清除能力隨質量濃度的增大而提升幅度較低,在最高濃度1.2 mg/mL時也未能超過50%;VC對超氧陰離子自由基有著極強的清除能力,在最低濃度0.2 mg/mL時就超過了90%,故這二者均無法求出其IC50。由表2可知,三葉青乙酸乙酯部位的IC50小于石油醚部位,乙酸乙酯部位對超氧陰離子自由基的清除能力強于石油醚部位,但均不及VC。
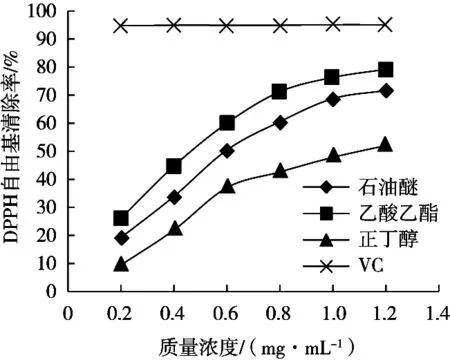
圖1 三葉青不同萃取部位對DPPH自由基的清除能力
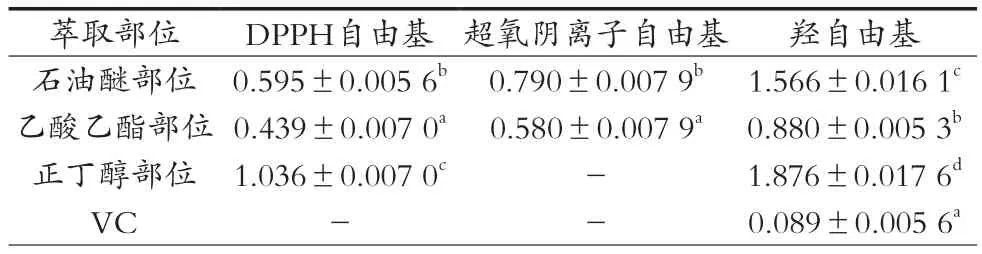
表2 三葉青不同萃取部位對自由基的半抑制濃度(IC50,X±S,n=3) mg/mL
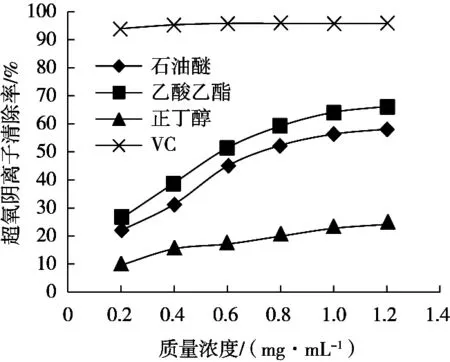
圖2 三葉青不同萃取部位對超氧陰離子的清除能力
3.5 羥自由基清除能力分析
如圖3所示,三葉青不同萃取部位及VC均對羥自由基有一定的清除能力。在0.05~4.0 mg/mL質量濃度范圍內,隨著質量濃度的增大,三葉青不同萃取部位及VC對羥自由基的清除率先增大再趨于平緩。其中石油醚部位、乙酸乙酯部位、正丁醇部位在2.0 mg/mL后清除率增幅不明顯,而VC在0.5 mg/mL后清除率就基本不變。由表2可知,三種不同萃取部位及VC對羥自由基的半抑制濃度(IC50)順序為VC<乙酸乙酯部位<石油醚部位<正丁醇部位,任何兩者之間差異顯著(p<0.05)。三種不同萃取部位對羥自由基的清除能力為:乙酸乙酯部位>石油醚部位>正丁醇部位,但均不及VC。
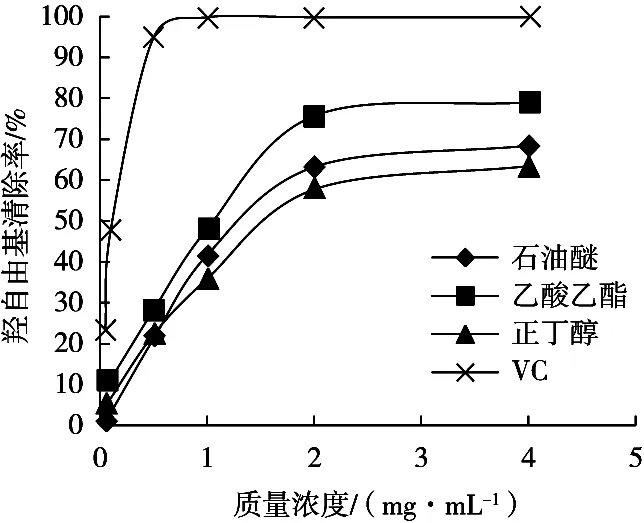
圖3 三葉青不同萃取部位對羥自由基的清除能力
3.6 鐵離子還原能力
如圖4所示,在0.025~0.15 mg/mL質量濃度范圍內,三葉青不同萃取部位對鐵離子還原能力均隨其質量濃度的增大而略有上升,但均處于較低水平,而VC對鐵離子還原能力隨其質量濃度的增大而顯著上升,且三種不同萃取部位對鐵離子還原能力始終遠低于VC。
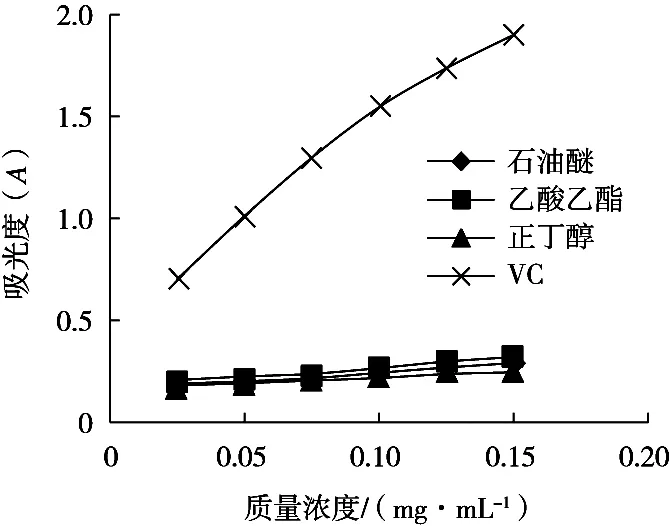
圖4 三葉青不同萃取部位對鐵離子還原能力
3.7 總酚、總黃酮含量與抗氧化活性的相關性分析
為評價三葉青不同萃取部位總酚、總黃酮含量與其抗氧化活性的相關性,試驗利用Pearson法進行了相關性分析,結果如表3所示。總酚含量與羥自由基清除能力的相關性達到了0.998,且顯著相關(p<0.05),說明總酚類物質是三葉青不同萃取部位清除羥自由基的主要活性成分。總黃酮含量與DPPH自由基清除能力、超氧陰離子自由基清除能力的相關性達到了0.997和0.999,且顯著相關(p<0.05),說明總黃酮類物質是三葉青不同萃取部位清除DPPH自由基、超氧陰離子自由基的主要活性成分。綜合所有相關系數來看,酚類、黃酮類化合物可能是三葉青不同萃取部位抗氧化活性的物質基礎。

表3 三葉青不同萃取部位總酚、總黃酮含量與抗氧化活性的相關性
4 結論與討論
試驗證明了三葉青的三個萃取部位均含有酚類和黃酮類化合物,其中乙酸乙酯部位的總酚、總黃酮含量最高,分別為39.31±0.79和177.40±2.98 mg/g;石油醚部位含量低于乙酸乙酯部位,分別為28.14±0.59和148.83±1.80 mg/g;正丁醇部位總酚、總黃酮含量最低,分別為21.37±0.47和42.34±1.15 mg/g。抗氧化活性試驗證明,三葉青三個萃取部位均具有一定的清除自由基的能力和鐵離子還原能力,其抗氧化的能力為乙酸乙酯部位>石油醚部位>正丁醇部位,但均不及VC。相關性分析證明三葉青三個萃取部位的抗氧化活性與它們的總酚、總黃酮含量大小顯著相關,說明酚類和黃酮類可能是其抗氧化作用的物質基礎,這與王維華[16]對三葉青體外抗氧化活性的研究結果相符。后續可考慮從三葉青乙酸乙酯和石油醚萃取部位分離純化出有關單體化合物,進而篩選出其具體的抗氧化活性成分,為三葉青的進一步開發利用提供一定的理論基礎。

