茶多酚/直鏈淀粉復合物體系的構建及表征
景悅,劉華玲,史苗苗, ,劉延奇, *
1. 鄭州輕工業大學食品與生物工程學院(鄭州 450002);2. 食品生產與安全河南省協同創新中心(鄭州 450002)
淀粉主要由直鏈淀粉和支鏈淀粉組成,直鏈淀粉主要是由α-1, 4糖苷鍵連接而成的聚合物,在配體的存在下,如二甲基亞砜(DMSO)、碘、溴化鉀、氫氧化鉀(KOH)、芳香化合物、脂質、脂肪酸和線性醇等[4],直鏈淀粉發生構象變化,形成具有親水性表面和疏水性內螺旋孔道左手單螺旋結構的直鏈淀粉復合物[5]。因此,直鏈淀粉可用作包埋疏水性客體分子的壁材料。直鏈淀粉包埋多種分子形成復合物的研究已有數十年,近幾年才有直鏈淀粉作為生物活性物質載體的系統性研究[6]。
試驗使用直鏈淀粉為原料,在乙醇溶液中構建茶多酚/直鏈淀粉單螺旋包和體系。研究反應時間、茶多酚添加量、乙醇體積分數和反應溫度4個反應參數對茶多酚包埋率的影響。研究茶多酚/直鏈淀粉復合物的結晶結構和表觀特征,以期為茶多酚/直鏈淀粉復合物的開發應用提供理論基礎。
1 材料與方法
1.1 材料、設備與儀器
馬鈴薯淀粉(固原長城淀粉有限公司);茶多酚(上海源葉生物科技有限公司);無水乙醇、正辛醇、鹽酸(均為分析純)。
SHB-Ⅲ循環水式多用真空泵(鄭州長城科工貿有限公司);LG10-2.4A型高速離心機(北京醫用離心機廠);Philips XL-3型掃描電子顯微鏡(SEM,日本日立公司);Bruker TENSOR27型紅外光譜儀(FTIR)、Bruker D8型X-射線衍射儀(XRD),均為德國布魯克公司。
1.2 B型微晶淀粉的制備
B型微晶淀粉參照參考文獻[7]的方法制備得到。
1.3 直鏈淀粉-正辛醇復合物的制備
短直鏈淀粉-正辛醇復合物參照參考文獻[8]的方法制備得到。
透過分析我們可以知道,“喬做”就是假裝、裝作,“喬公道”意為裝好意、假作公平。“喬坐衙”亦作“喬作衙”,其字面意義為假裝坐堂問事,深層的隱含意義為裝模作樣擺架子。
1.4 茶多酚/直鏈淀粉復合物的制備
將無水乙醇以10∶1比例對直鏈淀粉-正辛醇復合物進行洗滌,重復3次,經過冷凍干燥后即得直鏈淀粉。將0.5 g直鏈淀粉分散于25 mL一定體積分數的乙醇溶液中配成2 g/100 mL的淀粉懸浮液,加入一定量茶多酚和乙醇溶液,混勻后恒溫保持一定時間,冷卻至室溫,在4 ℃下儲存18 h后離心,所得沉淀經過冷凍干燥后得到茶多酚/直鏈淀粉復合物。
1.5 茶多酚含量測定
通過酒石酸亞鐵分光光度法[9]測定茶多酚含量。
以茶多酚為標準,其在0~10 μ g/mL質量濃度范圍內,符合比爾定律,線性良好。此標準曲線的回歸方程為Y=0.003 84X+0.001 29(R2=0.990 6,回歸效果顯著)。
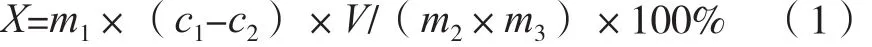
式中:X為茶多酚包埋率;m1為復合物質量,mg;c1為茶多酚總濃度,mg/mL;c2為分光光度計測得的茶多酚的濃度,mg/mL;V為溶劑體積,mL;m2為茶多酚質量,mg;m3為茶多酚與直鏈淀粉總質量,mg。
1.6 X-射線法分析(XRD)
取0.5 g淀粉樣品置于模具的圓形螺紋處,隨后用光滑的玻片壓平,用Burker D8型X-射線衍射儀測定,波長為0.154 2 nm的單色Cu-K α-射線。測試條件:管壓3 kV,管流20 mA,掃描速度4°/min,掃描區域5°~35°,采樣步寬0.04°,掃描方式為連續,重復次數為1[10]。
1.7 傅里葉紅外光譜(FT-IR)
樣品測試前,需將樣品與所需的KBr在40~50 ℃烘箱中干燥4~5 h,避免水分影響。稱取約2 mg樣品研細,加入150 mg干燥KBr,混合均勻并研細、壓片,壓片厚約0.5 mm,隨后將該薄片進行紅外掃描。測試條件:掃描波數范圍4 000~400 cm-1,分辨率4 cm-1,采用DTGS檢測器,以空氣為空白,掃描3次后取平均值,得到樣品的傅里葉紅外光譜圖[11]。
1.8 掃描電子顯微鏡(SEM)
觀察樣品之前,取出約2 mg樣品粘在導電膠上,利用噴涂儀對其進行鍍金處理,在操作電壓20 kV時,將樣品臺放入掃描電子顯微鏡下觀察,并拍攝具有代表性的樣品顆粒形貌的照片[12]。
1.9 軟件及數據處理方法
利用Origin 6.1軟件進行數據處理,得到X射線衍射圖譜和傅里葉紅外光譜。
2 結果與討論
2.1 茶多酚/直鏈淀粉復合物包埋效果影響因素的研究
茶多酚與直鏈淀粉的復合受多種因素的影響。試驗研究反應參數(反應時間、直鏈淀粉與茶多酚的比例、乙醇體積分數和反應溫度)對茶多酚包埋率的影響,結果如圖1所示。
2.1.1 反應時間對復合物包埋效果的影響
反應時間對茶多酚包埋效果的影響如圖1(a)所示。反應時間從0.5 h增加到2.0 h時,茶多酚的包埋率從9.37%提高到37.35%。反應時間低于1 h時,茶多酚包埋率較低,原因可能是反應時間較短,直鏈淀粉與茶多酚之間的反應不充分。反應時間進一步增加到4 h時,茶多酚包埋率幾乎保持不變。可能是反應開始時,茶多酚通過疏水作用進入直鏈淀粉的疏水腔,反應時間延長,部分茶多酚從疏水腔中釋放出來。
2.1.2 茶多酚添加量對茶多酚包埋效果的影響
茶多酚添加量對茶多酚包埋效果的影響如圖1(b)所示。隨著茶多酚添加量增加,茶多酚包埋率隨之增加。茶多酚添加量從50 mg增加到150 mg時,茶多酚包埋率從10.68%增加到35.55%。茶多酚添加量進一步增加到250 mg時,茶多酚包埋率幾乎保持不變。因此,茶多酚最佳添加量為200 mg,即直鏈淀粉與茶多酚質量比5∶2時,反應效果最好。
2.1.3 乙醇體積分數對茶多酚包埋效果的影響
乙醇體積分數對茶多酚包埋效果的影響如圖1(c)所示。乙醇體積分數10%時,茶多酚包埋率僅7.82%,乙醇體積分數從20%增加到50%時,茶多酚包埋率有較大提高,尤其乙醇體積分數40%時,茶多酚包埋效果最好,包埋率達36.15%。這與Shi等[13]的研究一致,直鏈淀粉與乙醇之間發生復雜反應,30%乙醇能保護直鏈淀粉的V型結構,減少其損傷。
2.1.4 反應溫度對茶多酚包埋效果的影響
反應溫度對茶多酚包埋效果的影響如圖1(d)所示。隨著反應溫度從20 ℃升高40 ℃,茶多酚包埋率從30.58%增加到38.14%。反應溫度從40 ℃升高到60℃時,茶多酚包埋率降低。總體上,反應溫度對茶多酚的包埋效果差異不明顯,因此反應溫度20~60 ℃范圍內對茶多酚包埋效果無顯著影響。

圖1 反應參數對茶多酚包埋率的影響。
2.2 最佳包埋率下所得復合物的結構表征
在最佳包埋率下制得直鏈淀粉-茶多酚復合物,采用XRD、SEM和FT-IR等對其結構性能進行表征。
2.2.1 掃描電鏡分析(SEM)
圖2是3種微晶淀粉的掃描電子顯微鏡照片。圖2(a)顯示,B型馬鈴薯淀粉微晶顆粒大小較為均勻,直徑約2 μ m,球晶顆粒形狀比較圓滑,呈球形結構。圖2(b)顯示,直鏈淀粉-正辛醇復合物扁平圓片狀結構,直徑約5 μm,表面相對光滑。圖2(c)顯示,茶多酚/直鏈淀粉復合物呈圓餅狀結構,直徑約5 μm,表面有破損且有大量小顆粒物質。這可能是制備茶多酚/直鏈淀粉復合物過程中,攪拌設備對樣品產生的機械破壞作用所造成復合物顆粒的破碎,較小的破碎物附著于淀粉顆粒表面的結果[14]。

圖2 掃描電子掃描顯微鏡圖
2.2.2 X射線衍射儀分析(XRD)
圖3中的4條曲線分別是茶多酚、B型微晶淀粉、直鏈淀粉-正辛醇復合物和茶多酚/直鏈淀粉復合物的X射線衍射圖。茶多酚無明顯吸收峰,B型馬鈴薯淀粉在6.06°,17.51°,22.59°和24.40°處出現特征衍射峰,直鏈淀粉-正辛醇復合物在7.48°,12.95°和19.79°處出現特征衍射峰,為V型微晶結構。以醇為溶劑制備所得的茶多酚/直鏈淀粉復合物在7.59°,13.11°和19.95°處出現特征衍射峰,為V型微晶淀粉。
2.2.3 傅里葉紅外波譜分析(FT-IR)
圖4是茶多酚、B型馬鈴薯淀粉、直鏈淀粉-正辛醇復合物和茶多酚/直鏈淀粉復合物的V型淀粉傅里葉紅外光譜圖。B型馬鈴薯淀粉在3 410 cm-1處出現一個寬而強的峰,是淀粉的—OH基的振動吸收峰。直鏈淀粉-正辛醇復合物在3 400 cm-1處出現吸收峰,與B型馬鈴薯淀粉相比,該峰向低波數方向移動,可能是淀粉的—OH基和正辛醇中的—OH基發生締合、疊加造成的[15]。茶多酚在3 380 cm-1處出現一個寬而強的峰,即酚類的—OH基的振動吸收峰。茶多酚/直鏈淀粉復合物在3 390 cm-1處出現吸收峰,與B型馬鈴薯淀粉相比,該峰朝低波數方向移動,可能是淀粉中的—OH基和茶多酚中的—OH基發生締合、疊加造成的。
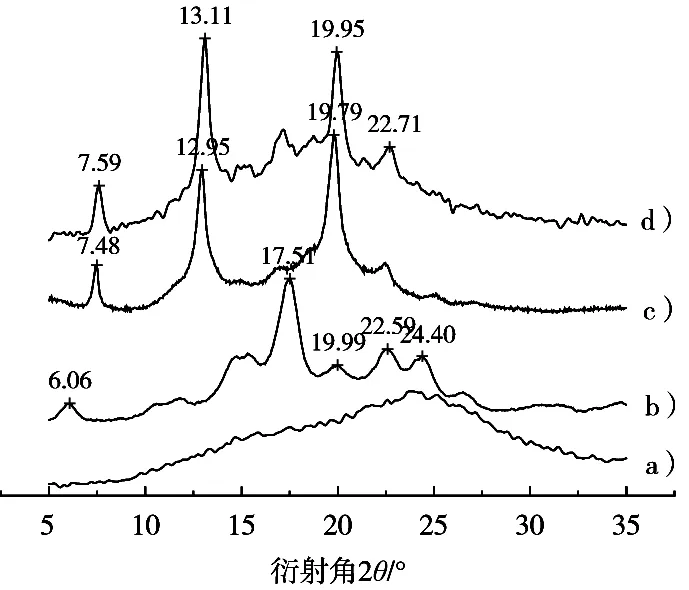
圖3 X射線衍射圖
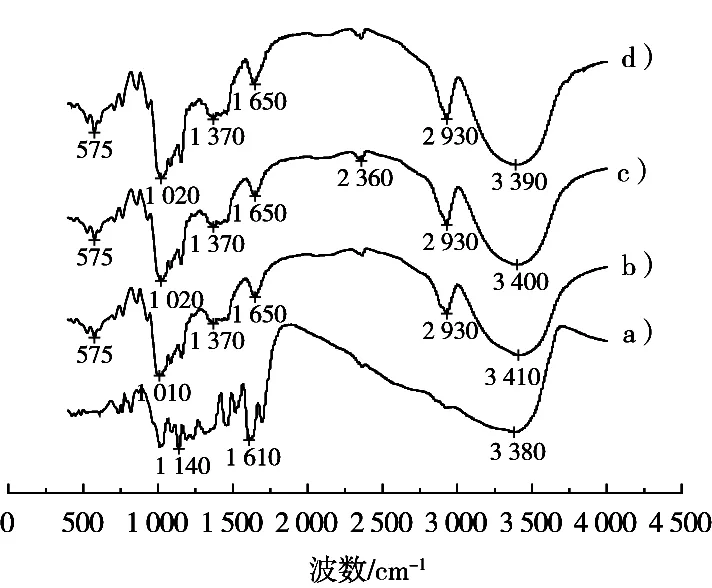
圖4 FT-IR圖譜
3 結論
構建茶多酚/直鏈淀粉單螺旋包和體系。以直鏈淀粉為原料,茶多酚為配體制備茶多酚/直鏈淀粉復合物,并對影響茶多酚包埋率的因素進行單因素試驗,研究得到制備茶多酚/直鏈淀粉復合物的最佳條件。通過掃描電子掃描顯微鏡觀測,發現直鏈淀粉-正辛醇復合物與茶多酚/直鏈淀粉復合物均為圓餅狀結構,直徑約5 μm。X射線衍射測試結果顯示,茶多酚/直鏈淀粉復合物是明顯的V型結晶結構,結晶度為41.61%。從紅外光譜中發現,茶多酚/直鏈淀粉復合物在3 390 cm-1處出現吸收峰向低波數方向移動,可能是茶多酚中的—OH基與淀粉中的—OH基在反應過程中共同產生的影響造成的。

