HBV 前S1編碼鏈鎖核酸的設計及體外抗HBV效果觀察
彭彬 許桂丹 韋武均 農順強 陳曉昊 肖樹榮 潘柳葉 鄧益斌
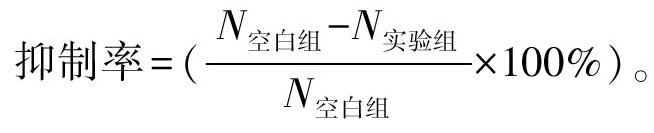
【摘要】 目的 針對乙型肝炎病毒(hepatitis B virus,HBV)前S1 dsDNA同聚嘌呤區設計反基因寡核苷酸藥物-鎖核酸(locked nucleic acid,LNA),并在體外觀察抑制HBV復制的效果。
方法 針對HBV前S1 dsDNA的3023~3037 nt、3094~3109 nt兩個同聚嘌呤區,利用RNA structure軟件分別設計并合成LNA,以陽離子脂質體為載體,將藥物轉染入HepG2.2.15細胞內,采用熒光定量PCR技術和化學發光免疫技術分別檢測3 d、6 d和9 d細胞培養上清液中HBV DNA和HBsAg的含量;CCK8法檢測鎖核酸對HepG2.2.15細胞代謝的影響。
結果 LNA對HepG2.2.15細胞的HBV DNA轉錄和HBsAg表達有顯著的抑制作用,并且抑制效果隨著時間進一步加強,在第9天的抑制率分別為45.37%和52.09%。兩個同聚嘌呤組與空白對照組比較差異均有統計學意義(均P<0.05),而封閉3023~3037nt同聚嘌呤區的LNA抑制作用較強,且最適序列長度為15~25 bp。CCK8實驗顯示LNA對HepG2.2.15細胞無任何明顯的代謝影響。
結論 針對前S1 dsDNA同聚嘌呤區的反基因鎖核酸分子在體外能夠有效地抑制HBV的復制,以封閉3023~3037 nt靶位效果較強,且合適序列長度為15~25 bp。
【關鍵詞】 反基因寡核苷酸藥物;乙型肝炎病毒;鎖核酸;反基因治療
中圖分類號:R73 文獻標志碼:A DOI:10.3969/j.issn.1003-1383.2020.02.003
【Abstract】 Objective To design an antisense oligodeoxynucleotide,a locked nucleic acid,against the pre-S1 dsDNA homopolyfluoride region of hepatitis B virus(HBV),and observe the inhibition effect of HBV replication in HepG2.2.15 cells.
Methods The two polymorphic regions of 3023-3037 nt and 3094-3109 nt of pre-S1 dsDNA of hepatitis B virus were designed and synthesized by RNA structure software.The transfected HepG2.2.15 cells were mediated by cationic liposome.Fluorescence quantitative polymerase chain reaction(PCR) and chemiluminescence immunoassay were used to detect the content of HBV DNA and HBsAg in cell culture supernatants at 3,6 and 9 days,respectively.The effect of LNA on the metabolism of HepG2.2.15 cells was detected by CCK8 method.
Results LNA significantly inhibited HBV DNA replication and HBsAg expression in HepG2.2.15 cells,and the inhibition rate increased with time.After 9 days,the inhibition rates were 45.37% and 52.09%,respectively.The difference between the experimental group and the control group was statistically significant (both P<0.05),while the blocking effect of LNA in the 3023-3037 nt polypyrogenic region was stronger,and the optimal sequence length was 15-25 bp.LNA has no significant metabolic effect on cells.
Conclusion The anti-gene-locked nucleic acid molecule targeting the pre-S1 dsDNA homomeric region can effectively inhibit the replication of HBV in vitro,and the effect of blocking the target of 3023-3037 nt is strong,and the suitable sequence length is 15-25 bp.
【Key words】 antisense oligodexymucleotide;hepatitis B virus;locked nucleic acid;antigene therapy
鎖核酸(locked nucleic acid,LNA)是近年來被人們發現的核苷酸衍生物,1994年,Rodriguez等在發酵副產物中發現LNA。四年后,Koshkin等[1]對LNA進行了第一次合成與雜交試驗,隨后,Wang等[2~3]進一步報道了LNA相關結構與性能的實驗。目前發現,鎖核酸在反基因治療應用中有著非常好的效果,與其他的寡核苷酸相比,鎖核酸具有以下優點:(1)LNA單體結合到寡核苷酸鏈中可以顯著地提高解鏈溫度,在與DNA、RNA互補成為雙鏈時可以提供很強的熱穩定性,每引入一個LNA單體,可以使解鏈溫度提高3℃[4~6];(2)LNA因其特殊結構,能夠具備抗3脫氧核苷酸酶降解的能力,抗酶解能力強[7~9];(3)LNA與DNA、RNA的結合可以對目的基因進行調控或者抑制,同時又可以被Rnase H識別,從而對mRNA進行降解[10~13];(4)LNA在與DNA、RNA結合時,具有出色的錯配辨別力[14];(5)脂溶性好[15];(6)半衰期長[16]。因此,為了觀察鎖核酸是否能夠抑制HBV DNA的復制和HBsAg的表達,本研究針對HBV preS1 dsDNA兩個同聚嘌呤區分別設計并合成鎖核酸序列,以脂質體介導為載體,將反基因藥物轉染入HepG2.2.15細胞株,并進一步觀察其抗乙肝病毒效果,為尋找新的乙肝病毒靶點和設計新型抗乙肝病毒藥物提供現實依據。
1 材料與方法
1.1 材料
HepG 2.2.15細胞是Hep2細胞在染色體上整合了HBV基因組的肝腫瘤細胞株,能夠在細胞上清液穩定表達HBsAg、HBeAg、HBV DNA等物質,由右江民族醫學院附屬醫院檢驗科許桂丹碩士惠贈,右江民族醫學院科學實驗中心常規培養于含G418、1%胎牛血清的高糖型DMEM培養基中,37℃、50 mL/CO2條件下;高糖型DMEM培養基、G418、胎牛血清等購自GIBCO公司;LipofectamineTM 3000購自美國Invitrogen公司;熒光定量PCR檢測HBV DNA試劑盒購自湖南圣湘生物科技有限公司;乙型肝炎病毒HBsAg定量檢測試劑盒購自鄭州安圖生物工程股份有限公司;化學發光免疫測定儀購自鄭州安圖生物工程股份有限公司;實時定量PCR儀購自美國ABI公司。
1.2 方法
1.2.1 反基因鎖核酸的合成與修飾
從NCBI基因庫中搜索到HBV ayw亞型全基因組序列(3.2 kb DNA,NC:003977.1,GI:21326584),利用RNA structure 6.0軟件針對編碼鏈的3023~3037 nt、3094~3109 nt兩個同聚嘌呤區分別設計1條長度不等的反基因寡核苷酸序列:(1)3023~3037 nt同聚嘌呤區:5CA*AA*TGCT*CCCGCT*C 3(15pb);(2)3094~3109 nt同聚嘌呤區:5T*GT*TGTCA*ATAT*GCC 3(15pb)。以上各序列中,標注*號的前一個堿基進行鎖核酸(LNA)修飾。各序列經BLAST排除與人同源后由上海生物工程有限公司合成修飾并純化。
1.2.2 實驗分組與脂質體轉染
本實驗設藥物組和空白組(未經轉染的HepG2.2.15細胞)。實驗組包括:(1)互補3023~3037 nt同聚嘌呤區序列:LNA-脂質體組;(2)互補3094~3109 nt同聚嘌呤區序列:LNA-脂質體組。將HepG 2.2.15細胞按1×105個/mL接種于6孔板培養板中,每孔最終稀釋量為 2 mL,實驗組為兩個,即3023~3037 nt同聚嘌呤區組,3094~3109 nt同聚嘌呤區組,每組復孔按照數字隨機表各設6個復孔,待細胞貼壁達50%~60%后分別在各組的每個復孔中加入用脂質體包裹著的反基因藥物,分別在3 d、6 d、9 d[17]收集各孔培養上清液(-20℃保存備用)。轉染步驟按脂質體說明書操作。
1.2.3 培養上清液HBsAg含量測定
采用化學發光免疫技術檢測,每個樣品重復測量3次,嚴格按試劑盒說明書及儀器操作說明書操作,HBsAg濃度以IU/mL表示。
1.2.4 培養上清液HBV DNA含量測定
采用實時熒光定量PCR法檢測。取培養上清液500 μL于新的1.5 mL EP管中,高速離心后留200 μL,加450 μL DNA提取液及4 μL內標溶液,100℃恒溫處理15 min。按比例(HBV PCR反應液27 μL/份+Taq酶3 μL/份)取相應量的PCR反應液及Taq酶,充分混勻后按30 μL/管分裝到PCR 八連管中,備用;往上述PCR反應管中用帶濾芯吸嘴分別按量加入處理過的待測樣本核酸、陰性質控品、強陽性質控品、臨界陽性質控品及不同濃度的定量參考品的上清液各20 μL,蓋緊PCR管蓋后瞬時離心數秒后放置于熒光定量PCR儀中,擴增條件:92℃預變性 2 min,93℃ 45 s,55℃ 60 s共 10個循環,93℃ 30 s,55℃ 45 s 共30個循環,72℃終延伸5 min共1個循環。由計算機軟件自動分析所收集的熒光信號并計算出定量結果,采用計算對數平均值的方法計算HBV DNA平均拷貝數。并按以下公式計算抑制率:
抑制率=(N空白組-N實驗組N空白組×100%)。
1.2.5 鎖核酸對細胞毒性檢測
根據CCK8比色法操作說明書檢測反基因藥物鎖核酸對HepG2.2.15細胞代謝活性的影響。
1.3 統計學方法
所有數據應用SPSS 17.0統計學軟件分析,計量資料符合正態分布,采用均數±標準差(±s)表示,組間比較采用One-Way ANOVA檢驗,進一步兩兩比較采用LSD檢驗,若方差不齊則用Games-Howell,檢驗水準:α=0.05,雙側檢驗。
2 結果
2.1 封閉不同靶位的反基因鎖核酸抑制HBV DNA復制的效果
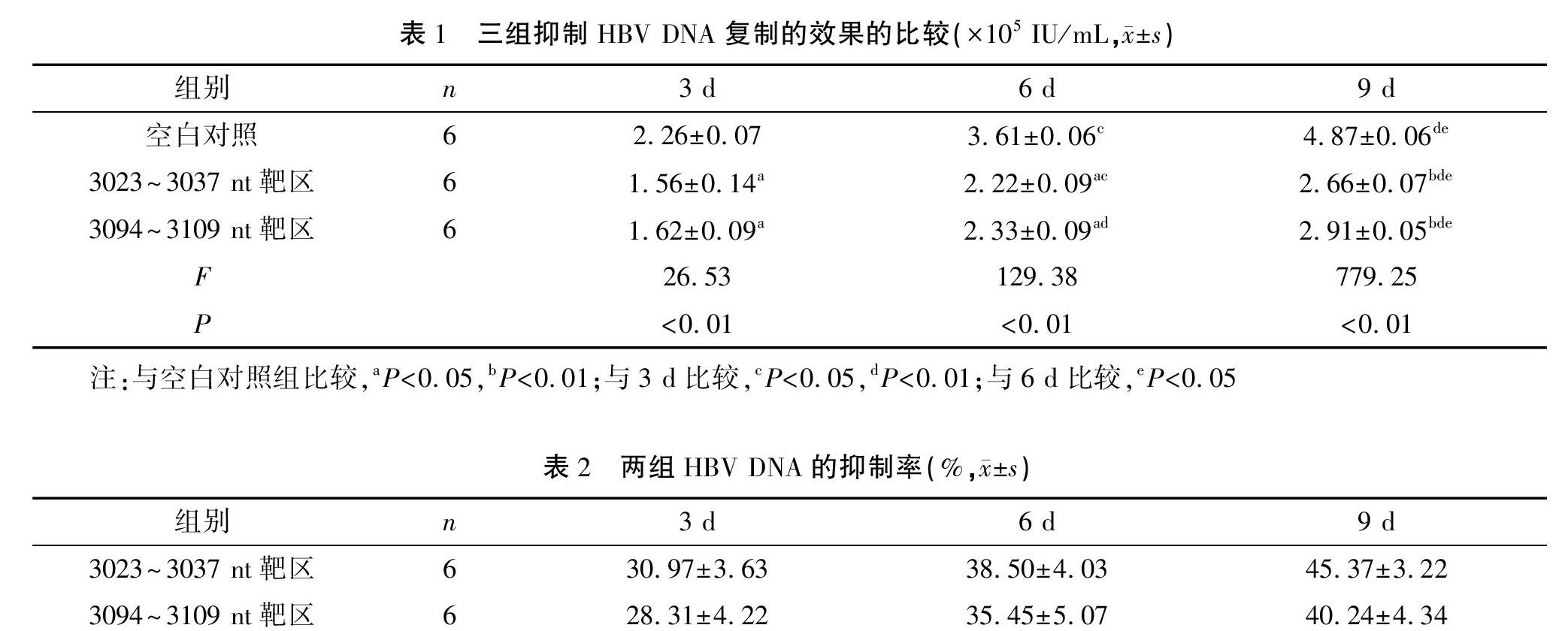
鎖核酸加入第3天后,HBV DNA的復制、轉錄即開始受到抑制,且抑制效果隨著時間推移進一步升高。兩個實驗組與空白對照組比較差異有統計學意義(均P<0.05),而封閉3023~3037 nt同聚嘌呤區的反基因LNA對HBV DNA復制的抑制效果最明顯。見表1。
2.2 封閉不同靶位的反基因鎖核酸抑制HBV DNA復制率
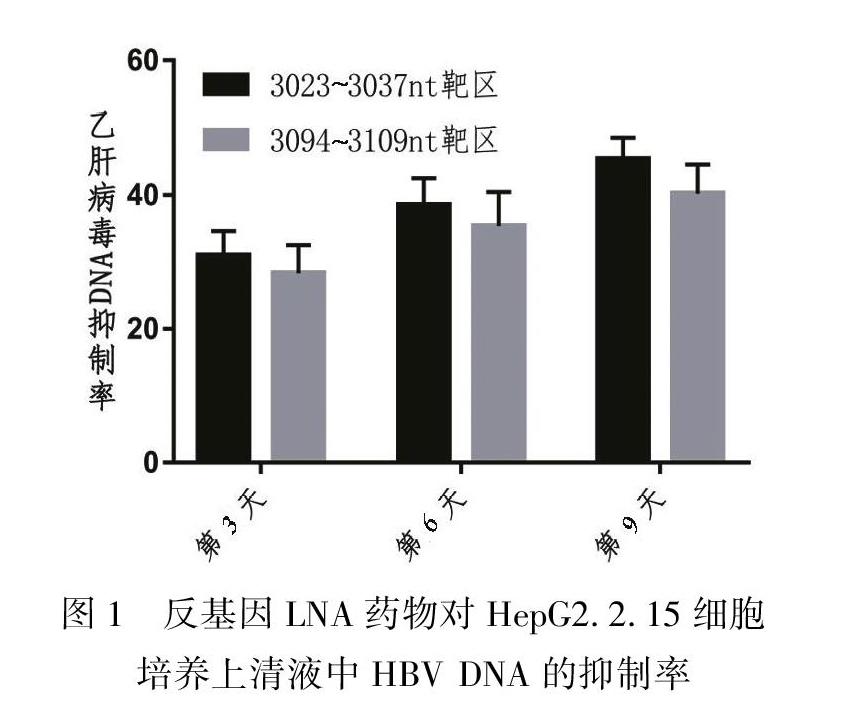
在反基因鎖核酸加入9 d后抑制率最高可以達到45.37%,兩個不同的靶區以3023~3037 nt同聚嘌呤區封閉效果最強。見表2、圖1。
2.3 反基因鎖核酸對乙型肝炎病毒表面抗原(HBsAg)表達的抑制作用
反基因藥物鎖核酸加入第3天后,鎖核酸對HBsAg的表達開始發揮抑制作用,且抑制效果隨著時間的增加呈現上升的趨勢,兩個實驗組與對照組比較差異有統計學意義(均P<0.05),而3023~3037 nt靶區對HBsAg表達的抑制作用最強。見表3。
2.4 反基因鎖核酸對乙型肝炎病毒表面抗原(HBsAg)表達的抑制率
反基因寡核酸藥物鎖核酸加入第3天后,LNA對HBsAg的表達開始發揮抑制作用,3023~3037 nt靶區對HBsAg表達的抑制作用最強。見表4、圖2。
2.5 CCK8比色法檢測鎖核酸對細胞代謝的影響
用藥第9天,采用CCK8比色法檢測鎖核酸組A 值為(2.209±0.006),對照組A 值為(2.207±0.008),比較差異無統計學意義(P>0.05),提示反基因藥物鎖核酸對HepG2.2.15細胞代謝基本無影響。
3 討論
含有前S1的蛋白主要存在于Dane顆粒和管型顆粒上,前S1蛋白在病毒侵入人體的復制和轉錄等過程起到了非常重要的作用,是急性乙型肝炎的臨床診斷、療效觀察和預后的良好指標。
因此,本研究針對HBV前S1 ds DNA編碼鏈的3023~3037 nt靶區和3094~3109 nt靶區兩個同聚嘌呤區設計合成1條序列長度不等的反基因鎖核酸分子,由LipofectamineTM 3000脂質體介導轉染HepG2.2.15細胞株,通過檢測空白組和實驗組的HBV DNA和HBsAg含量等指標來評價反基因鎖核酸分子的療效,實驗結果顯示,封閉3023-3037 nt靶區在體外抑制preS1 基因復制與表達的作用最強,抑制作用隨時間呈遞增趨勢,其中,在9 d的 HBV DNA抑制率是45.37%、HBsAg為 52.09%,這兩個序列長度相同,在同一實驗中,對乙肝病毒DNA、HBsAg的抑制效果以3023~3037 nt靶區最強,可能說明該區相對于3094~3109 nt靶區來說更加能夠有效地通過核孔進入細胞核內,識別并結合到HBV dsDNA的同聚堿基配對區形成三鏈雜交分子,能夠更加有效地對病毒靶基因的復制和表達起到抑制作用,具體機制尚未清楚,下一步實驗將針對該機制進行研究, 為后面研究反基因鎖核酸在HBV治療上提供了重要的理論、實驗依據。此外,CCK8檢測結果證實鎖核酸對細胞的代謝活性無明顯毒性作用。
總之,通過對比preS1 dsDNA同聚嘌呤區的反基因鎖核酸分子的兩條序列,觀察HBV DNA、HBsAg等實驗指標,以封閉3023~3037 nt靶區效果最強,且合適序列長度在15~25 bp之間,這為前S1的靶位提供了理論和實驗依據,也為HBV的藥物治療提供了有效的靶位。
參 考 文 獻
[1]Kumar R,Singh SK,Koshkin AA,et al.The first analogues of LNA (locked nucleic acids):phosphorothioate-LNA and 2-thio-LNA[J].Bioorg Med Chem Lett,1998,8(16):2219-2222.
[2]Wang G,Gunic E,Girardet JL,et al.Conformationally locked nucleosides.Synthesis and hybridization properties of oligodeoxynucleotides containing 2,4-C-bridged 2-deoxynucleosides[J].Bioorg Med Chem Lett,1999,9(8):1147-1150.
[3]Wang G,Middleton PJ,Lin C,et al.Biophysical and biochemical properties of oligodeoxy-nucleotides containing 4-C- and 5-C-substituted thymidines[J].Bioorg Med Chem Lett,1999,9(6):885-890.
[4]Kumar P,Truong L,Baker YR,et al.Synthesis,Affinity for Complementary RNA and DNA,and Enzymatic Stability of Triazole-Linked Locked Nucleic Acids (t-LNAs)[J].ACS Omega,2018,3(6):6976-6987.
[5]Booy EP,Mcrae EK,Koul A,et al.The long non-coding RNA BC200 (BCYRN1) is critical for cancer cell survival and proliferation[J].Mol Cancer,2017,16(1):109.
[6]Tian K,Chen X,Luan B,et al.Single Locked Nucleic Acid-Enhanced Nanopore Genetic Discrimination of Pathogenic Serotypes and Cancer Driver Mutations[J].ACS Nano,2018,12(5):4194-4205.
[7]Kasuya T,Hori S,Watanabe A,et al.Ribonuclease H1-dependent hepatotoxicity caused by locked nucleic acid-modified gapmer antisense oligonucleotides[J].Sci Rep,2016,6:30377.
[8]Dieckmann A,Hagedorn PH,Burki Y,et al.A Sensitive In Vitro Approach to Assess the Hybridization-Dependent Toxic Potential of High Affinity Gapmer Oligonucleotides[J].Mol Ther Nucleic Acids,2018,10:45-54.
[9]Biagetti M,Cuccioloni M,Bonfili L,et al.Chimeric DNA/LNA-based biosensor for the rapid detection of African swine fever virus[J].Talanta,2018,184:35-41.
[10] Ogino S,Konishi H,Ichikawa D,et al.Detection of fusion gene in cell-free DNA of a gastric synovial sarcoma[J].World J Gastroenterol,2018,24(8):949-956.
[11] Gougelet A,Sartor C,Bachelot L,et al.Antitumour activity of an inhibitor of miR-34a in liver cancer with beta-catenin-mutations[J].Gut,2016,65(6):1024-1034.
[12] Komatsu H,Inui A,Umetsu S,et al.Evaluation of the G145R Mutant of the Hepatitis B Virus as a Minor Strain in Mother-to-Child Transmission[J].PLoS One,2016,11(11):e165674.
[13] Javanbakht H,Mueller H,Walther J,et al.Liver-Targeted Anti-HBV Single-Stranded Oligonucleotides with Locked Nucleic Acid Potently Reduce HBV Gene Expression In Vivo[J].Mol Ther Nucleic Acids,2018,11:441-454.
[14] Fontenete S,Carvalho D,Guimaraes N,et al.Application of locked nucleic acid-based probes in fluorescence in situ hybridization[J].Appl Microbiol Biotechnol,2016,100(13):5897-5906.
[15] 鄧益斌,農樂根,梁祚仁,等.LNAzyme設計及其體外特異性抑制丙型肝炎病毒C基因的表達[J].世界華人消化雜志,2014,22(14):1992-1997.
[16] 鄧益斌,農樂根,梁祚仁,等.HCV LNAzyme對病毒5非編碼區基因調控的特異性抑制作用[J].基礎醫學與臨床,2014,34(10):1363-1366.
[17] 鄧益斌,溫旺榮.反基因鎖核酸體外抑制乙肝病毒前S1基因表達[J].基礎醫學與臨床,2013,33(6):722-725.
(收稿日期:2019-07-08 修回日期:2019-11-02)
(編輯:梁明佩)

