沉默GOLPH3對人胃癌細胞遷移與侵襲能力的影響及機制
魏紅權 賴麗琴 劉珺 韓小于 王園園 潘慶
GOLPH3基因位于人染色體5P13上,是一個高度保守的33KDa蛋白,定位于高爾基體反面網狀結構[1-2],不僅能維持高爾基體扁平結構,還參與將細胞表面受體和蛋白從內體逆轉運到高爾基體反面網狀結構的過程,起到運輸的作用[2-3],Scott等[4]研究報道高爾基磷酸化蛋白 3(golgi phosphoprotein 3,GOLPH3)在癌中可以調節mTOR信號途徑及增強癌細胞對雷帕霉素的敏感性,首次提出GOLPH3是一個全新的致癌基因,并能通過mTOR信號系統促進人類癌細胞增殖。為進一步探討GOLPH3基因對胃癌細胞遷移與侵襲能力的影響及其機制,本研究運用基因沉默的方法將GOLPH3-shRNA質粒轉染人胃癌BGC-823細胞,觀察GOLH3對胃癌細胞侵襲、轉移能力及侵襲相關分子基質金屬蛋白酶(MMP)-2和MMP-9分泌的影響,為胃癌的基因靶向治療提供新的策略和途徑。
1 材料和方法
1.1 主要試劑 Lipofectamine 2000購自美國Invitrogen公司,TotalRNA提取試劑盒購自日本Takara公司,RNA逆轉錄試劑盒購自日本TaKaRa公司,蛋白提取試劑盒購自上海碧云天生物,小鼠抗人GOLPH3抗體購自美國Proteinte公司,小鼠抗人MMP-2、MMP-9抗體購自美國SantaCruz公司,ECL發光試劑盒購自美國Millipore公司。GOLPH3-shRNA質粒及陰性對照由上海吉瑪公司合成,見表1。
1.2 研究方法
1.2.1 細胞培養、轉染與分組 人胃癌細胞BGC-823購自上海通派公司,飽和濕度,置于含有100U/ml青霉素、100g/ml鏈霉素、含20%小牛血清(FBS)的1640培養基中,37℃、5%CO2培養箱中培養。取對數生長期的細胞,接種到6孔板中(5×105/孔),待細胞貼壁后,按照Lipofectamine 2000試劑盒的實驗步驟進行轉染。轉染后的細胞于37℃、5%CO2培養箱中繼續培養4~6h后換液,繼續培養24h,篩選,獲得穩定轉染干擾載體的細胞,分為對照組(轉染無關序列質粒的NC-shRNA組)和3個實驗組(轉染3個目的基因質粒,分別為GOLPH3-shRNA1組、GOLPH3-shRNA2組、GOLPH3-shRNA3組)。
1.2.2 轉染后胃癌細胞BGC-823中GOLPH3的mRNA和蛋白的檢測 (1)qRT-PCR法檢測GOLPH3的mRNA水平:采用MiniBEST通用RNA提取試劑盒提取總RNA,-80℃保存。使用帶有gDNA擦除器的Prime-ScriptRRT reagent Kit逆轉錄合成 cDNA。用 SYBR Premix Ex Taq和Bio Rad CFX-96 PCR system進行qRT-PCR分析。GOLPH3基因的引物序列上游:5′-CTCCAGAAACGGTCCAGAAC-3′,下游 5′-CCACCAGGTTTTTAGCTAATCG-3′,擴增條件:95℃預變性 10min;94℃30s,56℃退火 30s,68℃ 30s,40 個循環;以 2-ΔΔCt值表達目的基因的相對表達量,每個樣本重復3次。(2)Western blot法檢測GOLPH3的蛋白水平:用預冷的PBS洗滌BGC-823細胞2次以上,加入100μl的RIPA細胞裂解液,4℃、12 000r/min離心15min,取上清液,進行蛋白質定量后,常規進行聚丙烯酰胺凝膠電泳,上樣量為50μg,轉膜、封閉后轉印至膜,加入小鼠抗人GOLPH3(工作濃度 1∶1 000)和 β-actin(工作濃度1∶2 000)作為一抗,4°C 孵育過夜后,加入辣根過氧化物酶標記的抗小鼠IgG(工作濃度1∶2 000)作為二抗,ECL化學發光,分析條帶的灰度值并與各自的內參β-actin的比值來判斷目的蛋白的表達水平。并據此從GOLPH3-shRNA1組、GOLPH3-shRNA2組、GOLPH3-shRNA3組中選取對GOLPH3基因干擾效果最好一組穩定轉染細胞株做后續實驗。
1.2.3 轉染后BGC-823細胞遷移能力檢測 采用劃痕實驗法。在6孔板上用DMEM(含10%FBS)培養細胞,待細胞融合后,用移液器槍頭用力劃直線,PBS沖洗3次,洗去劃痕產生的細胞碎片。0、24h分別采用Olympus IX50顯微鏡和Image-Pro Plus軟件捕獲和記錄細胞遷移的圖像,以遷移率表示細胞的遷移能力。遷移率=(劃痕后即刻劃痕面積—劃痕后24h劃痕面積)/劃痕后即刻劃痕面積×100%。實驗重復3次,取平均值。
1.2.4 轉染后BGC-823細胞的侵襲能力檢測 采用侵襲實驗法。接種細胞,調整細胞密度至1×106/ml,取細胞懸液200μl加入Transwell小室的上室內,下室加入600μl FBS,在37℃的CO2培養箱培養24h。取出Transwell小室,棄去6孔板孔中培養液,用無鈣的PBS洗2遍,甲醇固定30min,膜下面用0.1%結晶紫染色20min。400倍顯微鏡下隨機取5個視野計數細胞,取平均數。每組重復3次,取平均值。

表1 GOLPH3-shRNA干擾序列
1.2.5 轉染后 BGC-823細胞 MMP-2、MMP-9 mRNA表達水平檢測 采用qRT-PCR法。MMP-2基因的引物序列上游:5′-ATTCCGCTTCCAGGGCACAT-3′,下游5′-CACCTTCTGAGTTCCCACCAA-3′,MMP-9 基因的引物序列上游:5′-GTCCACCCTTGTGCTCTT-3′,下游5′-TGCCACCCGAGTGTAACCAT-3′。方法同 1.2.2。
1.2.6 轉染后細胞培養上清液中MMP-2和MMP-9活性檢測 采用明膠酶譜法。取轉染后的細胞在無血清DMEM培養基中培養24h。次日收集上清液,將上清液移入離心管中2 000r/min離心10min,-80℃保存。樣品與上樣緩沖液按照3∶1混合后,在含有0.1%明膠的10%SDS-PAGE凝膠中行電泳分離,電泳結束后,將凝膠置于洗脫液中振蕩洗脫4次,每次15min,然后置于孵育液中37℃孵育24h,孵育結束后經染色液染色及脫色液脫色后,顯示出MMP-2(Active-MMP-2或pro-MMP-2),MMP-9(Active-MMP-9 或 pro-MMP-9)為位于藍色背景上的透亮帶,用凝膠圖像分析系統分析讀取條帶面積,寬度和灰度值,做統計分析。
1.3 統計學處理 采用SPSS 13.0統計軟件。計量資料用表示,多組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 各組細胞GOLPH3 mRNA和蛋白表達水平的比較與 NC-shRNA 組比較,GOLPH3-shRNA1、GOLPH3-shRNA2、GOLPH3-shRNA3組 GOLPH3 mRNA和蛋白表達水平均明顯降低,差異均有統計學意義(均P<0.05);與 GOLPH3-shRNA1 組比較,GOLPH3-shRNA2、GOLPH3-shRNA3組GOLPH3 mRNA和蛋白表達水平均明顯升高,差異均有統計學意義(均P<0.05),因此選用GOLPH3-shRNA1組細胞株做后續實驗。見表1、圖1。
2.2 兩組BGC-823細胞遷移能力的比較 劃痕后24h,GOLPH3-shRNA1組中細胞遷移率(13.20±2.00)%,明顯低于對NC-shRNA組(40.37±5.37)%,差異有統計學意義(P<0.05),見圖 2(插頁)。
2.3 兩組BGC-823細胞侵襲能力的比較 GOLPH3-shRNA1組中細胞穿過基底膜的細胞數(67.00±7.20)個,明顯比 NC-shRNA 組(110.00±9.50)個少,差異有統計學意義(P<0.05),見圖 3(插頁)。
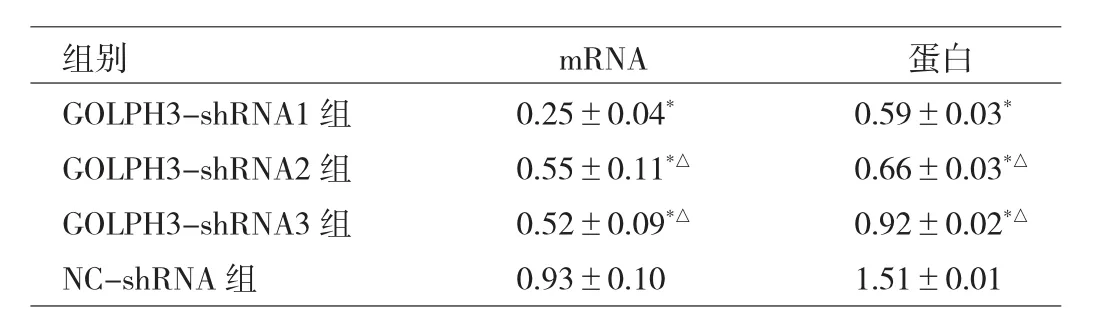
表1 轉染后各組細胞中GOLPH3的mRNA和蛋白表達水平的比較
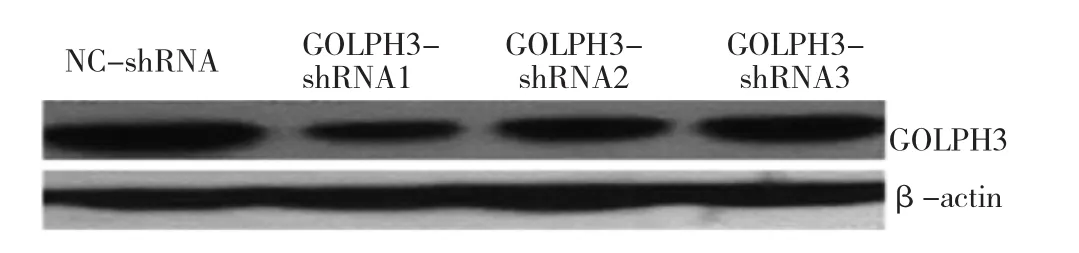
圖1 4組細胞GOLPH3蛋白表達水平的電泳圖
2.4 各組細胞MMP2、MMP9 mRNA表達水平的比較GOLPH3-shRNA1組細胞中,MMP2、MMP9 mRNA表達水平分別為0.49±0.04和0.69±0.04,均低于NC-shRNA組1.00±0.08和1.00±0.04,差異均有統計學意義(均P<0.05)。
2.5 各組細胞培養上清液 MMP-2和MMP-9活性的比較 與 NC-shRNA組相比,GOLPH3-shRNA1組Active-MMP-2、pro-MMP-9活性分別下降 44.2%和29.9%,差異均有統計學意義(均P<0.05),見圖4。
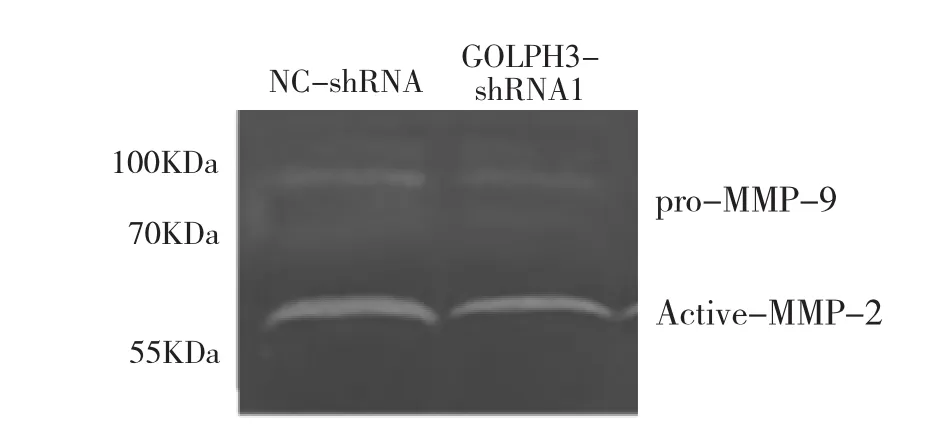
圖4 各組細胞培養上清液MMP-2和MMP-9活性的比較
3 討論
胃癌是全球第2大癌癥導致死亡的病因[5],盡管胃癌治療包括手術和化療均取得了一些進展,但胃癌患者的預后仍然較差,尤其是晚期患者,美國和歐洲的相對5年存活率是20%左右[6]。因此,尋找胃癌的新治療靶點和腫瘤發生機制具有重要的臨床意義。囊泡運輸,特別是內吞轉運,在癌癥的發生和轉移中起著重要作用[7],內吞轉運調整的信號級聯和表面生長因子受體可能存在新的靶點。最近的研究表明,GOLPH3作為一種與高爾基體相關的內吞蛋白,與囊泡形成、轉運有關,在口腔、非小細胞肺癌,食道等多種癌癥中呈現高表達,具有致癌基因的作用[8-10],以往的研究表明,胃癌患者血清中GOLPH3濃度顯著高于健康人,胃癌組織中GOLPH3的高表達與腫瘤大小、組織學分級、浸潤深度、淋巴結轉移密切相關[11-12]。因此本研究旨在進一步研究GOLPH3基因對胃癌細胞的侵襲、遷移的影響,GOLPH3-shRNA1質粒轉染胃癌細胞BGC-823后,qRT-PCR和Western blot法檢測結果顯示GOLPH3 mRNA和蛋白表達水平明顯低于NC-shRNA組細胞,差異有統計學意義。劃痕實驗表明,GOLPH3-shRNA1組細胞運動愈合劃痕的比例,明顯低于NC-shRNA組,侵襲實驗證實,GOLPH3-shRNA1組細胞穿過膜的細胞數量,明顯少于NC-shRNA組,差異均有統計學意義,表明沉默GOLPH3基因,能使胃癌細胞的遷移和侵襲能力明顯降低。
GOLPH3能通過mTOR信號系統促進人類癌細胞增殖[4],而已有研究表明,在多種腫瘤中通過增加PI3K/Akt/mTOR活性可上調幾種MMPs的表達[13-14],MMPs是一種螯合了鋅離子的蛋白酶類,主要功能是降解各種類型的膠原、纖連蛋白、層粘連蛋白和蛋白聚糖等細胞外基質成分,因此MMPs在腫瘤新生血管生成、腫瘤侵襲和轉移中扮演著重要的角色[15-16],其中,MMP-2和MMP-9在癌癥轉移起著至關重要的作用[16],因此筆者假設,GOLPH3能夠通過調節MMP-2或MMP-9,來影響腫瘤細胞的浸潤與轉移。本實驗結果顯示,GOLPH3-shRNA1組中,MMP-2、MMP-9 mRNA表達水平,均低于NC-shRNA組,差異均有統計學意義,明膠酶譜實驗表明GOLPH3-shRNA1組中Active-MMP-2、pro-MMP-9的活性也明顯低于對照組細胞,差異有統計學意義。這些結果證實了筆者的假設,GOLPH3很可能通過增加MMP-2和MMP-9的表達與活性,從而促進胃癌細胞的遷移與侵襲,具體的機制有待于進一步的研究。
本研究結果表明,GOLPH3-shRNA1可以特異性沉默BGC-823細胞中GOLPH3的表達,并降低MMP-2與MMP-9的表達及活性,有效地抑制該細胞的遷移和侵襲,今后筆者將進一步研究他的調控機制,為胃癌發病機制的研究提供了新的線索。

圖2 轉染GOLPH3-shRNA1后BGC-823細胞遷移能力的比較

圖3 兩組BGC-823細胞侵襲能力顯微鏡下所見(×400)

