DCE-MRI聯合DWI對原發性肝癌患者陽性檢出率的影響
徐明月 張曉萍 黃慧儀 李朝隆
【摘要】 目的 分析磁共振動態增強掃描(DCE-MRI)聯合彌散加權成像(DWI)對原發性肝癌患者陽性檢出率的臨床價值。方法 70例原發性肝癌患者, 分析并比較DCE-MRI、DWI及DCE-MRI聯合DWI檢查的影像學表現以及陽性符合率。結果 在DCE-MRI、DWI以及DCE-MRI聯合DWI動態掃描中, 分別有47、51、69例患者檢查顯示病變部位信號強度顯著高于周圍正常組織, 均在門脈期和延遲期表現為低信號或者為等信號。DCE-MRI檢查小肝癌型、結節型、塊狀型陽性符合率分別為68.18%、69.57%、64.00%, DWI檢查小肝癌型、結節型、塊狀型陽性符合率分別為77.27%、77.27%、72.00%, DCE-MRI聯合DWI檢查小肝癌型、結節型、塊狀型陽性符合率分別為100.00%、100.00%、96.00%。DCE-MRI聯合DWI檢查小肝癌型、結節型、塊狀型三種原發性肝癌陽性符合率均高于DCE-MRI、DWI單獨檢查, 差異有統計學意義(P<0.05)。結論 DCE-MRI聯合DWI檢查應用于原發性肝癌患者診斷中可提高病變部位的陽性檢出率, 兩種檢查方法聯合使用對于肝臟的診斷價值較高。
【關鍵詞】 磁共振動態增強掃描;彌散加權成像;原發性肝癌;診斷
DOI:10.14163/j.cnki.11-5547/r.2020.01.023
肝癌是我國最常見的惡性腫瘤, 是國內主要導致死亡的腫瘤之一, 近年來肝癌的發病率和病死率均有上升的趨勢[1]。肝臟初期病變的診斷對于患者的治療和預后都有很大的幫助。磁共振動態增強掃描(dynamiccon-trast-enhanced MRI, DCE-MRI)可以提供腫瘤血管滲透性方面的定量分析參數, 不僅可以提供肝臟病變形態學的特征, 還能反映出病變血管循環的改變[2, 3], 彌散加權成像(diffusion weighted imaging, DWI)能對肝臟組織結構及細胞特性進行定量分析, DWI能夠比常規MRI獲得更多的信息, 對明確人體各種生理活動和病理變化都有非常重大的意義。本研究分析原發性肝癌患者DCE-MRI聯合DWI定量分析的數據, 探討其在肝臟病變診斷中的臨床價值, 現報告如下。
1 資料與方法
1. 1 一般資料 選取本院2016年9月~2018年12月收治的70例原發性肝癌患者, 所有研究對象經過組織病理活檢和免疫組織化學檢驗診斷, 并且臨床資料齊全。男35例, 女35例;年齡40~65歲, 平均年齡(55.3±5.2)歲;病程2~14個月,?平均病程(6.7±2.5)個月;根據腫瘤類型可分為:小肝癌型(病灶直徑<3 cm)22例, 結節型(病灶直徑為3~5 cm)23例, 塊狀型( 病灶直徑>5 cm)25例。
1. 2 納入與排除標準 納入標準:均經臨床組織證實為小肝癌型、結節型、塊狀型的發性肝癌; 事先與所有患者說明本研究方案, 并且所有患者自愿簽署知情同意書。排除標準:患者癌癥擴散到其他組織器官, 或者患有其他臟器的實質性病變。
1. 3 方法 DCE-MRI檢查方法:采用飛利浦1.5 T Mutiva核磁共振, 使用16通道體部相控線圈采集MR信號。對患者在平掃后均進行四期動態增強掃描。DCE-MRI均采用橫斷面屏氣掃描, 每次采集時間約為12 s/次。使用增強T1高分辨率各向同性容積采集(e-THRIVE)序列:TR:4.3 ms, TE:
2.1 ms, 厚層:6 mm, 層間距:0 mm, 視野:410×309 mm, 矩陣:292×154, 翻轉角為12°。對比劑為扎噴酸葡胺, 用藥劑量為0.1 mmol/kg, 注藥流速為2 ml/s, 在注藥開始時即開始進行連續信號采集, 共采集10次, 采集時間約為14~17 s/次, 總共采集時間約為2~3 min, 必要時再增加延遲采集, 每次采集前吩咐患者吸氣后比屏住氣。
DWI檢查方法:選擇單次激發的平面回波序列進行橫斷面掃描, 設置上下預飽和帶, 加用脂肪抑制技術。B值采用0、800 s/mm2, 診斷圖像采用B值=800 s/mm2, 激勵次數:4, FOV:320~430 mm, TR:4000~4500 ms, TE:55~93 ms, 層厚:8 mm, 層間距1 mm, 采集矩陣180×130, 層數:28~36。
由兩名以上主治醫師采用雙盲法觀察、分析DCE-MRI、DWI檢查不同類型肝癌的差異, 一旦存在不同, 則由兩位醫師共同判斷, 然后分析并比較DCE-MRI、DWI及DCE-MRI聯合DWI檢查的影像學表現以及陽性符合率。
1. 4 統計學方法 采用SPSS22.0統計學軟件處理數據。計數資料以率(%)表示, 采用χ2檢驗。P<0.05表示差異有統計學意義。
2 結果
2. 1 影像學表現 在DCE-MRI、DWI以及DCE-MRI聯合DWI動態掃描中, 分別有47、51、69例患者檢查顯示病變部位信號強度顯著高于周圍正常組織, 均在門脈期和延遲期表現為低信號或者為等信號。
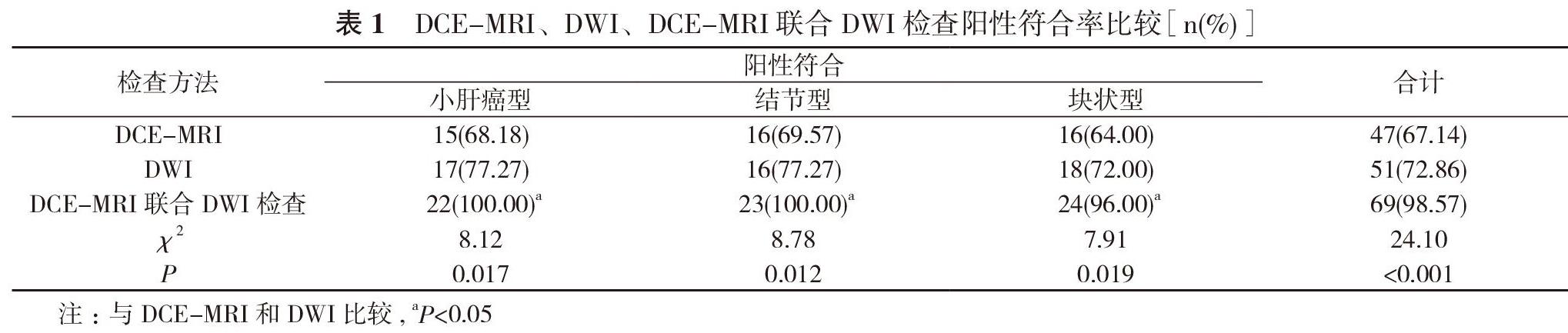
2. 2 DCE-MRI、DWI、DCE-MRI聯合DWI檢查陽性符合率比較 DCE-MRI檢查小肝癌型、結節型、塊狀型陽性符合率分別為68.18%、69.57%、64.00%, DWI檢查小肝癌型、結節型、塊狀型陽性符合率分別為77.27%、77.27%、72.00%,
DCE-MRI聯合DWI檢查小肝癌型、結節型、塊狀型陽性符合率分別為100.00%、100.00%、96.00%。DCE-MRI聯合DWI檢查小肝癌型、結節型、塊狀型三種原發性肝癌陽性符合率均高于DCE-MRI、DWI單獨檢查, 差異有統計學意義(P<0.05)。見表1。
3 討論
近年來, DWI聯合DCE-MRI開始應用與癌癥組織的篩查中。高分辨率DWI比標準雙側DWI能更詳細地評估腫瘤的形態。DWI測量的表觀擴散系數(ADC)為DCE-MRI動力學提供了清晰和互補的信息, 對肝臟病變的定性和綜合診斷提高準確性。DWI利用布朗運動提供了影響水的微觀流動性的內在組織特性的信息。ADC在腫瘤顯像中與腫瘤的侵襲性和腫瘤反應有關[4]。影響DWI的組織特性與DCE-MRI不同, DCE-MRI依靠增強動力學反映的組織血管差異來識別肝臟惡性腫瘤。雖然DWI還沒有常規用于臨床肝臟成像, 但以前的研究報道了肝臟良惡性病變[5, 6]的ADC值的差異以及通過ADC和DCE-MRI特征的多變量組合來提高診斷準確率。有研究表明是將定量DWI與計算機輔助評估生成的DCE-MRI動力學特征聯系起來, 并證明較低的病變ADC值(代表較高的細胞密度)與更多的可疑動力學有關。此外, 多因素分析顯示ADC和曲線類型是良惡性病變的獨立預測因子, 并證實DWI為DCE-MRI動力學提供了補充信息。在曲線動力學和ADC值上預測惡性腫瘤的大范圍表明, DCE-MRI和DWI-MRI聯合信息顯示了提高MRI檢查肝臟特異性的潛力。這些發現與最近的其他研究一致, 這些研究表明, 將DWI納入臨床肝臟MRI評估有助于提高診斷性能[7]。未來DWI將能夠評估特定病變亞組的模型性能, 如腫塊與非腫塊病變, 以及不同的良惡性組織學。本研究結果表明, DCE-MRI聯合DWI檢查小肝癌型、結節型、塊狀型三種原發性肝癌陽性符合率均高于DCE-MRI、DWI單獨檢查, 差異有統計學意義(P<0.05)。提示聯合使用對于病灶的良好篩查效果。
雖然DWI聯合DCE-MR檢查這項研究中沒有進行廣泛的成本效益分析, 但通過不斷的改進會減少不必要的活組織檢查的數量。此外, 單憑ADC和最差曲線的可比診斷準確性表明, 對比劑(Gd-DTPA)較敏感的患者(如腎功能不全的患者)DWI可能有潛在的好處, 這一點在臨床上是十分有價值的, 可以降低與手術相關的患者的發病率, 此外, 單用ADC和最差曲線的相對診斷精度也表明, DWI對于那些不能使用對比劑的患者(Gd-DTPA)可能有潛在的好處[8, 9]。有研究表明, 使用高分辨率DWI可以比標準雙側DWI更詳細地評估腫瘤形態。雖然雙側DWI的ADC值不同, 但兩種技術均可區分良性和惡性病變。雙側DWI的ADC值均顯著低于其他病變, 并且與文獻報道的ADC值相似[10]。盡管ADC值明顯較低, 但雙側DWI和高分辨率DWI在區分良性和惡性病變方面是相同的, 因此只要調整異常ADC值的閾值, ADC的這種差異幾乎沒有臨床影響[11]。
綜上所述, DCE-MRI聯合DWI檢查應用于原發性肝癌患者診斷中可提高病變部位的陽性檢出率, 此種檢查方法診斷價值較高。
參考文獻
[1] 鄧娟. 磁共振彌散加權成像聯合LAVA動態增強掃描診斷肝臟局灶性病變的臨床價值. 醫學綜述, 2014, 20(13):2473-2474.
[2] Boss MK, Muradyan N, Thrall DE. DCE-MRI: A review and applications in veterinary oncology. Veterinary and Comparative Oncology, 2011, 11(2):87-100.
[3] Kido A, Fujimoto K, Okada T, et al. Advanced MRI in malignant neoplasms of the uterus. Journal of Magnetic Resonance Imaging, 2013, 37(2):249-264.
[4] Padhani AR, Liu G, Mu-Koh D, et al. Diffusion-Weighted Magnetic Resonance Imaging as a Cancer Biomarker: Consensus and Recommendations. Neoplasia, 2009, 11(2):102-125.
[5] Guo Y, Cai YQ, Cai ZL, et al. Differentiation of clinically benign and malignant breast lesions using diffusion-weighted imaging. Journal of magnetic resonance imaging : JMRI, 2002, 16(2):172-178.
[6] Woodhams R, Matsunaga K, Kan S, et al. ADC Mapping of Benign and Malignant Breast Tumors. Magnetic Resonance in Medical Sciences, 2005, 4(1):35-42.
[7] Lehman CD, Gatsonis C, Kuhl CK, et al. MRI Evaluation of the Contralateral Breast in Women with Recently Diagnosed Breast Cancer. New England Journal of Medicine, 2007, 356(13):1295-1303.
[8] Rubesova E, Grell AS, Maertelaer VD, et al. Quantitative diffusion imaging in breast cancer: A clinical prospective study. Journal of magnetic resonance imaging : JMRI, 2006, 24(2):319-324.
[9] Guo Y, Cai YQ, Cai ZL, et al. Differentiation of clinically benign and malignant breast lesions using diffusion-weighted imaging. Journal of magnetic resonance imaging: JMRI, 2002, 16(2):172-178..
[10] 付振杰. DCE-MRI聯合DWI對肝臟局灶性結節性病變患者病灶陽性檢出率的影響. 現代醫用影像學, 2018, 27(4):245, 267.
[11] 敬文斌. DWI聯合DCE-MRI對肝臟局灶性結節性病變的診斷價值. 中國CT和MRI雜志, 2018, 16(11):94-97.
[收稿日期:2019-11-19]

