銅錳鈰復合氧化物催化甲苯燃燒研究
左滿宏,郭喜文,高 超*,劉恩莉,徐敏燕
(1.西安元創化工科技有限公司,陜西 西安 710061; 2.魯西催化劑有限公司,山東 聊城 252211)
揮發性有機化合物(VOCs)通常指在常溫下,沸點(50~260) ℃的各種有機化合物[1]。工業上通常以組分復雜、低濃度、高通量和大體積等特點排放到大氣,這些揮發性有機化合物對人類和環境造成巨大傷害[2]。甲苯是典型的VOC,具有揮發性和易燃性。甲苯去除技術包括吸附[3]、催化燃燒[4]、光催化降解[5]和物理分離[6]。催化燃燒法是去除甲苯的最經濟的策略之一,它具有更大的處理能力,更高的效率和更低的操作溫度(低于550 ℃)。目前,貴金屬催化劑和過渡金屬氧化物催化劑已廣泛應用于甲苯催化燃燒[7]。貴金屬催化劑催化性能更加優異,更易活化C—H鍵,但是貴金屬活性組分鉑、鈀價格高,且對氯或硫敏感,易中毒,長時間高溫反應,活性組分易燒結導致性能下降。過渡金屬氧化物催化劑(如CuO和MnO2)便宜并且對氯或硫有一定耐受力,不宜中毒,有時硫和氯還可以作為促進劑修飾和改善催化劑的氧化性能[8]。
近年來,具有尖晶石結構(AB2O4)的多元復合氧化物廣泛應用于催化、儲能、鋰電池等方面,AB2O4型化合物中A、B位金屬陽離子的選擇多樣,晶體結構的差異通常會在光、電、磁、熱等激發誘導下引起物化性能的顯著變化,展示出較好的應用前景。在催化領域,CuMn2O4尖晶石以離子結合方式多樣性和在晶體結構中的靈活性著稱。雖然CuMn2O4尖晶石在甲苯催化氧化過程中具有良好的氧化還原性能,但尖晶石的供氧能力和儲氧能力不足限制了催化性能的進一步提升。CeO2表現出良好的儲存-釋放氧能力,CeO2與過渡金屬之間獨特的電子相互作用可以顯著促進催化材料的氧化還原性能。Lu Hanfeng等[9]研究了用于甲苯燃燒反應的Cu-Mn,Cu-Mn-Ce和Cu-Ce混合氧化物催化劑,發現Cu-Mn-Ce三元催化活性最高。
本文通過一種簡單的共沉淀方法制備了具有高比表面的Cu-Mn-Ce催化劑并將其應用于甲苯催化燃燒。新型的Cu-Mn-Ce催化劑表現出更好的催化活性,并且在很長時間里催化劑仍然具有很高的催化活性。
1 實驗部分
1.1 原 料
硝酸錳、硝酸銅、硝酸鈰,均為分析純,國藥集團化學試劑有限公司;石英砂,(10~20) 目,天津石英鐘廠霸州市化工分廠;
1.2 催化劑制備
采用共沉淀法由前驅體鹽制備Cu1-yMn2CeyOx(y=0.1、0.2、0.3):將Mn(NO3)2、Cu(NO3)2·3H2O和Ce(NO3)3·6H2O以適當的物質的量比溶解于去離子水中,得到溶液(Mn2+濃度為0.01 M作為基準)。以Cu0.9Mn2Ce0.1O4為例,將Cu(NO3)2·3H2O、50%Mn(NO3)2和Ce(NO3)3·6H2O溶于200 mL去離子水中,以 0.25 mol·L-1NaOH調節pH=10,攪拌24 h。過濾后在真空烘箱中333.15 K干燥,在馬弗爐中空氣氣氛下423.15 K焙燒1 h除去樣品中剩余的水分,馬弗爐升溫速率5 K·min-1,同樣速率升溫至823.15 K焙燒4 h即得所需催化劑。
1.3 催化劑表征
XRD表征采用荷蘭PANalytical 公司X′Pert Powder 型多功能粉末衍射儀。
催化劑比表面積及孔結構表征采用美國麥克儀器公司TriStar3 000化學吸附儀,N2為吸附氣體,樣品在液氮溫度77 K進行吸附-脫附,測定前,樣品在300 ℃真空脫氣3 h,根據BET公式計算樣品的比表面積和孔體積。
1.4 催化劑性能評價
催化劑性能評價采用固定床反應器,石英反應管(內徑11 mm)中加入(60~80) 目的催化劑200 mg。質量流量計控制含甲苯體積分數0.2%的空氣為反應原料,流量120 mL·min-1,空速10 000 h-1。甲苯入口和出口濃度采用GC7900氣相色譜分析,火焰離子化檢測器,Carbowax 20M/Chromosorb W色譜柱,柱箱溫度為423.15 K。
2 結果與討論
2.1 表征結果
圖1是Cu1-yMn2CeyO4(y=0.1、0.2、0.3)的XRD圖。由圖1可知,Cu0.9Mn2Ce0.1O4、Cu0.8Mn2Ce0.2O4和Cu0.7Mn2Ce0.3O4中均觀察到尖晶石結構的CuMn2O4衍射峰(JCPDS-ICDD 74-2422),其中2θ=18.5o、30.4o、35.85o、37.5o、43.58o、47.7o、57.6o、63.3o為CuMn2O4特征衍射峰。CuMn2O4衍射峰尖銳,表明其晶形相對完整。與CuMn2O4相比,Cu1-yMn2CeyO4(y=0.1、0.2、0.3)的XRD圖中可以觀察到CeO2(JCPDS-ICDD 89-8436)的存在,2θ=28.5o、33.08o、47.5o、56.3o、59.09o為CeO2的特征衍射峰。CuMn2O4和CeO2峰位置發生紅移,表明CuMn2O4和CeO2的晶面間距發生了變化。3種催化劑中均未觀察到其他相,如CuO和MnOx,原因在于一方面形成了尖晶石結構,另一方隨著Cu含量的降低,一些相對過量的Mn發生電子轉移,Mn3+向Mn4+價態變化,以維持尖晶石的電中性,而其他的Mn則進入CeO2晶格。
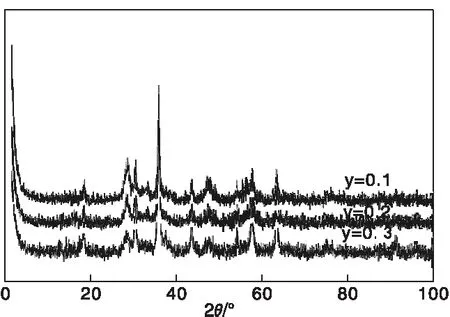
圖1 Cu1-yMn2CeyO4(y=0.1、0.2、0.3)的XRD圖Figure 1 XRD patterns of Cu1-yMn2CeyO4(y=0.1,0.2,0.3)
Cu1-yMn2CeyO4(y=0.1、0.2、0.3)催化劑的比表面積、孔容和孔徑如表1所示。由表1可知,3種催化劑孔徑(2.742~3.832) nm之間,表明Cu1-yMn2CeyO4(y=0.1、0.2、0.3)為介孔材料。甲苯分子直徑為0.6 nm,催化劑可較為容易的提供甲苯有效吸附通道,為氣固相反應提供大量的物理吸附位點和擴散通道,提高反應速率。
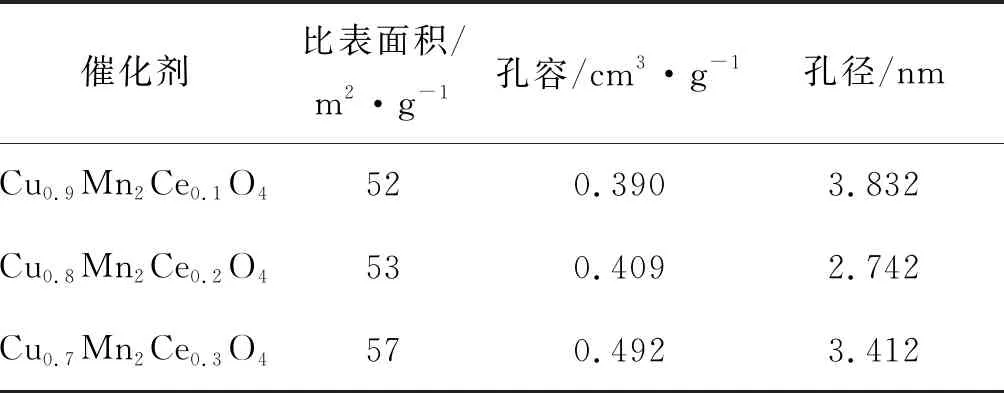
表1 Cu1-yMn2CeyO4(y=0.1、0.2、0.3)的比表面、孔容和孔徑
2.2 催化劑活性
Cu0.8Mn2Ce0.2O4催化劑及文獻[10-12]中銅、錳催化體系的甲苯燃燒活性如表2所示。由表2可知,同文獻中報道的不同含過渡金屬的催化劑相比,本文制備的Cu1-yMn2CeyO4性能較好,反應溫度更低。
不同反應溫度下,Cu1-yMn2CeyO4(y=0.1、0.2、0.3)催化劑上甲苯轉化率如圖2所示。由圖2可知,Cu0.8Mn2Ce0.2O4催化劑上甲苯轉化率最高,反應溫度大于292 ℃時,甲苯完全降解。催化劑活性順序為Cu0.8Mn2Ce0.2O4>Cu0.9Mn2Ce0.1O4>Cu0.7Mn2Ce0.3O4>CuMn2O4。Cu0.8Mn2Ce0.2O4催化劑壽命評價發現該催化劑穩定性良好。催化劑的性能取決活性組分的分散度,CuMn2O4尖晶石結構和CeO2的添加量。在Cu1-yMn2CeyO4催化劑中,CeO2和CuMn2O4有明顯的相互作用。由于Cu含量的降低,CuMn2O4尖晶石中Mn3+向Mn4+轉化,將尖晶石的Mn4+引入CeO2晶格中,產生CeO2(111)晶格面中的晶格缺陷。

表2 自制催化劑和文獻中催化劑的甲苯燃燒性能
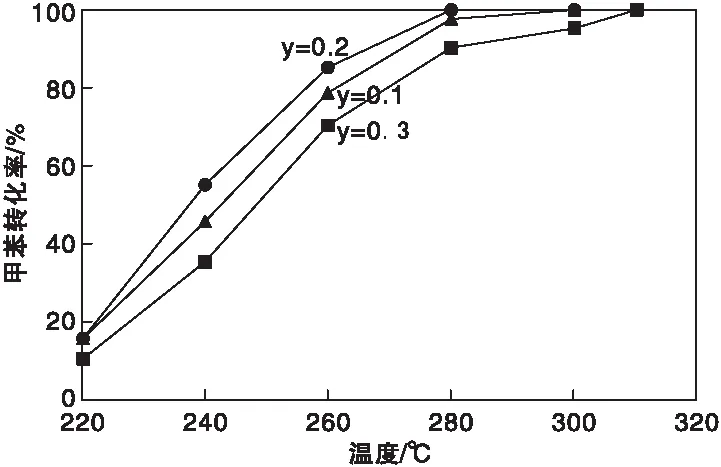
圖2 Cu1-yMn2CeyO4(y=0.1、0.2、0.3)催化燃燒甲苯轉化率Figure 2 Catalytic activity of Cu1-yMn2CeyO4(y=0.1、0.2、0.3) for toluene oxidation
2.3 反應機理
為進一步研究甲苯氧化反應過程,采用GC-MS分析Cu0.8Mn2Ce0.2O4催化劑上甲苯全氧化反應過程中的副產物,結果如表3所示。由表3可知,未檢測到副產物苯酚和氫醌,這主要是由于這些分子反應活性較高;副產物乙炔、甲基乙炔,二甲基甲烷具有鏈烷烴特征,它們的存在可以通過芳環的開環和催化裂化來解釋;副產物甲烷和苯可以通過甲苯的裂解來解釋。通常,GC-MS觀察的主要副產物如果是甲烷和苯,由于甲烷和甲苯比開環和催化裂化產物的氧化難度大,可判斷催化劑性能方面表現不佳。

表3 Cu0.8Mn2Ce0.2O4催化劑質譜觀察到的副產物痕跡
本研究的主要副產品是一氧化碳和甲苯的開環和催化裂化產物,Cu0.8Mn2Ce0.2O4具有較少量的副產物苯。因此,Cu0.8Mn2Ce0.2O4更容易開環和催化裂解芳環。一氧化碳的完全氧化溫度在Cu0.8Mn2Ce0.2O4上較低,開環和催化裂化產物完全氧化溫度也不高。總的來說,Cu0.8Mn2Ce0.2O4對甲苯氧化是非常有效的。
3 結 論
通過共沉淀法成功制備了一系列不同負載量的Cu1-yMn2CeyO4(y=0.1、0.2、0.3)催化劑。Cu0.8Mn2Ce0.2O4具有良好的甲苯降解催化穩定性,得益于CeO2-CuMn2O4與Cu0.8Mn2Ce0.2Ox高分散的相互作用。與CuMn2O4相比,Cu0.8Mn2Ce0.2O4中Cu含量的降低促進了Mn3+向Mn4+的電子轉移,當尖晶石中過量的Mn被引入CeO2晶格時,Ce含量的增加產生了氧空位。

