多囊卵巢綜合征患者血清特異性LncRNA表達譜研究
吳鑌莎 余寧 盧佳敏 李小青 周怡池 萬凌屹 謝遲遲 張娟文 鄭若姮
多囊卵巢綜合征(polycystic ovary syndrome,PCOS)是一種以持續排卵障礙、高雄激素血癥及胰島素抵抗(insulin resistance,IR)為特征的生殖內分泌常見疾病,其發病率在育齡期婦女中達5%~10%,占不排卵性不孕癥的50%~70%[1]。PCOS以不孕、多毛、無排卵及月經不調等為主要臨床表現,同時伴有特征性的血清生化指標改變,如雄激素及促黃體激素(luteinizing hormone,LH)水平上升但卵泡刺激素(follicle stimulating hormone,FSH)水平正常等。PCOS是一種多因性疾病,與遺傳[2]、基因多態性[3]、代謝綜合征[4]及環境[5]等因素密切相關,但具體機制仍然未明,且缺少特異性的分子生物學診斷標志物。本研究聯合長鏈非編碼核糖核酸(long noncoding ribonucleic acid,LncRNA)表達芯片初篩及實時定量逆轉錄-聚合酶鏈反應(quantitative real time polymerase chain reaction,qRT-PCR)驗證,構建 PCOS特異性表達譜,進一步采用生物信息學方法推測其可能的下游基因通路,為PCOS分子生物學診斷方法的研發提供新思路。
1 對象和方法
1.1 對象 選取2017年1月1日至2018年6月30日在浙江大學醫學院附屬第一醫院就診的50例PCOS患者為PCOS組,同期在體檢中心常規體檢的50例健康人群作為對照。PCOS的診斷依據鹿特丹標準(至少滿足以下3條標準中的2條):(1)排卵減少或不排卵;(2)臨床雄激素過高征,包括多毛、痤瘡、男性化的脫發以及高雄激素血癥;(3)B超檢查見一側或雙側卵巢直徑2~9mm的卵泡≥12個和(或)卵巢體積≥10cm3。本研究經醫院倫理委員會審查批準,兩組對象均知情同意。
1.2 方法
1.2.1 血清RNA提取 采集所有對象血清5ml,-80℃保存備用。每例取血清 100~500μl,加入 800μl Trizol-LS,振蕩混勻;加入 10μl 0.1pmol/μl的 miRNA156,振蕩混勻,靜置15min。加入200μl氯仿,劇烈振蕩,靜置15min;16 000g離心20min。取上清液,加入400μl水飽和酚,振蕩混勻,靜置1~2min;16 000g離心3min。取上清液,加入200μl水飽和酚和200μl氯仿,振蕩混勻,靜置1~2min;16 000g離心 3min。取上清液(約 800μl),分至兩管,每管加入1ml異丙醇,振蕩混勻,靜置于冰上20min;4℃、16 000g離心20min。棄上清液,每管加入500μl 75%焦碳酸二乙酯(DEPC)-乙醇,振蕩后16 000g離心20min。棄上清液,用吸水紙在試管口將剩余液體吸干,開蓋晾干(若液體仍較多,可用移液槍將液體吸出,但應注意不要碰到管底)。每管加入15μl DEPC水,靜置待RNA溶解后,將兩管合并。
1.2.2 LncRNA表達譜檢測 從PCOS組、對照組分別隨機選取3例血清標本進行LncRNA表達譜檢測。使用Nanodrop測定提取RNA在分光光度計260、280、230nm處的吸光度,以進行濃度測定與純度評估。用甲醛電泳試劑進行變性瓊脂糖凝膠電泳,檢測RNA純度及完整性。采用人類8*60KLncRNA芯片進行信號采集,該芯片包含有30 586個人LncRNA位點(Arraystar,Rockville,Maryland,USA)。首先根據單色微陣列基因表達分析流程(Agilent Technology,Santa Clara,USA)進行樣本的標記與序列雜交,再利用安捷倫圖像獲取軟件11.0.1.1進行圖像分析。后續的分位數標準化與數據處理在GeneSpring GX v12.1軟件(Agilent Technologies)中進行。聯合分析組間t檢驗(P<0.05)、多重假設檢驗(FDR<0.05)和倍數變化(>2或<0.5)的結果,得到顯著性差異的LncRNA表達譜。進一步以熱圖形象化顯示可區分PCOS患者和健康人群的差異表達LncRNA。
1.2.3 LncRNA的qRT-PCR驗證 選取包含接受芯片檢查對象在內的PCOS患者和健康人群各6例,使用Prime Script RTreagent試劑盒(TakaRa,大連,中國)針對熱圖得到的差異表達LncRNA進行qRT-PCR驗證。U6核小RNA(snRNA)進一步擴增,作為內參。將每個LncRNA的絕對表達量除以U6 snRNA的絕對表達量,得到LncRNA的相對表達量。
1.2.4 生物信息學分析 將芯片得到的顯著上調和下調的LncRNA,利用starbase網站(http://starbase.Sysu.edu.cn)進行下游調控靶基因預測。將預測得到的信使RNA(mRNA)進行基因本體注釋(gene ontology,GO)富集分析,以得到潛在的共同細胞生物學功能。
1.3 統計學處理 采用SPSS 11.0統計軟件。每項實驗至少進行3次,正態分布的計量資料用±s表示,兩組比較采用兩獨立樣本t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 兩組對象一般資料比較 與對照組相比,PCOS組體重指數(body mass index,BMI)、睪酮、甘油三酯、C 反應蛋白(C-reactive protein,CRP)水平及胰島素抵抗穩態模型(homeostasis model assessment-insulin resistance,HOMA-IR)明顯增高,雌二醇水平明顯降低,差異均有統計學意義(均P<0.05);兩組對象年齡、膽固醇水平比較,差異均無統計學意義(均P>0.05),見表1。
2.2 PCOS患者LncRNA表達譜的構建 與對照組比較,PCOS組患者血清中分別有351、217種顯著上調和下調的LncRNA(符合變化系數≥2.0,P<0.05)。進一步作聚類分析,發現包含顯著上調的11種LncRNA和顯著下調的8種LncRNA的數據集可以成功區分PCOS患者和健康人群,見圖1(插頁)。
2.3 差異表達LncRNA的驗證 通過qRT-PCR驗證熱圖中所列LncRNA,與對照組比較,在PCOS組上調的LncRNA中,ENST00000433673和 CTC-338M123未達到顯著性差異;在PCOS組下調的LncRNA中,ENST00000569039未達到顯著性差異。qRT-PCR結果進一步支持LncRNA芯片作為初篩方法的靈敏度和特異度。

表1 兩組對象一般資料比較
2.4 LncRNA下游靶基因的GO富集分析 選取PCOS患者LncRNA芯片中顯著上調和下調的LncRNA各20個,輸入Starbase網站進行下游基因預測,得到的靶基因作進一步GO富集分析,結果發現顯著上調LncRNA預測的mRNA共涉及11個相關GO生物學功能,包括細胞生長和體積的負調控、N-乙酰葡萄胺/葡萄胺代謝過程、氨基糖代謝過程、細胞組分大小和定位調控、細胞腔;顯著下調LncRNA預測的mRNA共涉及20個相關GO生物學功能,包括基因及表觀遺傳學負調控、細胞活化調控、細胞周期、淋巴血管發育、鈣離子反應、染色質重塑、離子轉運、干擾素r生物合成過程正調控、血細胞發生、嘌呤堿生物合成、結合調控、mRNA接合位點選擇、細胞運動、轉錄、白細胞活化調控,見圖2。
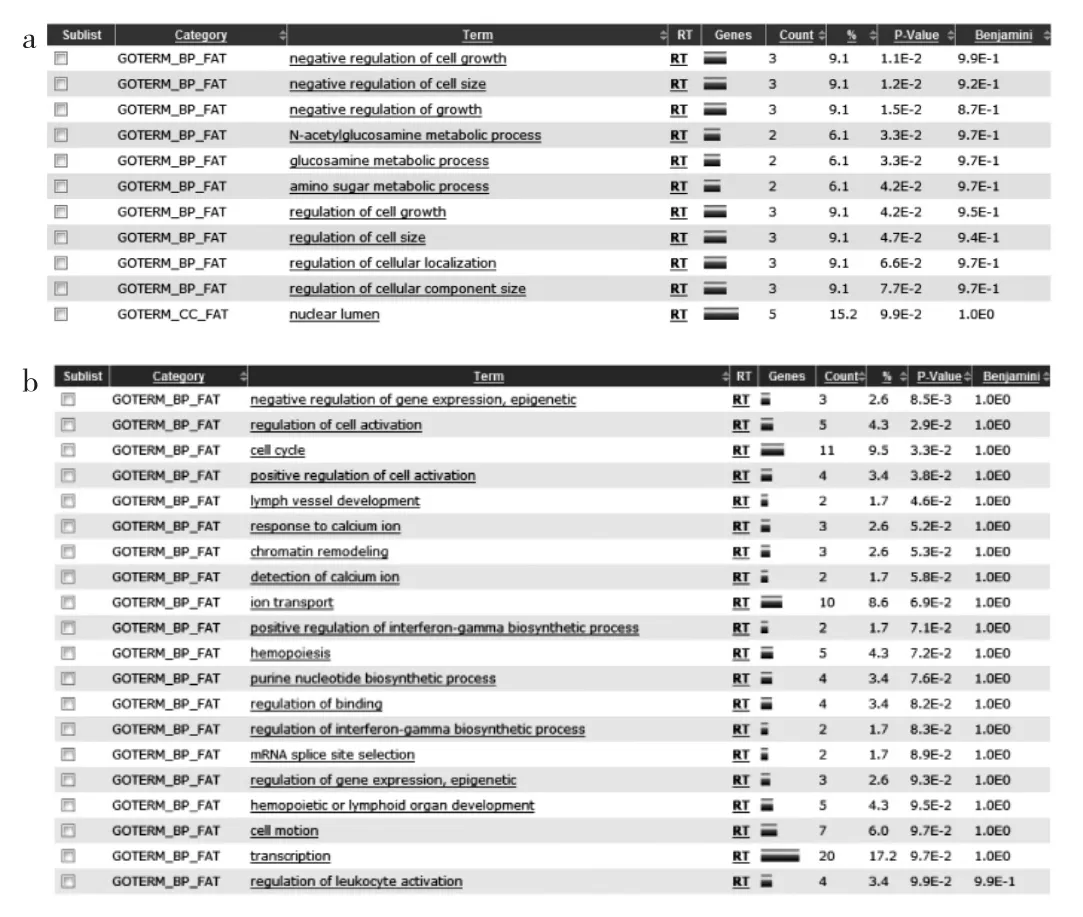
圖2 差異表達LncRNA所預測靶基因的GO富集分析(a:顯著上調LncRNA所預測的下游mRNA;b:顯著下調的LncRNA所預測的下游mRNA)
3 討論
當前PCOS的診斷多采用2003年鹿特丹標準[6]。各項研究表明 PCOS除引起生殖功能和代謝功能的異常外,還可增加子宮內膜癌、血脂異常、心血管疾病和2型糖尿病的發病風險。有報道指出,PCOS可并發雄激素性脫發、睡眠呼吸暫停、抑郁、妊娠期高血壓、先兆子癇、非酒精性脂肪性肝病等[7],病情嚴重時可能影響女性一生的健康。由此可見,早期診斷和治療是至關重要的。因此,構建PCOS非侵入性的分子標志物群,不僅有助于提高疾病的臨床檢出率,實現早期診療,對于PCOS的研究、減輕社會經濟負擔也有重要意義。
LncRNA是一類長度介于200~100 000個核苷酸的非編碼RNA[8]。目前研究認為,它在表觀遺傳學水平、轉錄水平及轉錄后水平上廣泛地參與腫瘤調節基因的表達,從而在復雜的腫瘤調控網絡中發揮重要作用[9]。此外,LncRNA通過調控下游靶基因參與各種病理、生理過程(如腫瘤發生、信號轉導、血管生成等)也是當前學術界研究的熱點。然而,LncRNA在PCOS中的研究并不多見,且主要集中于其下游調控機制的研究(如LncRNA-GS5促進PCOS患者的IR[10]、LncRNA介導的內源競爭RNA網絡在PCOS患者卵母細胞核成熟中的作用[11])或組織LncRNA表達譜的變化(如PCOS患者顆粒細胞[12]和卵丘細胞[13])。
血清存在著多種蛋白、糖質、色素、電解質、無機鹽,同時還匯集了來自全身組織器官的多種信號分子。目前組織中LncRNA分子已被證實是一類新型疾病標志物,而血清中LncRNA是否存在同樣的效能,是當前研究的最熱點問題之一。Chen等[14]最早闡明了血清中存在穩定的miRNA(一種短鏈RNA)并且在不同疾病之間miRNA的表達譜存在有顯著性差異,支持血清中非編碼RNA存在的可能。此后,血清LncRNA在食管鱗癌[15]、膀胱癌[16]和乳腺癌[17]中的預測作用陸續被發現,使得血清LncRNA表達譜在疾病中的作用日益受到重視。血清LncRNA作為新型疾病標志物,具有檢出譜系廣、靈敏度高、檢測成本低、取材方便、樣本易存放(-20℃存放即可)等優點,該方法可廣泛用于疾病普查等相關工作,成為了早期診斷疾病的有效手段。但是筆者檢索了國內外文獻,關于血清LncRNA在PCOS中的研究未見報道。
本研究通過LncRNA表達譜研究,闡明了PCOS患者差異性表達的LncRNA;并進一步作聚類分析,發現包含顯著上調的11種LncRNA和顯著下調的8種LncRNA的數據集可以成功區分PCOS患者和健康人群。針對聚類分析的結果,進一步采用qRT-PCR進行驗證,發現16種LncRNA差異表達與芯片結果一致,符合率達84.2%。在這些差異表達的LncRNA中,既往研究提示CCAT1與腫瘤發生、發展密切相關,如其通過介導下游Runx2基因參與人宮頸癌的增殖和上皮細胞向間質細胞的轉變[18];XLOC家族中的006390被報道可以通過穩定c-Myc來促進胰腺癌發生和谷氨酸鹽代謝[19];LncRNA-ROR可以通過調節miRNA-145/FSCN1通路促進食管癌細胞的轉移和浸潤[20]。生物信息學分析結果提示,這些差異表達的LncRNA下游調控基因的生物學功能涵蓋細胞生長、活化、表觀遺傳學調控等,值得進一步研究。
綜上所述,本研究系統闡述了PCOS患者血清特異性LncRNA表達譜,并對熱圖分析產生的差異LncRNA進行qRT-PCR驗證,進一步對預測的下游mRNA進行生物信息學分析,通過GO富集分析找到若干關鍵基因功能,為PCOS非侵入性診斷提供分子生物學標志物。但本研究也存在一些不足:(1)PCOS患者血清LncRNA表達譜測定的樣本數偏少,雖經qRT-PCR驗證,但仍可能會發生較大偏倚,無法充分反映目標人群情況;(2)筆者預測了差異表達程度最高的20個LncRNA的下游mRNA,但仍需要進一步qRT-PCR驗證,同時擴大驗證進行預測下游mRNA的LncRNA范圍;(3)僅采用GO富集分析LncRNA下游mRNA的生物信息學功能,后續可針對其KEGG通路作進一步分析。

