高考化學二卷信息型氧化還原反應方程式書寫策略分析


摘要:文章主要闡述高考理綜化學二卷陌生方程式中的信息型氧化還原方程式的書寫策略,同時將此策略遷移至電化學的電極反應書寫,以期讓學生氧化還原復習時能將學習的知識和方法融會貫通,學以致用,取得高考好成績。
關鍵詞:信息型氧化還原反應;方程式;策略
信息型氧化還原反應在歷年高考試題二卷中頻頻出現,其書寫方法遷移至電化學電極反應,所以陌生氧化還原方程式的書寫方法在高三一輪二輪復習時很重要。文章就不同類型的信息型氧化還原方程式書寫應對策略進行逐一說明,并將此方法推及電極反應書寫。
一、 信息型氧化還原反應方程式的書寫應對策略
(一)常見氧化劑和還原劑之間的氧化還原方程式書寫
方法:電子守恒——電荷守恒——元素守恒法
步驟:
常見氧化劑:Cr2O2-7、MnO-4 、NO-3(H+)、 ClO-、 H2O2 、Fe3+
一般產物:Cr3+、Mn2+(H+)、 NO2(濃)、 Cl-、H2O、Fe2+、
MnO2(OH-)、NO(稀)
常見還原劑:S2-、 HS-、 SO2-3、 HSO-3、 I-、 Br-、 Fe2+、 H2O2
一般產物:S、 SO2-4、I2 、 Br2、 Fe3+ 、 O2
例1MnO-4和Fe2+在酸性條件下的反應
寫主要物質、標化合價、配主要物質的系數:
MnO-4+7+Fe2-+2Mn2-+2得5e-×1+Fe3++3
失1e-×5
酸性環境用氫離子補電荷守恒:MnO-4+5Fe2++8H+Mn2++5Fe3+
氫原子守恒在右端補水、最后用氧原子守恒檢查:
MnO-4+5Fe2++8H+Mn2++5Fe3++4H2O
(二)信息型氧化還原方程式的類型
信息型氧化還原反應最主要解決第一步寫出主要物質。根據主要物質是否全部明確分4類說明。
類型1、主要物質在字里行間和流程中直接給出——主要產物明確型
例2(2017年全國3-28)砷(As)是第四周期ⅤA族元素,可以形成
As2S3、AS2O5、H3AsO3、H3AsO4等化合物,有著廣泛的用途。回答下列問題:
(2)工業上常將含砷廢渣(主要成分為As2S3)制成漿狀,通入O2氧化,生成H3AsO4和單質硫。寫出發生反應的化學方程式。
分析:從(2)信息可知主要還原劑和氧化劑為As2S3和O2反應生成H3AsO4和S,根據書寫方法得到方程式為2As2S3+6H2O+5O26S+4H3AsO4
類型2、根據化合價升降規律分析得出主要物質——主要產物半明型
例3(2019年全國26-2)①以重晶石(BaSO4)為原料,可按如下工藝生產立德粉:
問題:在回轉窯中重晶石被過量焦炭還原為可溶性硫化鋇,寫出該過程的化學方程式。回轉窯尾氣中含有有毒氣體,生產上可通過水蒸氣變換反應將其轉化為CO2和一種清潔能源氣體,寫出該反應的化學方程式。
分析:第一小問:根據流程顯示回轉窯溫度900~1200℃,浸出槽得到物質是產物BaS,所以C和BaSO4反應生成BaS。硫的化合價從+6降為-2,根據化合價升降規律分析,碳的化合價一定升高,不特別說明,生成物為CO2,由此寫出主要物質,然后根據電子守恒和元素守恒配平即得:C+BaSO4BaS+CO2(900~1200℃)。
第二小問:回轉窯有毒氣體只能是CO,和H2O反應得到CO2和一種清潔能源,根據碳化合價升高,只能是氫的化合價降低生成H2,所以方程式為:H2O(g)+COCO2+H2(高溫)
例4(2018年全國1-27(4))Na2S2O5可用作食品的抗氧化劑。在測定某葡萄酒中Na2S2O5殘留量時,取50.00mL葡萄酒樣品,用0.01000mol·L-1的碘標準液滴定至終點,消耗10.00mL。滴定反應的離子方程式為:S2O2-5+2I2+3H2O2SO2-4+4I-+6H+。
例5(2017·全國1-28)將水樣與Mn(OH)2堿性懸濁液混合,反應生成MnO(OH)2,實現氧的固定。“氧的固定”中發生反應的化學方程式。根據化合價升降規律可知Mn(OH)2生成
MnO(OH)2錳的化合價從+2升至+4,肯定有化合價降低的元素,“氧的固定”告訴應該是氧氣氧化了錳元素。根據電子守恒和元素守恒方程式為:4Mn(OH)2+O24MnO(OH)2。
類型3、根據流程信息和化合價升降規律得出主要物質——產物和反應物都不透明
方法:從具體流程找出進出物質,再根據氧化還原規律和書寫方法書寫。
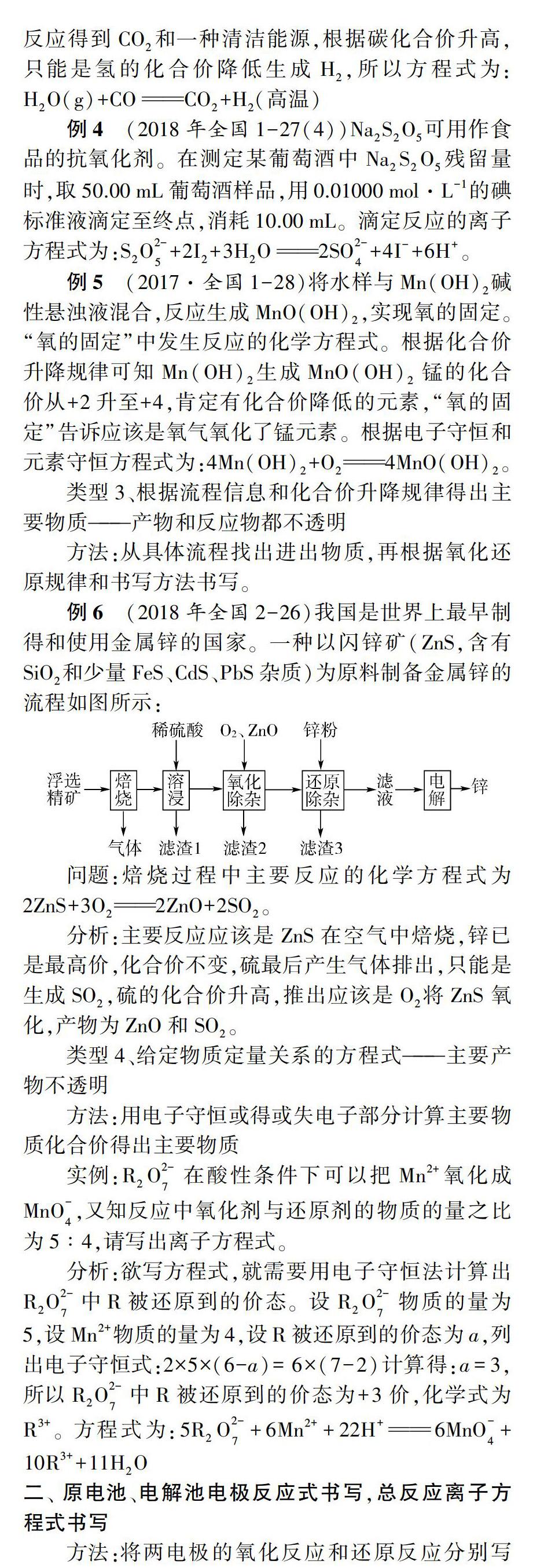
例6(2018年全國2-26)我國是世界上最早制得和使用金屬鋅的國家。一種以閃鋅礦(ZnS,含有SiO2和少量FeS、CdS、PbS雜質)為原料制備金屬鋅的流程如圖所示:
問題:焙燒過程中主要反應的化學方程式為2ZnS+3O22ZnO+2SO2。
分析:主要反應應該是ZnS在空氣中焙燒,鋅已是最高價,化合價不變,硫最后產生氣體排出,只能是生成SO2,硫的化合價升高,推出應該是O2將ZnS氧化,產物為ZnO和SO2。
類型4、給定物質定量關系的方程式——主要產物不透明
方法:用電子守恒或得或失電子部分計算主要物質化合價得出主要物質
實例:R2O2-7在酸性條件下可以把Mn2+氧化成MnO-4,又知反應中氧化劑與還原劑的物質的量之比為5∶4,請寫出離子方程式。
分析:欲寫方程式,就需要用電子守恒法計算出R2O2-7中R被還原到的價態。設R2O2-7物質的量為5,設Mn2+物質的量為4,設R被還原到的價態為a,列出電子守恒式:2×5×(6-a)=6×(7-2)計算得:a=3,所以R2O2-7中R被還原到的價態為+3價,化學式為R3+。方程式為:5R2O2-7+6Mn2++22H+6MnO-4+10R3++11H2O
二、 原電池、電解池電極反應式書寫,總反應離子方程式書寫
方法:將兩電極的氧化反應和還原反應分別寫出,原電池正極、電解池陰極化合價降低的電子為還原反應,原負電陽元素化合價升高失去電子為氧化反應。加合得出總反應。依照:電荷守恒—元素守恒—電子守恒過程書寫。
步驟:
實例1:(2018年27題 (3)) 改編:KIO3也可采用“電解法”制備,裝置如圖所示。書寫陽極電極反應式。
分析:在堿性條件下,碘單質在陽極被氧化。根據書寫方法有:
I2-10e-+12OH-2IO-3+6H2O
實例2:化學在環境保護中起著十分重要的作用。催化反硝化法和電解法降解法可用于治理水中硝酸鹽的污染。(2)、電化學降解NO-3是酸性溶液中硝酸根在電極上降解為N2,硝酸根在為(填“陽極”或“陰極”)放電,寫出陰極反應式。
分析:NO-3的氮元素從+5價降低到的N2零價,化合價降低得電子在電解池的陰極。電極反應為:2NO-3+ 10e-+8H+N2↑+4H2O
電極反應只是將氧化還原方程式的氧化反應和還原反應分開書寫,書寫同信息型氧化還原應對方法。教師在講解時要講方法講透,學生融會貫通后,對氧化還原的方程式的書寫加強訓練,遇到陌生方程式按一定的思路求解,必不失分,取得好成績。
參考文獻:
[1]杜志建.2017年全國各省市高考試題匯編,理科綜合[J].烏魯木齊:新疆青少年出版社,2017.
[2]天利全國高考命題研究中心編.2018全國各省市高考試題匯編全解,理科綜合[M].拉薩:西藏人民出版社,2018.
[3]杜志建.2019年全國各省市高考試題匯編,理科綜合[J].烏魯木齊:新疆青少年出版社,2019.
作者簡介:聶柯湘,陜西省西安市,陜西省西安市高新區鄠邑第四中學。

