食管支架在復(fù)雜性食管狹窄中的研究進展
吳斯蔚, 劉文靜, 李超婧, 王富軍, 王 璐
食管狹窄根據(jù)病情程度分惡性和良性:食管惡性狹窄通常由晚期食管癌引發(fā)[1],90%以上的食管癌患者在確診時已經(jīng)是中晚期,總體5年生存率低于20%,支架置入作為惡性食管狹窄的姑息治療選擇之一,被歐洲胃腸道內(nèi)鏡學(xué)會(European Society of Gastrointestinal Endoscopy,ESGE)定為最佳治療方案[2]。
食管良性狹窄(benign esophageal strictures,BES)的成因較多,約80%為消化性損傷,其余為先天性狹窄、術(shù)后吻合口狹窄以及放射性狹窄等[3]。臨床上根據(jù)治療難易程度將BES分為簡單性和復(fù)雜性,其中復(fù)雜性食管良性狹窄(refractory benign esophageal stricture,RBES)多是因組織纖維化所致的瘢痕狹窄,狹窄部分的長度通常多于20 mm,常規(guī)口徑內(nèi)鏡難以順利通過,且伴隨嚴重腔內(nèi)狹窄[4]。現(xiàn)階段RBES的治療途徑主要分為內(nèi)鏡下擴張、藥物注射及支架置入術(shù)。
1 復(fù)雜性食管狹窄治療現(xiàn)狀
近年來BES病因增加,內(nèi)鏡下黏膜剝離術(shù)等在手術(shù)中的應(yīng)用可能導(dǎo)致切除病變組織后的食管黏膜周圍損傷超過3/4,引發(fā)食管狹窄。通常推薦內(nèi)鏡下擴張作為治療此類狹窄的首選[2],然而30%~40%患者在長期隨訪過程中會出現(xiàn)病情反復(fù)以至需要手術(shù)治療,10%以上患者會發(fā)展為 RBES[5],Kochman等[6]將RBES定義為無法在 2周內(nèi)經(jīng)由5次擴張作用達到14 mm的管腔直徑,或一旦直徑擴張至14 mm后無法保持食管持續(xù)4周的通暢。但實際臨床的RBES情況要更為復(fù)雜[7],當(dāng)前探條擴張和球囊擴張是常用且較為成熟的技術(shù),支架置入術(shù)因治療時效性強而更具優(yōu)勢,但就目前療效來看,置入后各類并發(fā)癥較多,尚未得到積極的應(yīng)用。
1.1 內(nèi)鏡下擴張
內(nèi)鏡下擴張通常作為第一步治療,有探條和球囊兩種方式,利用短暫機械擴張作用將食管撐至理想狀態(tài)后即刻取出,一般需擴張3次以上。短期效果明顯,但擴張時效短、病情容易反復(fù),通常無法應(yīng)對RBES。
1.2 藥物注射
藥物注射常與內(nèi)鏡下擴張協(xié)同作用,能減少擴張次數(shù),減輕并發(fā)癥,藥物多為類固醇激素和絲裂霉素[8],抑制成纖維細胞膠原合成以減少膠原沉積引起的瘢痕增生。當(dāng)前研究表明絲裂霉素局部應(yīng)用于 RBES中安全有效[9],但療效有限且不良反應(yīng)尚未明確。
1.3 支架置入術(shù)
支架置入術(shù)將食管支架置于病變狹隘處,通過支架自身徑向支撐力擴張狹窄部位,具有長期療效。在治療RBES方面,ESGE推薦在內(nèi)鏡下擴張失效的情況下使用暫時性自膨脹支架[2],達到預(yù)期的擴張效果后再度取出支架。Martin等[10]通過是否放置食管支架組的對比研究,發(fā)現(xiàn)支架置入能有效減少額外擴張治療,但并發(fā)癥更加嚴重,并發(fā)癥類型為移位、再狹窄、胸痛、食管反流和出血等,其中支架移位發(fā)生頻率較高,因而在針對不同程度食管狹窄的手術(shù)操作過程中應(yīng)考慮支架的支撐力度和實際操作的穩(wěn)定性。考慮到內(nèi)鏡下擴張作用時間只在數(shù)秒到數(shù)分鐘,以支架置入食管的方式延長作用時間達到長期的擴張效果被認為是一個更高效的治療途徑[11]。
2 用于復(fù)雜性食管狹窄的食管支架
2.1 食管支架類型及發(fā)展歷程
自1976年提出支架置入治療方案起[12],食管支架經(jīng)歷了從剛性塑料支架[13]、不銹鋼支架[14]、鎳鈦合金支架到聚酯塑料支架[15]及生物可降解支架[16]等不同材料和結(jié)構(gòu)的改進(表1)。
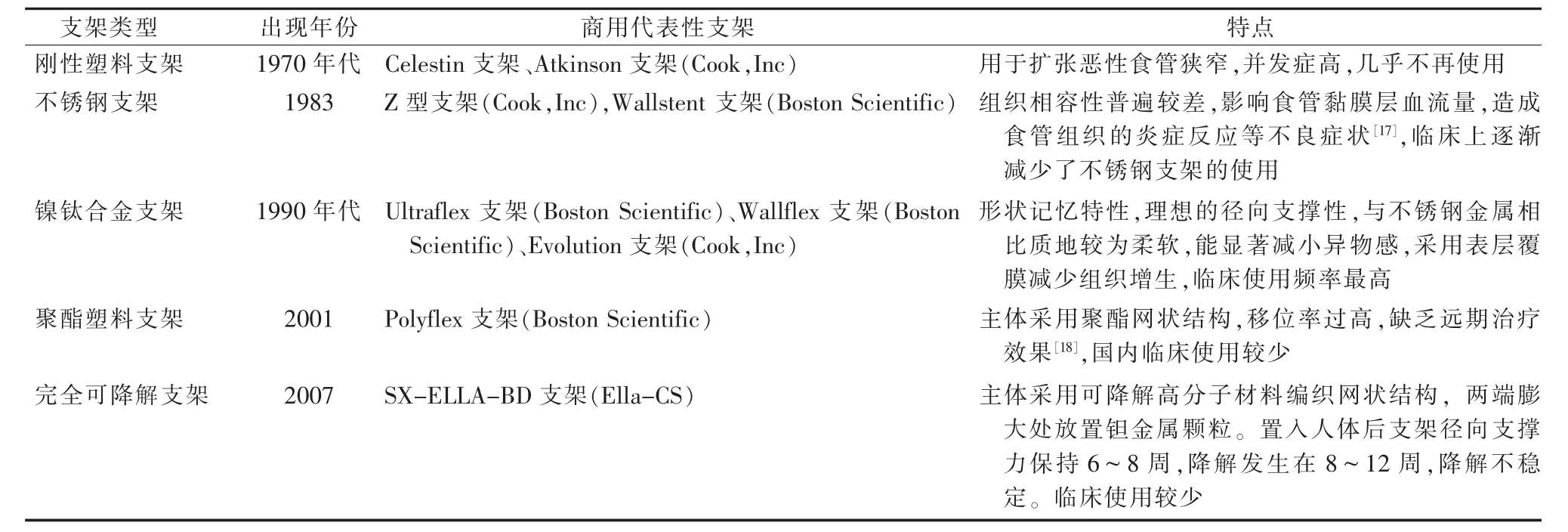
表1 食管支架發(fā)展歷程及支架類型
2.2 食管支架在治療復(fù)雜性食管狹窄中的情況
自膨式塑料支架(self-expandable plastic stents,SEPS)被FDA批準(zhǔn)用于RBES的治療,目前唯一可用的商用SEPS為Polyflex支架(Boston Scientific),Repica等[5]通過分析10項研究共 130例 RBES患者使用該支架的數(shù)據(jù)表明:SEPS的置入手術(shù)成功率達到98%,臨床成功率達到52%,24%患者發(fā)生早期的支架移位,21%患者需再次內(nèi)鏡下干預(yù)治療,9%患者出現(xiàn)明顯的并發(fā)癥如胸痛和出血。研究表明SEPS在RBES的治療中雖支架位移率高(<50%),但絕大多數(shù)塑料支架都能通過手術(shù)二次取出,故總體而言是有效且安全的,可以作為內(nèi)鏡下擴張的替代治療方案。
全覆膜自膨式金屬支架(fully covered selfexpanding metal stents,F(xiàn)CSEMS)表面全覆膜可阻礙組織通過金屬網(wǎng)眼向支架內(nèi)生長,能預(yù)防組織粘連,置入后可二次取出,理論上也適應(yīng)于RBES的支架置入治療。Fuccio等[19]分析了10項研究共227位RBES患者使用FCSEMS治療RBES的數(shù)據(jù)表明:長期治療成功率在35%~45%,這取決于RBES的嚴重程度,并受到患者前期治療的影響。不同類型的FCSEMS的位移率為25%~35%,20%~25%患者出現(xiàn)不良反應(yīng),盡管FCSEMS和SEPS的治療結(jié)果在統(tǒng)計學(xué)上差異不大,但在FCSEMS置入和反復(fù)探條擴張的對比研究中顯示,F(xiàn)CSMES可以減輕患者的治療負擔(dān),改善患者的生活質(zhì)量[20]。
生物可降解食管支架(biodegradable esophageal stent,BDES)能避免再次取出手術(shù)而在治療RBES中具有很好的應(yīng)用前景,F(xiàn)uccio等[19]通過4組研究共77例患者使用BDES的情況表明,使用BDES與FCMSES無顯著差異,30%~40%患者能長期緩解吞咽困難,20%~25%患者會出現(xiàn)出血及嚴重的胸痛等,幾乎無支架位移情況。van Halsema等[21]通過臨床研究表明SEMS、BDES和SEPS在RBES的臨床成功率為分別為14.1%,32.9%,27.1%,支架遷移率分別為31.8%,14.3%,27.1%,證實生物可降解支架在RBES治療中支架位移率較低,總體成功率最優(yōu)。Yano等[22]通過跟進18例使用完全可降解支架的患者并對后續(xù)吞咽困難等級進行評分,證實BDES在RBES治療中是有效且可接受的,但若患者前期進行過放化療治療,則長期療效有限。McCain等[23]通過隨訪20例RBES患者置入BDES的后期研究表明,可降解支架對半數(shù)以上患者具有長期療效,對其余患者則能有效延長其二次治療期間的間隔時間。
3 食管支架發(fā)展前景
現(xiàn)臨床使用食管支架仍不可避免出現(xiàn)各類并發(fā)癥。隨著放化療技術(shù)的發(fā)展,用于惡性狹窄食管支架在部分發(fā)達國家使用頻率已有所下降,而RBES治療還沒有一個長期有效的治療方案[24],在內(nèi)鏡下擴張應(yīng)對RBES無效時,支架置入術(shù)因具有持續(xù)有效的徑向擴張強力仍是優(yōu)先考慮的治療方案。Yang等[25]經(jīng)內(nèi)鏡遞送少量低濃度腐蝕劑的方式成功建立了適用于支架置入研究的BES兔模型,有望促進支架置入在復(fù)雜性食管狹窄中的研究及應(yīng)用,目前已經(jīng)有新的治療技術(shù)和新型支架治療方案提出[22,26]。
3.1 Stent-in-stent技術(shù)(SIS)
SIS技術(shù)[27]的適應(yīng)證之一為RBES,主要針對組織增生和支架回收困難的問題,通過在部分覆膜支架管腔內(nèi)部放置全覆膜支架,誘導(dǎo)嵌入支架之間的黏膜組織因受到壓力而壞死,減輕組織增生問題,使得部分覆膜支架較以往容易回收,但觀察SIS技術(shù)移除雙重支架的過程中仍有食管潰瘍和小范圍出血的情況的發(fā)生。
3.2 3D打印柔性支架
3D打印柔性管狀聚合物支架[28-29]主體材料可選用PLA和TPU或兩者混合,通過改變兩者比例來調(diào)節(jié)聚合物支架的機械性能,支架具有足夠的柔韌性,便于支架在輸送系統(tǒng)中的壓縮以及釋放后的自擴張。據(jù)研究,螺旋形支架的自膨脹力高于非螺旋形支架的自膨脹力。根據(jù)與離體正常豬食管中的非螺旋支架相比,支架外側(cè)的螺旋顯著增加了抗遷移力,有望適應(yīng)于復(fù)雜性食管良性狹窄。
3.3 生物可降解支架
BDES 最早由 Fry等[30]在 1997 年制備,主體采用PLA且療效顯著。支架主體材料通常選用經(jīng)FDA認證的可降解高分子線材如 PLA,PGA和PPDO等[31]。除了已經(jīng)臨床使用的ELLA支架外,還有其他處在研究階段的BDES:分段式PPDO生物可降解食管支架[32],通過梯度降解來保持良好的機械強力;PDO/PLLA復(fù)合皮芯結(jié)構(gòu)增強型可降解食管支架[33],具備降解可控性;可降解鎂合金[34]和鋅基合金食管支架在手術(shù)過程中可順利顯影,便于臨床使用。
4 結(jié)論與展望
近年來支架置入術(shù)在針對RBES的治療中得到越來越多的實驗數(shù)據(jù)支持,但考慮到動物實驗及臨床使用中支架置入后并發(fā)癥的問題,目前并沒有針對該類食管狹窄的的理想支架。新型食管支架或具備更優(yōu)的擴張效果,或更適應(yīng)人體愈合速率的降解可控性,但缺乏大規(guī)模樣本的數(shù)據(jù)支持。隨著對生物可降解食管支架治療研究的推進,發(fā)現(xiàn)BDES具有無需二次介入,可減緩胸痛惡心等早期并發(fā)癥,與組織細胞具有較優(yōu)的生物相容性且能適應(yīng)兒童發(fā)育等優(yōu)勢。多數(shù)研發(fā)中的BDES已經(jīng)進入到臨床試驗階段,盡管它目前在結(jié)構(gòu)設(shè)計、材料選擇和規(guī)模制備工藝方面不夠成熟[35-36],支架整體力學(xué)性能不足可能引發(fā)支架移位甚至滑脫,炎癥及組織增生問題可能引發(fā)再狹窄,導(dǎo)致其安全性尚缺乏遠期隨訪資料的論證。當(dāng)前已有研究通過設(shè)計新型支架結(jié)構(gòu)進行多層次降解,探究不同復(fù)合增強線材或可降解金屬的方式來提升支架徑向支撐強力,考慮到可降解高分子是良好的藥物載體,可采用藥物涂層或覆膜涂層的方式適當(dāng)抑制炎癥,減緩組織增生問題,上述并發(fā)癥可能得到緩解。隨著食管支架的改進及介入治療的優(yōu)化,有望出現(xiàn)更安全有效的支架類型,食管支架尤其是可降解類型的食管支架在RBES中將得到更加廣泛的應(yīng)用。
- 介入放射學(xué)雜志的其它文章
- 經(jīng)皮肺穿刺活檢日間手術(shù)運行模式的建立與護理安全管理
- 專病護士在介入專科護理門診建設(shè)中的作用
- 輔助125I粒子植入器械包聯(lián)合腹部125I粒子植入防護鉛褂在惡性梗阻性黃疸125I粒子支架植入患者中的應(yīng)用及效果
- 下腔靜脈造影在腎癌伴發(fā)下腔靜脈癌栓切除術(shù)前評估中的應(yīng)用價值
- 微粒-TACE聯(lián)合伊馬替尼治療進展期胃腸道間質(zhì)瘤肝轉(zhuǎn)移臨床療效觀察
- 顱內(nèi)動脈瘤支架結(jié)合彈簧圈栓塞術(shù)后不同維持時間雙聯(lián)抗血小板治療對遲發(fā)性腦缺血的影響

