黑面神雌花氣味傳粉前后的變化及其生態(tài)意義
黃代紅 王志博 楊麗芳 石福臣 李后魂


摘?要:該文以與頭細蛾傳粉相關的葉下珠科植物黑面神為材料,采用動態(tài)頂空吸附法分別收集了該物種雌花傳粉前后釋放的揮發(fā)物,利用氣相色譜-質譜聯用技術分析了其化學成分,探索了三者間花氣味的異同,并對其生態(tài)意義進行了討論。結果表明:從該物種傳粉前、傳粉期和傳粉后的雌花氣味中共分離出22種揮發(fā)物(傳粉前12種,傳粉期15種和傳粉后13種),以脂肪族衍生物和萜類物質為主。3-己烯醛、反-2-己烯醛、順-3-己烯-1-醇、順-乙酸-3-己烯酯、反-β-羅勒烯、β-石竹烯、β-蛇麻烯、反,反-α-金合歡烯和長葉烯是其主要揮發(fā)物。傳粉前后雌花氣味的化學種類及組成發(fā)生了顯著分化,且這種變化主要是由于各時期主要揮發(fā)物發(fā)生改變而引起的。反-β-羅勒烯在傳粉期含量最高,而在傳粉后顯著下降,3-己烯、反-2-己烯醛、順-3-己烯-1-醇和順-乙酸-3-己烯酯在傳粉前含量均最高,β-石竹烯含量在傳粉后顯著升高,且長葉烯僅在傳粉后出現。在傳粉期和傳粉后β-蛇麻烯和反,反-α-金合歡烯的含量均顯著上升。同時,傳粉期雌花的釋放量明顯高于傳粉前和傳粉后的。綜上結果顯示,黑面神雌花傳粉前后花氣味發(fā)生了質與量的改變。初步推測黑面神雌花傳粉前后花氣味的分化可能會有效阻止頭細蛾對其進行再次訪問,限制頭細蛾在其雌花中過度產卵,進而來減少傳粉頭細蛾對宿主種子的取食,這無疑對維持葉下珠科植物-頭細蛾專性傳粉互利共生體系的穩(wěn)定性具有重要的化學生態(tài)意義。
關鍵詞:花氣味,氣相色譜-質譜聯用法,傳粉前后,黑面神,頭細蛾,專性傳粉互利共生關系
中圖分類號:Q946.8
文獻標識碼:A
文章編號:1000-3142(2020)07-1010-11
Abstract:The?floral?scent?is?the?key?chemical?signals?for?maintaining?nursery?pollination?mutualisms?between?Phyllantheae?plants?and?Epicephala?moths.?At?pollination?stage,the?floral?scent?could?guide?obligate?pollinators?to?encounter?their?host?plants?for?pollination?service?and?laying?eggs.?Until?post-pollination,it?also?plays?other?potential?ecological?functions.?Here,floral?volatiles?of?female?flowers?of?Breynia?fruticosa(Phyllanthaceae)?at?pre-pollination,pollination?and?post-pollination?stages?were?collected?by?dynamic?headspace?absorption?technique,respectively,then?chemical?components?using?gas?chromatography-mass?spectrometry(GC-MS).?We?have?determined?whether?there?are?variations?of?floral?scent?at?pre-pollination,pollination?and?post-pollination?stages?by?conducting?principal?component?analysis.?The?results?showed?that?a?total?of?22?volatile?compounds?were?detected?from?the?floral?scent?of?female?flowers?of?B.?fruticosa?at?pre-pollination?stage(12?compounds),pollination?stage(15?compounds),and?post-pollination?stage(13?compounds),which?were?mainly?contained?fatty?acid?derivatives?and?terpenoids.?3-Hexenal,(E)-2-Hexenal,(Z)-3-Hexen-1-ol,(Z)-3-Hexenyl?acetate,(E)-β-Ocimene,β-Caryophyllene,β-Humulene,(E,E)-α-Farnesene?and?Longiborneol?were?considered?as?the?major?scent?component(the?relative?amount>5%?).?Multivariate?statistical?analysis?showed?there?were?obviously?qualitative?differences?in?chemical?compositions?of?the?floral?scents?from?female?flowers?at?pre-pollination,pollination?and?post-pollination?stages,and?such?differences?were?result?from?changes?of?the?main?scents?compounds?among?different?flowering?stages.?For?example,the?content?of?(E)-β-Ocimene?is?the?highest?at?pollination?stage,whereas?it?significantly?decreased?after?pollination.?3-Hexenal,(E)-2-Hexenal,(Z)-3-Hexen-1-ol?and?(Z)-3-Hexenyl?acetate?are?the?four?most?abundant?compounds?at?pre-pollination?stage.?β-Caryophyllene?obviously?increased?and?Longiborneol?newly?appeared?at?post-pollination?stage.?Both?β-Humulene?and?(E,E)-α-Farnesene?sigificantly?increased?at?pollination?and?post-pollination?stages.?In?addition,the?volatile?release?amount?of?female?flowers?at?pollination?stage?emitted?significantly?more?volatiles?than?that?at?pre-?and?post-pollination?stages,respectively.?The?strong?reduced?emission?of?floral?bouquet?and?significant?variation?in?the?chemical?composition?in?female?flower?scents?at?post-pollination?stage?may?be?a?function?as?post-pollination?mechanisms?to?efficiently?reduce?further?flowers?visit,thereby?to?limit?seed?predation.?It?was?specultated?that?such?qualitative?and?quantity?differentiation?in?floral?scent?from?Phyllantheae?plants?at?pre-pollination,pollination?and?post-pollination?stages?might?have?the?important?chemical?ecological?significance?for?maintaining?in?stability?of?nursery?pollination?mutualisms?between?Phyllantheae?species?and?Epicephala?moths.
Key?words:floral?scent,GC-MS,pre-?and?post-pollination?stage,Breynia?fruticosa,Epicephala?moth,obligate?pollination?mutualisms
在植物與昆蟲專性傳粉互利共生關系中,葉下珠科(Phyllanthaceae)植物和頭細蛾屬(Epicep-hala)昆蟲共生系統(tǒng)最近成了關注熱點(Kawakita?&?Kato,2006;Hembry?et?al.,2013),頭細蛾專門在該科植物的雄花上積極采集花粉,主動為雌花傳粉,同時在子房里產卵,其孵化的幼蟲僅消耗宿主完整果實中的部分種子即可完成發(fā)育,其余種子用來保證宿主正常繁衍后代,這樣兩者之間就建立了專性傳粉互利共生關系(Kawakita?&?Kato?2004a,b;Zhang?et?al.,2012a,b)。花氣味是一類低分子量、易揮發(fā)的有機化合物(Schiestl,2010),它作為一類重要化學信號,可以誘導傳粉者迅速、準確定位到植物,促使雙方相遇,進而從各自搭檔中獲取相應報酬。因此,它在植物與昆蟲專性傳粉互利共生關系中起著非常關鍵的作用(Hossaert-McKey?et?al.,2010)。
目前,有關花氣味在葉下珠科植物-頭細蛾專性傳粉互利共生體系中的研究主要集中于三個方面:(一)花氣味揮發(fā)物的化學分析及吸引傳粉頭細蛾的活性揮發(fā)物的鑒定。據統(tǒng)計,與頭細蛾存在專性傳粉共生關系的葉下珠科植物有600多種,主要集中在算盤子屬(Glochidion)、葉下珠屬(Phyllanthus)和黑面神屬(Breynia)中(Kawakita?et?al.,2010)。目前研究僅報道了11種宿主植物的花氣味化學組成,包括算盤子屬植物9種(Okamoto?et?al.,2007;Huang?et?al.,2015;黃代紅等,2015;張振國等,2016)、葉下珠屬植物1種(小果葉下珠Phyllanthus?reticulates)(黃代紅等,2016)和黑面神屬植物1種(小葉黑面神Breynia?vitis-idaea)(Svensson?et?al.,2010)。花氣味化學分析發(fā)現,已報道的算盤子屬和葉下珠屬植物主要以萜類物質為主,黑面神屬植物主要為芳香族化合物,如算盤子(Glochidion?puberum)花氣味中的主要成分為芳樟醇和β-欖香烯(黃代紅等,2015),披針葉算盤子(G.?lanceolatum)以芳樟醇為主(Okamoto?et?al.,2007),小果葉下珠中順-β-羅勒烯含量最高(黃代紅等,2016),2-苯乙腈和2-苯乙醇在小葉黑面神(Breynia?vitis-idaea)中所占比例高達80%,且進一步通過昆蟲電生理學和行為學實驗證明,這兩種化合物的混合物對傳粉頭細蛾具有強烈的吸引作用,是引發(fā)頭細蛾傳粉行為反應的重要生理活性物質(Svensson?et?al.,2010)。(二)花氣味的種間特異性。多元統(tǒng)計分析表明,由不同頭細蛾傳粉的算盤子屬植物間花釋放的揮發(fā)物出現了分化,即具有種間差異性。相反,由相同頭細蛾傳粉的香港算盤子(Glochidion?zeylanicum)和厚葉算盤子(G.?hirsutum)植物的花產生的氣味并未發(fā)生分歧,即具有種間保守性(Okamoto?et?al.,2007;Huang?et?al.,2015)。昆蟲行為學實驗發(fā)現,種特異性頭細蛾能夠區(qū)分出種間氣味的差異,從而識別出自己的宿主植物(Okamoto?et?al.,2007)。因此,花氣味的種間特異性可以使種特異性頭細蛾與各自宿主植物相遇,是兩者建立互利共生關系的前提保證。(三)雌雄花間氣味的差異性,即兩性異型性。研究顯示,與頭細蛾傳粉相關的葉下珠科植物的雌雄花產生的氣味具有明顯的差異性,不僅在化學組成上有所不同,而且雄花的釋放量顯著高于雌花(Svensson?et?al.,2010;Okamoto?et?al.,2013;Huang?et?al.,2015;黃代紅等,2016)。昆蟲行為學實驗發(fā)現,傳粉頭細蛾可以識別宿主植物兩性間花氣味的差異,且偏向選擇雄花,從而觸發(fā)頭細蛾積極主動的傳粉行為(Okamoto?et?al.,2013)。因此,花氣味兩性異型性有助于傳粉頭細蛾分別在宿主的雌雄花上完成不同且有序的主動傳粉行為:首先在雄花上積極采集花粉,然后主動為雌花傳粉,目的是為了獲取不同的傳粉報酬。雄花可為頭細蛾提供花粉作為食物,雌花可提供子房作為傳粉者的產卵地,從而雙方之間形成了這種互利共生關系(Svensson?et?al.,2010;Okamoto?et?al.,2013)。
在互利共生體系的維持過程中,共生雙方盡量減少自身利益受到損失是該系統(tǒng)穩(wěn)定性維持的重要機制之一。只有在雙方自身均具有防止搭檔過度消耗自身資源的機制下,才能保證該系統(tǒng)的穩(wěn)定,否則,互利共生體系就會面臨崩潰(Herre?et?al.,2008)。對于植物而言,一旦種子寄生性傳粉昆蟲過度訪問其雌花而產卵,就會導致其果實內寄生過多的傳粉者幼蟲,一方面會增加果實里傳粉者幼蟲間的競爭性,降低其后代的成活率,從而會影響傳粉者種群的延續(xù);另一方面過多的幼蟲會完全消耗掉宿主果實內的全部種子,無法確保宿主植物來繁衍后代,從而影響該共生體系的穩(wěn)定性(胡冰冰等,2011)。因此,在植物-昆蟲專性互利共生關系的長期進化中,宿主植物為了防止種子寄生性傳粉者對其資源,尤其是雌花資源的過度開采,演變出的一種可能的適應策略就是傳粉前后花氣味的變化。宿主利用傳粉后花氣味的變化來減少其對傳粉者的吸引,降低宿主果實內的產卵率,這樣可以有效阻止傳粉者對宿主資源的過度消耗。目前,專性傳粉互利共生系統(tǒng)中宿主植物傳粉前后花氣味變化的研究主要集中在榕樹(Proffit?et?al.,2008;Chen?et?al.,2009)、絲蘭(Svensson?et?al.,2011)、蘭花(Schiestl?et?al.,1997;Schiestl?&?Ayasse?2001)以及蠅子草(Muhlemann?et?al.,2006;Horn?&?Holland.,2010)等植物中。除絲蘭外,這些植物傳粉前后花氣味均發(fā)生了改變,該變化主要體現在一些傳粉期活性物質含量的下降以及傳粉后一些排斥物質的增加。然而,目前關于與頭細蛾傳粉相關的葉下珠科植物花氣味傳粉前后變化的研究還缺乏報道。
為此,本研究以與頭細蛾傳粉相關的葉下珠科黑面神屬植物黑面神(Breynia?fruticosa)為對象,利用動態(tài)頂空吸附法收集該物種雌花傳粉前后的氣味揮發(fā)物,運用氣相色譜-質譜聯用技術(gas?chromatography?coupled?with?mass?spectrometry,GC-MS)分析不同傳粉時期花氣味的化學組成,以期探討以下科學問題:(1)該物種雌花傳粉前后揮發(fā)物的化學組成是否發(fā)生明顯改變;(2)該物種雌花傳粉前后釋放量是否具有顯著變化;(3)該物種雌花氣味傳粉前后發(fā)生質與量的變化有何生態(tài)意義。對這些問題的回答,可為進一步揭示葉下珠科植物與傳粉頭細蛾專性傳粉互利共生體系穩(wěn)定性維持的化學生態(tài)機制提供理論基礎。
1?材料與方法
1.1?材料
選擇位于海南鸚哥嶺自然保護區(qū)鸚哥嘴分站內,主要生長于山坡、平地曠野灌叢或林緣地帶的黑面神(Breynia?fruticosa)為材料。地理位置為109°34′04″E、19°02′21″N,海拔450?m。該研究地點植被類型以熱帶低地雨林和熱帶季雨林為主,土壤類型為燥紅壤和磚紅壤(Wu?et?al.,2008;郝清玉等,2013)。
1.2?方法
1.2.1?花氣味的收集?采用動態(tài)頂空吸附法分別收集黑面神雌花傳粉前后的花氣味揮發(fā)物(黃代紅等,2015),具體工作流程如下:將采集的花放入無味透明的聚氟乙烯采集袋中(2?L,TeflonFEP,大連德霖氣體包裝有限公司),用封條密封采集袋的開口端。為了減少空氣中的水分對吸附劑吸附效果的影響及除掉空氣中的灰塵顆粒,首先利用通氣泵(FAY4002,成都氣海機電制造有限公司)將空氣導入活性碳管(長75?mm,外徑6?mm,Sigma-Aldrich公司,美國)對其進行干燥和凈化,然后經由采集袋進氣口通入袋內,促使花朵釋放氣味,再通過抽氣泵(同通氣泵型號)將花氣味經由采集袋出氣口抽出,最后導入Tenax?TA(60/80目,100/50?mg,Sigma-Aldrich公司,美國)吸附管(長75?mm,外徑6?mm)中進行揮發(fā)物的收集。利用玻璃轉子流量器(ZB-4,天津流量儀表有限公司)分別對進氣端和出氣端的空氣流量進行控制,流速均為400?mL·min-1。通過無味的特氟隆管(PTEE,VICI?Jour公司,瑞士)將采集裝置中的各部分連接起來。為了與傳粉頭細蛾活動時間保持一致,花氣味收集選擇在18:30—23:30進行,持續(xù)5?h。在采集過程中,將空氣作為對照,與花氣味收集同步進行。采集完畢后,用錫箔紙包裹吸附管裝入密封袋內,放置超低溫冰盒帶回實驗室。
在化學分析前,首先取出吸附管,用正己烷(色譜純,Fisher公司,美國)洗脫揮發(fā)物,重復3?次,然后將洗脫液收集在2?mL棕色進樣瓶內(Sigma-Aldrich公司,美國),約0.5?mL,再加入500?ng正二十烷(色譜純,Sigma-Aldrich公司,美國)作為內標化合物對揮發(fā)物的含量進行定量,用氮氣濃縮至100?μL,最后將樣品置于冰箱內(-18?℃)保存待分析。
1.2.2?花氣味的化學分析?采用氣-質聯用儀(GC-MS;GC,HP-6890;MS,HP-5795;Agilent?Technoligies,USA)進行氣味揮發(fā)物的分析及鑒定。(1)GC條件:色譜柱采用HP-5MS石英毛細管柱(30?m×0.25?mm×0.25?μm);進樣量2?μL,采用4∶1分流模式;柱箱程序升溫:40?℃?保持?5?min,以3?℃·min-1升溫至?150?℃,以10?℃·min-1升至200?℃,保持5?min;進樣口溫度250?℃;載氣為高純He,流速1.0?mL·min-1。(2)MS條件:離子轟擊源設為掃描功能,掃描范圍?35~500?amu,電離方式EI;電子能量70?eV;接口溫度280?℃;離子源溫度?230?℃;極桿溫度150?℃。(3)氣味化合物的鑒定:利用儀器自帶的標準譜庫(NIST08)檢索目標化合物,確定其可能性,進一步利用保留指數,并根據相關文獻加以確定。運用面積歸一化法計算出氣味各揮發(fā)物組分的相對百分含量。
1.3?數據處理
采用Graphad?Prism?5.0軟件,利用單因素方差分析中的Tukeys方法分別對黑面神雌花傳粉前后花氣味中不同類型揮發(fā)物的相對含量、傳粉前后9種主要揮發(fā)物的相對含量以及傳粉前后揮發(fā)物的釋放量進行差異性檢驗;采用SPSS17.0軟件,運用主成分分析法對黑面神雌花傳粉前后的氣味化學成分進行差異性分析,并且利用非參數檢驗?Kruskal-Wallis?test對主成分1和主成分2進行差異性檢驗,同時運用對應分析法探討黑面神雌花傳粉前后花氣味與9種主要揮發(fā)物之間的相互聯系。所有圖片采用?Graphad?Prism?5.0和Photoshop軟件制作完成。
2?結果與分析
2.1?傳粉前后花氣味的化學組成
運用GC-MS技術分別從黑面神雌花傳粉前、傳粉期和傳粉后的氣味中共鑒定出22種揮發(fā)物,由11種脂肪族衍生物、3種單萜類化合物、6種倍半萜類化合物以及2種芳香族化合物四大類構成(表1)。其中,三個時期中均能檢測到的揮發(fā)物僅5種,分別是3-己烯醛、反-2-己烯醛、順-3-己烯-1-醇、順-乙酸-3-己烯酯和反-β-羅勒烯;任意兩個時期共同出現的化合物多達8種,包括反-乙酸-2-己烯酯、順-丁酸-3-己烯酯、反-氧化芳樟醇(呋喃型)、β-石竹烯、β-蛇麻烯、反,反-α-金合歡烯、苯甲醛和水楊酸甲酯;傳粉前和傳粉期均有反-乙酸-2-己烯酯、順-丁酸-3-己烯酯和苯甲醛3種揮發(fā)物。
傳粉前雌花中共檢測到12種揮發(fā)物,主要包括順-乙酸-3-己烯酯(48.69±6.31)%、順-3-己烯-1-醇(21.04±10.68)%和3-己烯醛(13.35±9.59)%?3種物質,含量高達總相對含量的83%。其中,傳粉前僅有正己醇、2-乙基-2-己烯醛、正十一烷和正十三烷4種特有化合物;傳粉期雌花中發(fā)現15種揮發(fā)物,主要成分有反-β-羅勒烯(34.19±8.42)%、順-乙酸-3-己烯酯(18.79±6.06)%、β-石竹烯(12.44±8.85)%以及反,反-α-金合歡烯(10.42±4.66)%?5種化合物,含量約占總相對含量的75%。其中,傳粉期所特有的揮發(fā)物僅乙酸-3-己烯酯和順-β-羅勒烯2種;傳粉后雌花共檢測出13種揮發(fā)物,以β-石竹烯(35.82±6.14)%和順-乙酸-3-己烯酯(18.19±5.19)%為主,約占總相對含量的54%。其中,β-欖香烯、β-胡椒烯和長葉烯三種化合物為傳粉后所特有。
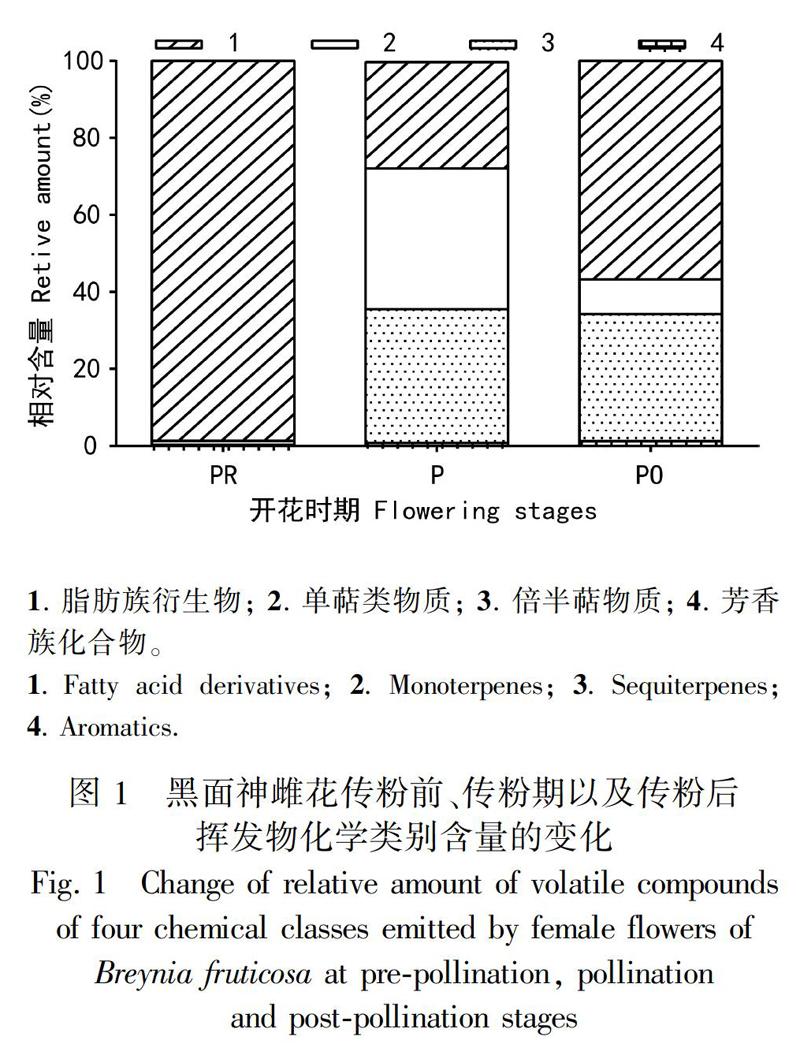
2.2?傳粉前后花氣味揮發(fā)物化學類別的變化
從圖1可以看出,傳粉前氣味揮發(fā)物中未檢測到倍半萜類物質,以脂肪族衍生物(98.44±0.61)%最為突出,明顯高于其他兩類化合物(P>0.05)。在傳粉期,揮發(fā)物中以脂肪族衍生物(34.74?±?14.88)%、單萜類(36.61?±?6.60)%和倍半萜類三類化合物(27.61?±?9.82)%為主,三者含量相當(P<0.05),超過總相對含量的99%。在傳粉后,揮發(fā)物主要為倍半萜類物質(56.86?±?4.58)%,顯著高于其他三類化合物(P>0.05)。此外,芳香族化合物的相對含量在三個時期中一直均最低,且在各個時期變化趨勢不大(P<0.05)(圖1)。以上結果說明黑面神雌花傳粉前后揮發(fā)物的化學類別發(fā)生了明顯的改變。
2.3?傳粉前后花氣味中主要揮發(fā)物含量的變化
黑面神傳粉前、傳粉期和傳粉后雌花氣味中共檢測出的22種揮發(fā)物中,相對含量>5%的化合物有9種,為花氣味的主要成分(表1)。圖2顯示了黑面神雌花授粉前后花氣味中主要揮發(fā)物的變化。在傳粉前,3-己烯(化合物1)、反-2-己烯醛(化合物2)、順-3-己烯-1-醇(化合物3)和順-乙酸-3-己烯酯(化合物4)4種主要揮發(fā)物含量最高,且在授粉期和授粉后含量均顯著降低(P<0.05)。反-β-羅勒烯在傳粉期含量最高(化合物5),且顯著高于授粉前和授粉后(P<0.05)。β-石竹烯(化合物6)在授粉前沒有檢測到,在授粉期含量較低,而到授粉后含量顯著升高(P<0.05),長葉烯(化合物9)僅在傳粉后被檢測到,在傳粉前以及傳粉期均無發(fā)現。β-蛇麻烯(化合物6)和反,反-α-金合歡烯(化合物7)兩種化合物在傳粉期未出現,到傳粉期和傳粉后含量顯著上升(P<0.05)。以上結果說明黑面神雌花傳粉前后氣味中的主要揮發(fā)物發(fā)生了明顯的變化。
2.4?傳粉前后花氣味的化學組成差異性
對傳粉前、傳粉期和傳粉后的花氣味中已鑒定的共22種頂空揮發(fā)物進行主成分分析。結果如圖3:A所示,主成分1和主成分2的方差累計率達60.59%,可認為這兩主成分包含了原來花氣味結果中主要信息(表1)。傳粉前、傳粉期和傳粉后花氣味的頂空樣品各自聚合在一起,三者之間則相互分離,沒有出現重疊或交叉。對主成分1和主成分2進行非參數Krushal-Wallis檢驗,結果顯示用主成分1和主成分2確實可明顯區(qū)分傳粉前、傳粉期和傳粉后的花氣味(χ2=10.68,P=0.005),說明傳粉前后黑面神雌花氣味的化學成分和組成之間存在顯著差異。
對應分析中使用的9種主要揮發(fā)物與結果2.3中一樣。如圖3:B所示,三個時期分別位于不同的象限,互相分離,與主成分分析結果一致,說明這三個時期的花氣味成分之間具有差異性。同時,每個時期周圍均聚集有一些不同主要揮發(fā)物,化合物距離花期越近,說明該化合物與之對應的花期之間關系越密切。如對傳粉前的花氣味貢獻最大的主要揮發(fā)物包括3-己烯醛(化合物1,13.35%)、順-3-己烯-1-醇(化合物2,7.27%)、順-3-己烯-1-醇(化合物3,21.04%)和順-丁酸-3-己烯酯(化合物4,48.69%);傳粉期有反-β-羅勒烯(化合物5,34.19%)、β-蛇麻烯(化合物7,4.74%)和反,反-α-金合歡烯(化合物8,10.42%);傳粉后的是β-石竹烯(化合物6,35.82%)和長葉烯(化合物9,7.97%)。因此,傳粉前后雌花氣味出現的差異是由于主要揮發(fā)物發(fā)生了顯著的變化而導致的。這說明黑面神雌花氣味傳粉前后發(fā)生了明顯的分化,并且這種改變主要是通過傳粉前后主要揮發(fā)物發(fā)生了變化來體現。
2.5?傳粉前后花氣味釋放量的變化
從圖4可以看出,黑面神雌花在傳粉前單位時間內釋放的揮發(fā)物量最少,到了傳粉期,花氣味的釋放量明顯上升,達到最大,隨著昆蟲傳粉進程,傳粉后花氣味揮發(fā)物量又顯著降低(P<0.05)。這說明黑面神雌花傳粉前后花氣味釋放量發(fā)生了明顯的變化。
3?討論與結論
3.1?黑面神雌花傳粉前后氣味發(fā)生了質與量的變化
目前,榕樹-榕小峰和絲蘭-絲蘭蛾兩大經典的專性傳粉系統(tǒng)中均已有宿主榕樹(Chen?et?al.,2009;Gu?et?al.,2012;李宗波等,2012a,b)和絲蘭(Svensson?et?al.,2011)傳粉前后花氣味的變化方面的報道。已有研究表明,接受前期、接受期(相當于傳粉期)以及接受后期榕果揮發(fā)物的化學成分及組成之間存在著明顯差異,接受期榕果釋放的揮發(fā)物含量最高,傳粉后顯著減少(Chen?et?al.,2009;Gu?et?al.,2012;李宗波等,2012a,b)。昆蟲行為學實驗也證實了只有接受期的榕果產生的揮發(fā)物才能強烈地吸引傳粉榕小蜂(Chen?et?al.,2009;Gu?et?al.,2012)。然而,絲蘭傳粉前后花氣味的化學成分并未發(fā)生變化,相應地,絲蘭蛾也不能區(qū)分未授粉和已授粉宿主的花(Svensson?et?al.,2011)。本研究首次報道了與頭細蛾傳粉相關的葉下珠科植物傳粉前后花氣味的動態(tài)變化。研究發(fā)現,該科植物黑面神雌花在傳粉前、傳粉期以及傳粉后氣味揮發(fā)物的化學組成發(fā)生了明顯改變,揮發(fā)物釋放量也表現出顯著差異,傳粉期釋放量最高,明顯高于傳粉前和傳粉后,說明黑面神雌花傳粉前后氣味發(fā)生了質與量的變化。這與榕樹研究中的結果類似。因此,今后還應需進一步結合昆蟲行為學實驗來比較傳粉前后黑面神雌花氣味對頭細蛾的吸引能力。
目前關于傳粉前后花氣味動態(tài)變化的報道中,不論在專性傳粉系統(tǒng),比如榕樹(Chen?&?Song,2008;Guet?al.,2012)、蘭花(Tollsten,1993;Schiestl?&?Ayasse,2001)以及蠅子草(Muhlemann?et?al.,2006;Horn?&?Holland,2010)等,還是在泛化傳粉系統(tǒng),如大薊(Theis?&?Raguso,2005),這些研究結果的一個共同趨勢就是傳粉前后花氣味的改變主要體現在傳粉后一些吸引傳粉者的活性物質釋放量的顯著降低或者趨避性物質釋放量的明顯增加。比如,在榕樹-榕小蜂共生系統(tǒng)中,雞嗉子榕(Ficus?semicordata)的雄果和雌果在傳粉期均釋放出的一種芳香族化合物4-苯甲基醚,含量高達99%,然而該物質在傳粉后從雞嗉子榕的榕果揮發(fā)物中消失。昆蟲行為學實驗進一步證明,該物質可以強烈地吸引其種特異性的傳粉榕小蜂(Ceratosolen??gravelyi)(Chen?et?al.,2010)。在蠅子草(Silene?latifolia)-夜蛾昆蟲(Hadena?bicruris)傳粉系統(tǒng)中,紫丁香醛和鄰苯二甲醚在傳粉期的蠅子草花氣味中含量較高,而到傳粉后,這兩種揮發(fā)物釋放量明顯下降。昆蟲行為學實驗發(fā)現這兩種化合物不僅對傳粉者的觸角具有電生理活性,而且均可強烈地吸引傳粉者(Dotterl?et?al.,2006;Muhlemann?et?al.,2006)。本研究發(fā)現,反-β-羅勒烯在黑面神雌花的傳粉期含量最高,占總相對含量的34.18%,均顯著高于傳粉前和傳粉后。對應性分析結果顯示,該化合物距離傳粉期最近,說明它在傳粉期的雌花氣味中占主導作用,因此可推測反-β-羅勒烯者有可能是黑面神雌花吸引其異性頭細蛾為其傳粉的潛在活性物質,然而,將來還需通過昆蟲行為學實驗來驗證該物質對傳粉頭細蛾真正的吸引能力。
3.2?黑面神雌花氣味傳粉前后動態(tài)變化的生態(tài)意義
在植物-昆蟲專性傳粉育幼系統(tǒng)中,傳粉昆蟲在為宿主植物完成傳粉的同時,還將其卵寄生于宿主植物雌花的果實內,孵化的幼蟲依靠捕食宿主果實里的種子來發(fā)育,昆蟲既是傳粉者,也是種子寄生者,植物與昆蟲之間形成了傳粉-寄生的共生關系。這種特殊關系往往伴隨著對共生雙方利益的損害,尤其是對植物適合度的損害。共生雙方在互利的同時需兼具一定程度的損害(童澤宇和黃雙全,2019)。只有共生雙方均具備了減少相互作用的消耗,傾向于保證自己的利益的機制,雙方最終才均能從各自搭檔中獲得利益(Herre,2008)。因此,宿主通常為了限制種子寄生性傳粉者對其資源的過度開采,尤其是防止在雌花內過多產卵,傳粉者與宿主在長期的傳粉-寄生互作過程中進化出的一種可能的適應對策就是宿主植物傳粉后花氣味化學成分發(fā)生分化以及揮發(fā)量的降低。
在頭細蛾-葉下珠科植物專性傳粉互利共生體系中,花氣味具有非常關鍵的化學生態(tài)功能。在傳粉期,它可以強烈吸引種特異性頭細蛾準確定位到宿主植物為其傳粉并產卵(Okamoto?et?al.,2007;Svensson?etal.,2010;Okamoto?et?al.,2013)。伴隨花的不斷發(fā)育,尤其到傳粉后階段,花氣味可能發(fā)揮著其他潛在的生物學功能(Proffit?et?al.,2008)。同榕果一樣,黑面神雌花傳粉前后花氣味化學成分的改變以及釋放量的顯著減低,推測可以有效減少其對傳粉頭細蛾的吸引,進一步限制頭細蛾在雌花的子房內過度的產卵,防止宿主資源過度消耗,這種策略對于維持葉下珠族植物與傳粉頭細蛾互利共生體系的穩(wěn)定性具有重要的生態(tài)學意義。然而,與本研究結果相反的是,絲蘭傳粉前后花氣味的化學成分并未發(fā)生變化,絲蘭蛾并不能區(qū)分未授粉和已授粉宿主的花(Svensson?et?al.,2011)。然而有趣的是,絲蘭本身會自我識別,將那些寄生太多絲蘭蛾卵的花選擇性地流產掉(Pellmyr?&?Huth,1994)。同時,絲蘭蛾在訪花時通常會在已傳粉的絲蘭花上沉積下自己的性激素作為標記,來有效阻止絲蘭蛾的再次訪問來限制其過度產卵(Huth?&?Pellmyr,1999)。因此,絲蘭-絲蘭蛾的共生系統(tǒng)可采取以上兩種策略,而并非利用傳粉前后花氣味的改變來限制宿主雌花資源的過度消耗從而維持互利共生關系的穩(wěn)定性。
3.3?葉下珠科植物與頭細蛾專性傳粉互利共生關系的化學生態(tài)維持機制
針對目前已有關于葉下珠科植物花氣味的研究,結合本研究的結果,現歸納總結出葉下珠科植物-頭細蛾互利共生體系的化學生態(tài)維持機制:在傳粉期,宿主通過釋放獨特的花氣味在夜晚來吸引種特異性頭細蛾前來訪花(Okamoto?et?al.,2007;Svensson?et?al.,2010)。通常情況下,宿主雄花的釋放量遠高于雌花,宿主主要是依靠雄花將其種特異性頭細蛾吸引而來。之后,由于宿主雌雄花產生的氣味互不相同,可以誘導傳粉頭細蛾在雄花和雌花上分別完成不同的傳粉行為,從而獲取相應的報酬:頭細蛾在雄花上積極采集花粉,之后主動為雌花傳粉并產卵,同時雄花可為傳粉者提供花粉作為食物,而雌花為傳粉者提供子房作為產卵地(Okamoto?et?al.,2013),這樣兩者之間就形成了專性傳粉互利共生關系。到傳粉后,宿主分化出與傳粉期不同花氣味以及減低氣味釋放量來減少傳粉頭細蛾的再次訪問,這樣可以限制頭細蛾在雌花中過度產卵,確保宿主果實中的種子既可滿足頭細蛾孵化出的幼蟲發(fā)育的需要,也可保障宿主能夠正常繁衍后代,從而使得雙方之間的專性傳粉互利共生關系更為穩(wěn)定。然而,目前絕大部分關于維持該互利共生體系的化學基礎方面研究僅集中于花氣味的化學成分的分析以及差異性比較,而忽略了氣味揮發(fā)物與傳粉者之間是如何建立起真正的聯系的,因此今后的研究應該加強開展揮發(fā)物成分的昆蟲行為學以及電生理學方面的研究,來更加全面和深入地揭示該共生體系的化學生態(tài)維持機制。
參考文獻:
CHEN?C,SONG?QS,PROFFIT?M,et?al.,2009.?Private?channel:a?single?unusual?compound?assures?specific?pollinator?attraction?in?Ficus?semicordata[J].?Funct?Ecol,23(5):941-950.
DOTTERL?S,JURGRNS?A,SEIFERT?K,et?al.,2006.?Nursery?pollination?by?a?moth?in?Silene?latifolia:the?role?of?odours?in?eliciting?antennal?and?behavioural?responses[J].?New?Phytol,169(4):707-718.
GU?D,COMPTOM?SG,PENG?YQ,et?al.,2012.?‘Push?and?‘pull?responses?by?g?wasps?to?volatiles?released?by?their?host?gs[J].?Chemoecology,22(4):217-227.
HAO?QY,LIU?Q,WANG?SQ,et?al.,2013.??Biomass?of?forest?communities?at?different?altitude?regions?in?Yinggeling?montane?tropical?rainforest[J].??J?Trop?Subtrop?Bot,21(6):529-537.[郝清玉,劉強,王士泉,等,2013.?鸚哥嶺山地雨林不同海拔區(qū)森林群落的生物量研究[J].?帶亞熱帶植物學報,21(6):529-537.]
HEMBRY?DH,KAWAKITA?A,GURR?NE,et?al.,2013.?Non-congruent?colonizations?and?diversification?in?a?coevolving?pollination?mutualism?on?oceanic?islands[J/OL].?Proc?Roy?Soc?B-Biol?Sci,280(1761):20130306.?http://dx.doi.org/10.1098/rspb.2013.0361.
HERRE?EA,JANDER?C,MACHADO?A,2008.?Evolutionary?ecology?of?gs?and?their?associates:recent?progress?and?outstanding?puzzles[J].?Ann?Rev?Ecol?Evol?Syst,39(1):439-458.
HORN?KC,HOLLAND?JN,2010.?Discrimination?among?oral?resources?by?an?obligately?pollinating?seed-eating?moth:host-marking?signals?and?pollination?and?orivory?cues[J].?Evol?Ecol?Res,12:119-129.
HOSSAERT-MCKEY?M,SOLER?C,SCHATZ?B,et?al.,2010.?Floral?scents:their?role?in?nursery?pollination?mutua-lisms[J].?Chemoecology,20(2):75-88.
HU?BB,LI?HH,SHI?FC,2011.?Advance?in?the?study?of?the?mutualism?between?Epicephala?moths(Lepidoptera:Gracillariidae)and?Euphorbiaceae?plants?in?China[J].?Acta?Zootaxonomica?Sin,36(2):447-457.[胡冰冰,李后魂,石福臣,2011.?中國頭細蛾屬昆蟲(鱗翅目:細蛾科)與大戟科植物互利共生關系研究進展[J].?動物分類學報,36(2):447-457.]
HUANG?DH,SHI?FC,CHAI?MW,et?al.,2015.?Interspecific?and?intersexual?differences?in?the?chemical?composition?of?floral?scent?in?Glochidion?species(Phyllanthaceae)in?south?China[J/OL].?J?Chem?Ecol,2015:1-14[2019-11-14].?https://doi.org/10.1155/2015/865694.
HUANG?DH,ZHANG?ZG,CHEN?GP,et?al.,2015.?Analysis?of?the?components?of?floral?scent?in?Glochidion?puberum?using?gas?chromatography-mass?spectrometry?with?dynamic?headspace?adsorption[J].?Chin?J?Chromatogr,33(3):318-322.[黃代紅,張振國,陳國平,等,2015.?應用動態(tài)頂空吸附—氣相色譜—質譜法分析算盤子花氣味的化學成分[J].?色譜,33(3):318-312.]
HUANG?DH,CHEN?GP,YANG?XF,et?al.,2016.?Analysis?of?the?composition?and?sexual?dimorphism?of?floral?scent?in?Phyllanthus?microcarpus[J].?Acta?Ecol?Sin,36(13):4013-4020.[黃代紅,陳國平,楊曉飛,等,2016.?小果葉下珠花氣味組成及其兩性異型性分析[J].?生態(tài)學報,36(13):4013-4020.]
HUTH?CJ,PELLMYR?O,1999.?Yucca?moth?oviposition?and?pollination?behavior?is?affected?by?past?ower?visitors:evidence?for?a?host-marking?pheromone[J].?Oecologia,119(4):593-599.
KAWAKITA?A,KATO?M,2004a.?Evolution?of?obligate?pollination?mutualism?in?New?Caledonian?Phyllanthus?(Euphorbiaceae)[J].?Amer?J?Bot,91(3):410-415.
KAWAKITA?A,KATO?M,2004b.?Obligate?pollination?mutualism?in?Breynia(Phyllanthaceae):further?documentation?of?pollination?mutualism?involving?Epicephala?moth(Gracillariidae)[J].?Amer?J?Bot,91(9):1319-1325.
KAWAKITA?A,KATO?M,2006.?Assessment?of?the?diversity?and?species?specificity?of?the?mutualistic?association?between?Epicephala?moths?and?Glochidion?trees[J].?Mol?Ecol,15:3567-3581.
KAWAKITA?A,OKAMATO?T,GOTO?R,et?al.,2010.?Mutua-lism?favours?higher?host?specificity?than?does?antagonism?in?plant-herbivore?interaction[J].?Proc?Roy?Soc?B-Biol?Sci,277(1695):2765-2774.
LI?ZB,YANG?P,PENG?YQ,et?al.,2012a.?Analysis?on?chemical?compounds?and?characteristics?of?fig?volatiles?emitted?from?Ficus?curtipes?Corner[J].?J?trop?subtrop?bot,20(3):292-298.[李宗波,楊培,彭艷瓊,等,2012a.?鈍葉榕榕果揮發(fā)物成分及其構成特征分析[J].?熱帶亞熱帶植物學報,20(3):292-298.]
LI?ZB,YANG?P,PENG?YQ,et?al.,2012b.?Components?and?spatial?variations?in?the?emission?of?volatiles?by?figs?of?Ficus?auriculata?before?and?after?pollination[J].?J?Yunnan?Univ,34(1):90-98.[李宗波,楊培,彭艷瓊,等,2012b.?木瓜榕隱頭果傳粉前后揮發(fā)性化合物構成及其變化規(guī)律[J].?云南大學學報,34(1):90-98.]
MUHLEMANN?JK,WAELTI?MO,WIDMER?A,et?al.,2006.?Post-pollination?changes?in?floral?odor?in?Silene?latifolia:adaptive?mechanisms?for?seed-predator?avoidance[J].?J?Chem?Ecol,32(8):1855-1860.
OKAMOTO?T,KAWAKITA?A,GOTO?R,et?al.,2013.?Active?pollination?favours?sexual?dimorphism?in?floral?scent[J].?Proc?Roy?Soc?B-Biol?Sci,280:20132280.
OKAMOTO?T,KAWAKITA?A,KATO?M,2007.?Interspecic?variation?of?oral?scent?composition?in?Glochidion?and?its?association?with?host-specic?pollinating?seed?parasite(Epicephala)[J].?J?Chem?Ecol,33(5):1065-1081.
PELLMYR?O,HUTH?CJ,1994.?Evolutionary?stability?of?mutualisms?between?yuccas?and?yucca?moths[J].?Nature,372:257-260.
PROFFIT?M,SCHATZ?B,BESSIERE?JM,et?al.,2008.?Signalling?receptivity:comparison?of?the?emission?of?volatile?compounds?by?gs?of?Ficus?hispida?before,during?and?after?the?phase?of?receptivity?to?pollinators[J].?Symbiosis,45(1):15-24.
SCHIESTL?FP,2010.?The?evolution?of?floral?scent?and?insect?chemical?communication[J].?Ecol?Lett,13:643-656.
SCHIESTL?FP,AYASSE?M,2001.?Post-pollination?emission?of?a?repellent?compound?in?a?sexually?deceptive?orchid:a?new?mechanism?for?maximizing?reproductive?success[J].?Oecologia,126(4):531-534.

