有關產率的解題策略
張曉玲


摘要:本文從多個方面闡述了有關產率問題的多種題型和解題策略,對于高考復習提高教學質量和學生的綜合能力具有一定的現實意義。
關鍵詞:高考,產率,計算,分析
近幾年高考化學試題關于產率的考查比較頻繁,既有產率計算的考查,也有以文字敘述形式考查產率的分析。這類試題具有較強的實用性和綜合性,能較好地考查學同學們信息獲取能力、分析問題能力、語言表達能力和計算能力等。
題型一:產率的計算
生產中實際產量往往會低于理論產量。為體現反應效率,可以用下面的公式來計算
產率:%產率=(實際產量/理論產量)x 100%
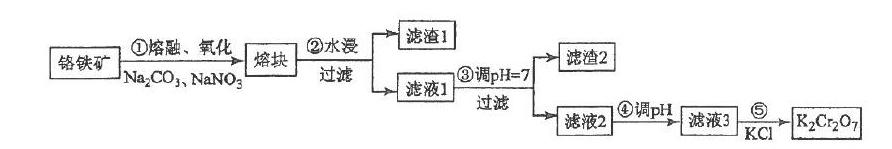
例:重鉻酸鉀一般由鉻鐵礦制備,鉻鐵礦的主要成分為FeO·Cr2O3。制備流程如圖所示:
(5)某工廠用m1 kg 鉻鐵礦粉(含Cr2O3 40%)制備K2Cr2O7,最終得到產品 m2 kg,產率為_____________。
題型二:產率的分析
多以簡答題形式要求學生結合題意和圖像說明產率變化的原因。不僅考查同學們的邏輯思維能力,分析和解決問題的能力,也考查學生的語言表達能力.平時考試和高考閱卷分析發現,文字表達題是學生主要的失分點之一。
1.化學工藝流程題產率的分析 掌握基本反應原理,提煉信息,全面分析
例:一種利用鋼鐵廠煙灰(含Mn、Fe、SiO2,少量的Al2O3、CaO及MgO)制備MnCO3的工藝流程如下:
已知25℃時,下列難溶物的溶度積常數:
回答下列問題
步驟Ⅴ沉錳時,在60℃按投料比 =2,溶液的pH對MnCO3產率的影響如圖1所示;pH=7,按投料比 =2,反應溫度對MnCO3產率的影響如圖2所示。
①圖1中,在pH<7.0時,pH越小產率(填“越高”或“越低”);在pH>7.0時,pH越大產率越低且純度也降低,其原因是。
分析 ①讀圖1可知 ,在pH<7.0時,產率隨pH 的增大而增大,pH越小MnCO3產率越小;pH>7.0 時氫氧根離子濃度增大到一定程度, 由表格所給溶度積Ksp可知,pH>7.0 時,溶液堿性增強,MnCO3 部分會轉化為溶解度更小的Mn(OH)2,導致產率和純度降低,②圖2中,溫度高于60℃時,溫度越高產率越低且純度也越低,主要原因是。
分析 ② 由圖2 可知,60℃ 時,MnCO3產率最大,溫度高于60℃時, 產率越低。
思維方式,從反應物和生成物兩方面分析。溫度升高目標產物MnCO3水解程度越大,反應物,(NH4)2CO3和MnCO3也會熱分解,導致產率和純度降低.
2.實驗題中的產率分分析? 立足于基礎知識,多角度動態分析,有序思維。
例 實驗室利用FeCO3與甘氨酸(NH2CH2COOH)制備甘氨酸亞鐵,實驗裝置如下圖所示
Ⅰ. 裝置C中盛有17.4g FeCO3和200mL 1.0mol·L-1甘氨酸溶液。實驗時,先打開儀器a的活塞,待裝置C中空氣排凈后,加熱并不斷攪拌;然后向三頸瓶中滴加檸檬酸溶液。
過程I加入檸檬酸促進FeCO3溶解并調節溶液pH,溶液pH與甘氨酸亞鐵產率的關系如圖所示。
pH過低或過高均導致產率下降,其原因是 解題過程 ①過程Ⅰ加入檸檬酸促進FeCO3溶解并調節溶液pH,當pH 過低即酸性較強時,甘氨酸會與H+ 反應;當pH 過高即溶液中OH- 較大時,Fe2+ 與OH- 反應生成Fe(OH)2沉淀,故pH 過低或過高均會導致產率下降;
3.化學反應原理產率的分析? ?準確運用化學反應原理,在復習過程中歸納和總結,不斷積累解題方法和技巧。
分析方法? ? 1(平衡產率)只與平衡有關,分析時聯系平衡轉化率,若平衡向正反應方向移動,平衡產率增大,反之減小。2產率,不一定是平衡產率,產率的變化可能與化學反應速率有關也可能與平衡移動有關。3若產率增大,可能是條件改變使平衡向正反應方向移動;或未到達平衡,正在向正反應方向建立平衡。4如果產率降低,可能是條件改變平衡向逆反應方向移動;或是條件改變導致逆反應速率增大或者正反應速率減小,如溫度升高導致催化劑活性降低或者溫度升高導致副反應增多;或者是產物在一定條件下發生副反應(分解,被氧化等等)而被消耗。如果存在主反應和副反應的競爭, 盡可能選擇有利于主反應的催化劑和溫度等其它反應條件使主反應的反應速率盡可能快,反應限度盡可能大。
參考文獻:
1? ? 2017年全國卷2
2? ?2019·河北中原名校聯考

