水產養殖廢水處理的菌藻共生系統中藻種優選及氮、磷轉化特性
黃靜依,張皓馳,李先寧
(東南大學能源與環境學院,江蘇南京 210096)
我國是世界規模最大的水產養殖國家。新型生態養殖模式循環水養殖系統(recirculating aquaculture system,RAS)將水產養殖系統分為集中養殖區和水體凈化區等單元[1],在循環利用水和氮、磷等資源的同時將養殖廢水凈化,最終實現水產養殖污染的零排放。菌藻共生系統利用細菌和微藻兩類生物之間的生理功能協同作用來凈化污水[2]。然而,單獨使用菌藻共生系統處理水產養殖廢水時需考慮有效的微藻攔截或回收方法,需避免大量微藻流入養殖水體形成水華等環境災害。基于RAS理念,“高效菌藻共生單元-水生動物濾食單元-水耕蔬菜濾床單元”三級生物生態耦合處理工藝被創新提出。其中,第一級高效菌藻共生單元利用菌藻共生體系將水產養殖廢水中溶解態的氮、磷同化為顆粒態生物質,有利于在后續處理單元中被水生動植物濾食和濾除。這種多級處理工藝既節約成本又避免了二次污染,通過收獲水生動植物產品還能取得一定的經濟收益。
作為三級生物生態耦合處理工藝的起始環節,菌藻共生系統的高效穩定運行至關重要。季節溫度變化對開放系統中微藻生長的影響是本工藝中需要重點考慮的問題。此外,目前對菌藻共生系統處理廢水的研究聚焦于氮、磷去除率,且常以藍、綠藻門為研究對象,對于處理過程中氮、磷在不同形態間的轉化規律研究較少,對于更多門類微藻的應用可行性研究有限,共生系統中細菌群落結構的變化及功能仍不明確。值得特別說明的是,目前的研究尚未從微藻進一步被水生動物濾食去除的角度探討微藻的篩選標準。本研究工藝中,為保證微藻在后續單元中被有效去除,濾食性動物對其的同化率也作為微藻的篩選條件之一。因此,篩選出不同季節溫度適應性強、生長穩定且易于被動物濾食消化的藻種具有重要的理論研究和現實意義。
本研究根據微藻的生長特性、營養特征等,選用小球藻屬(Chlorella,綠藻門)、卵囊藻屬(Oocystis,綠藻門)、隱藻屬(Cryptomonas,隱藻門)、舟形藻屬(Navicula,硅藻門)的4種微藻作為研究對象,考察其在不同模擬季節溫度下的生長狀況,并綜合考慮濾食動物對其的濾食性能,篩選出不同溫度下處理水產養殖廢水的適宜藻種;結合微生物群落結構分析,探究菌藻共生系統中微藻和細菌在氮、磷轉化中的作用,為菌藻共生系統的工程應用提供理論基礎。
1 試驗材料與方法
1.1 試驗用藻種及菌種
本研究試驗藻種均采購自中國科學院淡水藻種庫,普通小球藻(Chlorellavulgaris)和卵囊藻(Oocystissp.)采用BG11培養基,卵形隱藻(Cryptomonasobovata)采用AF-6培養基,舟形藻(Naviculapelliculosa)采用CSI培養基進行無菌擴培,培養至對數增長期后,即可用于試驗。試驗菌種由南京城東污水處理廠二沉池采集的活性污泥經實驗室擴培獲得。微藻、細菌的培養及試驗均在人工氣候光照培養箱(NGC-250P型,上海一恒)中進行,培養溫度為(25±0.5)℃,光照強度為3 000~4 000 lux,光暗比為12 h∶12 h,每天定時搖瓶3次。
1.2 試驗用模擬水產養殖廢水

表1 模擬水產養殖廢水指標Tab.1 Water Quality Index of Simulated Aquaculture Wastewater


表2 模擬無機水產養殖廢水指標Tab.2 Water Quality Index of Simulated Inorganic Aquaculture Wastewater
1.3 試驗設計
1.3.1 不同環境溫度下的藻種篩選試驗
本試驗采用無菌純藻在模擬無機水產養殖廢水(表2)中進行。在250 mL錐形瓶中加入150 mL無機模擬廢水,瓶口包裹無菌透氣封口膜,高壓蒸汽滅菌鍋滅菌(121 ℃,30 min),冷卻至室溫后,在超凈工作臺中接種1%藻種(v/v)。4種微藻在5、10、15、25、30 ℃這5種溫度下分別進行生長培養試驗。試驗期間的光照培養箱條件:光照強度為3 000~4 000 lux,光暗比為12 h∶12 h。每批試驗進行14 d。取樣采用破壞性取樣方式,每2 d取樣1次,取整瓶水樣進行水質和生物量分析。每個取樣點設置3個平行,每天定時搖動培養瓶3次。
1.3.2 菌藻在共生系統中的作用
在溫度篩選試驗的基礎上選出2種微藻,在模擬水產養殖廢水(表1)中進行菌藻共生系統研究試驗。在250 mL錐形瓶中加入150 mL模擬廢水,滅菌處理后,2種微藻試驗組分別接種1%微藻(v/v)+1%細菌(v/v),另外設置1組不加菌藻的空白對照組。在光照培養箱中(25±0.5)℃、3 000~4 000 lux光照強度、 12 h∶12 h光暗比條件下,培養16 d。每2 d進行1次破壞性取樣,每個點設置3個平行,每天定時搖動培養瓶3次。
1.4 水質指標測定
CPN(PP)=CTN(TP)-CTDN(TDP)
(1)
(2)
(3)
(4)
1.5 生物量測定及細菌群落多樣性分析
菌、藻生物量的測定與水質測定同時進行。由于各試驗組間微藻種類、大小不同,微藻生物量用單位體積中微藻干重表示,用重量法(GB 11901—1989)測定;細菌生物量采用DAPI熒光染色計數法,在熒光顯微鏡(ECLIPSE Ci-L,日本Nikon公司)下計數得到細菌密度。
生物對數增長期的比生長速率(μ)由式(5)計算。
(5)
其中:t2-t1——某一時間間隔,d;
x1——間隔開始時微藻或細菌的生物量,mg/L或個/mL;
x2——間隔終結時微藻或細菌的生物量,mg/L或個/mL;
μ——生物對數增長期的比生長速率,d-1。

圖1 不同溫度下各微藻生長曲線Fig.1 Growth Curve of Each Algae under Different Temperatures
各組試驗結束時,取50 mL均質的懸濁藻液,以8 000 r/min離心15 min,棄去上清液,用無菌水從離心管中洗出沉淀物,測定生物質氮、磷,測定方法與TN、TP相同。菌藻共生試驗前后,采集微生物樣品,由北京奧維森基因科技有限公司進行16S rRNA(V3~V4區)擴增子高通量測序,分析試驗前后細菌群落結構的差異。
1.6 數據處理與統計分析
利用Excel 2016對數據進行處理,各組試驗數據的顯著性差異分析利用SPSS 21.0軟件進行,顯著水平P取0.05,P<0.05說明2組數據具有顯著性差異,反之則無顯著性差異。數據表示方式為平均值±標準偏差。
2 結果與討論
2.1 不同環境溫度下藻種篩選試驗
5~30 ℃下,4種微藻在無菌無機模擬廢水中的生長曲線如圖1所示。微藻對數增長期的平均比生長速率μ及最高生物量如表3所示。結果表明,溫度對各微藻的生長均有顯著影響,且不同藻種對溫度的適應性差異顯著。小球藻、卵囊藻、隱藻都在25 ℃下生長最佳,達到各自最高的μ值和最高生物量,分別為0.424、0.388、0.698 d-1和140、114、149 mg/L。而舟形藻在15 ℃下生長最好,該溫度下其μ值和最高生物量分別為0.427 d-1和83 mg/L。低溫和高溫對各種微藻生長均有一定的抑制作用。30 ℃高溫對舟形藻生長抑制極為明顯,舟形藻經4 d緩慢增長至17 mg/L后即迅速衰亡。溫度低于15 ℃時,小球藻和卵囊藻2種綠藻生長受到明顯抑制;低于10 ℃時,2種綠藻生長6 d后即進入衰亡期;5 ℃時,小球藻和卵囊藻的最高生物量與25 ℃時相比分別降低了127 mg/L和104 mg/L。隱藻在各溫度條件下均有4種微藻中最大的μ值和最高生物量,但隨著溫度下降,其生長也受到明顯抑制,最高生物量顯著下降。此外,隱藻生長周期較短,各溫度條件下,隱藻生長8~10 d后即進入穩定期或衰亡期,藻液由深綠色逐漸變為黃綠色;隱藻具有鞭毛,鏡檢觀察到試驗初期隱藻細胞快速運動,8~10 d后藻細胞活性明顯減弱。
選取適宜微藻生長的25 ℃,比較相同溫度下各微藻處理組中DIN、DIP與生物質氮、磷的變化情況,如圖2所示。結果表明,水體中DIN、DIP的去除量與微藻生物質氮、磷的積累量無顯著差異,基本成等價關系(P>0.05)。14 d小球藻、卵囊藻、舟形藻、隱藻試驗組DIN的去除量分別為5.98、3.33、3.76、6.42 mg/L,DIP的去除量分別為1.08、1.11、0.96、1.20 mg/L。隱藻組具有最高的DIN、DIP去除率和生物質氮、磷積累量。

表3 不同溫度下各微藻對數增長期平均增長率及最高生物量Tab.3 Average Growth Rate and Highest Biomass of Each Algae under Different Temperatures

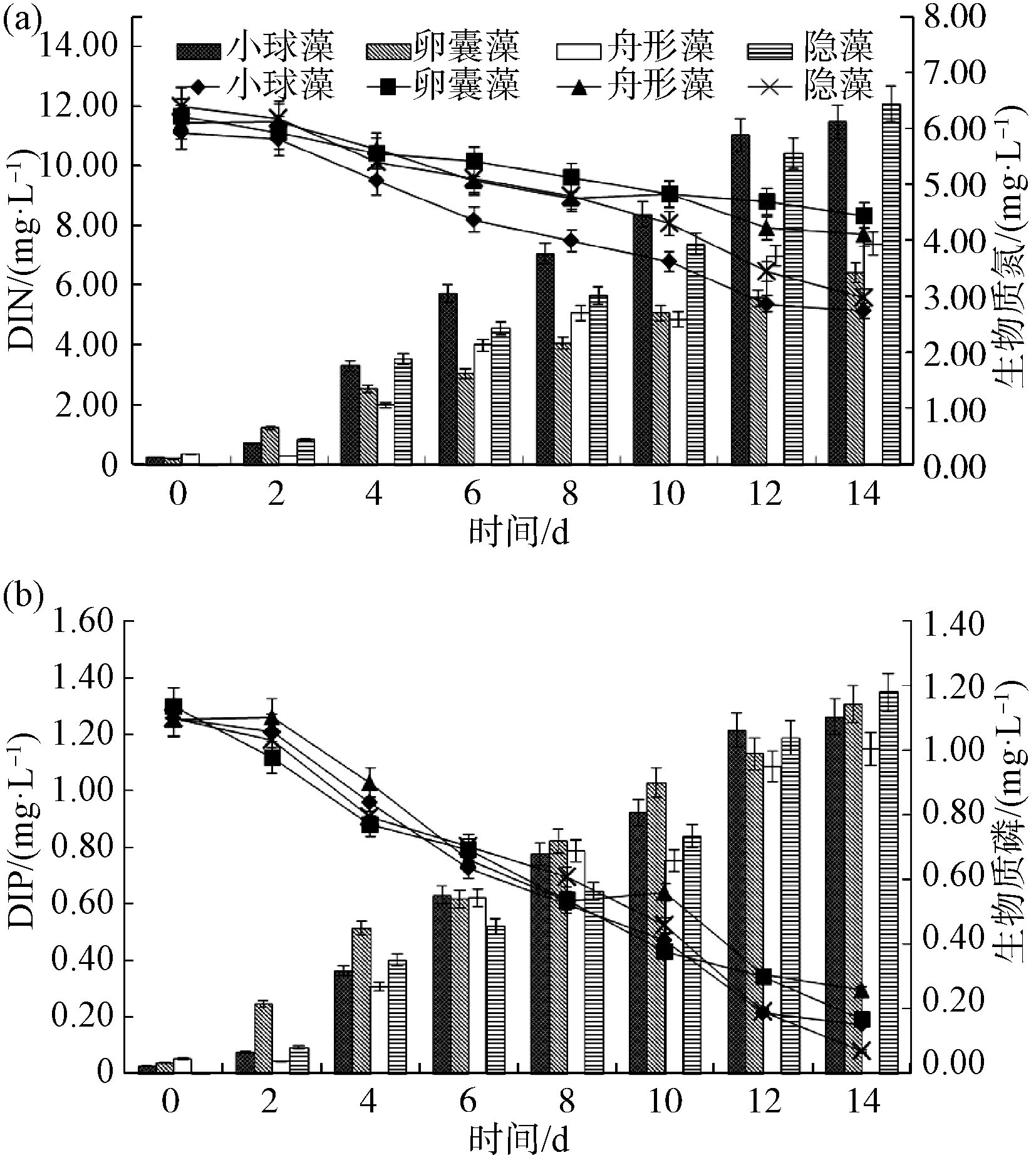
圖2 25 ℃時各試驗組DIN、DIP(折線圖)及生物質氮、磷變化(柱狀圖)Fig.2 Changes of DIN, DIP (Line Chart) and Biomass Nitrogen, Phosphorus (Histogram) in Each Group at 25 ℃

圖3 25 ℃時隱藻組各形態氮(a)和磷(b)的收支平衡Fig.3 Nitrogen(a) and Phosphorus(b) Balancing of Cryptomonas obovata Group at 25 ℃

表4 25 ℃下各微藻平均生物質氮、磷含量Tab.4 Average Biomass Nitrogen and Phosphorus Contents of Algae at 25 ℃
不同藻種對高溫和低溫的耐受性存在顯著差異。通常,溫度可以通過影響微藻細胞結構和酶的活性影響其代謝過程。高溫會破壞微藻生物膜的功能鍵,膜結構破壞,阻礙微藻各種生理代謝過程;低溫可使微藻脂膜受損,改變酶的活性,降低細胞對營養物的利用率[3-5]。溫度還會對微藻葉綠素熒光活性、葉綠素含量產生影響。薄香蘭等[6]發現,15 ℃低溫時,小球藻的光合機構受到明顯抑制,從而影響了其營養攝取和生長。本研究結果表明,小球藻在25~30 ℃較高溫度內表現出理想的生長狀態,此時小球藻生長穩定且生物質氮、磷含量較高,是濾食性動物的合適餌料。因此,小球藻適宜夏秋高溫季節應用于水產養殖廢水的處理。
舟形藻對低溫有較好的適應性,長江下游地區冬春季硅藻種類相對夏秋更為豐富[10]。Iris等[11]研究了生長在北極地區的舟形藻(Naviculaperminuta)的生理,發現該藻在寒冷黑暗條件下降低基礎代謝的同時可利用體內的儲能物質三酰甘油(TAG)和游離脂肪酸(FFA)進行內源代謝,從而維持生長。舟形藻同時又是一種重要的商業飼料,營養價值高,濾食性動物同化率高。盡管如此,舟形藻在低溫下占優勢的一大原因是綠藻受到了明顯抑制,舟形藻本身的生物量很低,且生長緩慢。因此,盡管舟形藻低溫適應性強且易于被動物濾食,但并非處理水產養殖廢水的理想藻種。
隱藻是浮游動物的重要食物,其對各個季節溫度具有廣泛的適應性,低溫下也具有較高的生長速率和最高生物量,是理想的應用藻種。Wirth等[12]研究了溫度與光照對隱藻生長的交互影響,發現在10~28 ℃時,隱藻的生長受溫度影響較小,且在20 ℃以下時生長速率更高。
各微藻生物質氮、磷占比表明,小球藻和隱藻具有相近的氮、磷含量。費志良等[13]研究了濾食性動物三角帆蚌對不同微藻的濾食類和消化率,其中,對隱藻的的濾食率和消化率分別為23.0%和41.1%,小球藻為44.3%和75.2%,舟形藻為77.7%和84.4%。可見,濾食性動物對不同藻種的同化率:舟形藻>小球藻>隱藻。
綜合考慮溫度生長和動物濾食因素,5~15 ℃低溫時,隱藻能夠保持較好的生長狀態,因此,冬春低溫季節應選用隱藻作為水處理藻種;25~30 ℃高溫時,小球藻和隱藻均有較高的生長速率和氮、磷同化率,但考慮到濾食性動物對小球藻的同化率更高,而隱藻生長周期較短,因此,選用小球藻作為夏秋高溫季節的水處理藻種。
2.2 菌藻在共生系統中的作用
2.2.1 菌藻共生系統中的生物量變化
細菌與微藻具有利用O2和CO2、有機物和無機物并產生互補的生理特性,且菌藻可分泌促進彼此生長的促進因子,使其能夠形成高效的菌藻共生系統。羅龍皂等[14]的研究表明,添加有機降解菌不僅有助于促進微藻生長,還能促進廢水中碳、氮、磷的去除效果。25 ℃時,小球藻-菌、隱藻-菌共生試驗組的生物量變化如圖4所示。結果表明,在相同的環境條件及水產養殖廢水氮、磷營養物水平下,菌藻共生系統中小球藻、隱藻的最高生物量分別達到194、215 mg/L,細菌密度達到7.00×106、8.80×106個/mL,微藻生物量比純藻系統分別高出54 mg/L和66 mg/L,且隱藻組的微藻和細菌增長速率及最高生物量均高于小球藻組,隱藻與細菌形成了更為高效的菌藻共生系統。

圖4 25 ℃時小球藻/隱藻-細菌試驗組生物量變化Fig.4 Growth of Chlorella, Cryptomonas and Symbiotic Bacteria at 25 ℃
2.2.2 菌藻共生系統中的pH、DO變化
25 ℃時,各處理組pH、DO的變化分別如圖5、圖6所示。試驗期間,對照組pH、DO均無顯著變化(P>0.05),表明非生物作用對pH、DO變化的影響可忽略不計。在菌藻共生系統中,微藻光合作用對CO2的利用以及O2的釋放可明顯升高系統內的pH和DO,而菌藻呼吸作用則會降低系統內的pH和DO。本試驗中,小球藻、隱藻組試驗初始pH值均為6.8,2 d時兩組的pH值均略微降低,分別為6.5和6.6。由圖4微藻生長曲線可知,此時2種微藻仍處于生長適應期,光合作用較弱,菌藻的呼吸作用導致水體pH降低。隨后,小球藻試驗組,pH值逐步上升,10 d之后穩定在8.7~9.0;隱藻試驗組,pH值在2~8 d逐步上升,8 d后又快速下降,試驗結束時降低至5.4,水體酸化嚴重,藻液從深綠色逐漸變為黃綠色,結合隱藻生長曲線,推測隱藻已進入衰亡期,微藻老化導致pH降低[15],結合2.1節溫度生長試驗,進一步表明隱藻具有生長周期較短的特點。小球藻、隱藻試驗組,DO濃度初始值為7.8~7.9 mg/L,2 d時迅速降低至4.6 mg/L和4.4 mg/L,隨后又均快速上升;小球藻試驗組,DO濃度8 d后穩定在8.2~8.8 mg/L,隱藻組則先快速上升,然后緩慢下降,16 d時降至7.1 mg/L。與pH變化趨勢相似,試驗初期,菌藻的呼吸作用導致DO下降明顯,微藻進入對數增長期后大量釋放O2,導致DO升高,但10 d后隱藻生長減緩甚至衰亡,導致隱藻試驗組中DO有所降低。

圖5 各處理組試驗期間pH的變化Fig.5 Variation of pH Value in Each Treatment Group

圖6 各處理組試驗期間DO的變化Fig.6 Variation of DO in Each Treatment Group
2.2.3 菌藻共生系統中的細菌群落結構變化
菌藻共生系統是一種人工微生態系統,由多個功能性微生物群落組成,這些菌群與菌藻共生系統的性能密切相關。16 d試驗前后,小球藻、隱藻試驗組中細菌微生物多樣性如圖7所示,樣品Origin、Chlorella、Crypto分別代表試驗前細菌原液、試驗后小球藻組及試驗后隱藻組的水樣。結果表明,小球藻、隱藻組試驗前后細菌群落結構均發生了顯著變化且表現出差異,說明不同微藻對細菌群落結構的形成具有重要影響,這些影響又會反作用于微藻生長,并共同作用于水產養殖廢水中營養物質的轉化過程。在門水平上,變形菌門(Proteobacteria)在3個樣品中的相對比重均為最高,在試驗前占72.0%,試驗后2個試驗組均有提高,小球藻、隱藻組中分別占84.6%和92.0%。厚壁菌門(Firmicutes)試驗前占19.3%,試驗后小球藻、隱藻組分別降低至2.1%和2.7%。藍藻門(Cyanobacteria)在試驗后2組中明顯增加,小球藻和隱藻組中分別占12.5%和5.0%。

圖7 試驗前(Origin)、試驗后小球藻試驗組(Chlorella)(a)及隱藻試驗組(Crypto)(b)物種聚類柱狀圖Fig.7 Histogram of Microbial Flora Species Composition Analysis before (Origin) and after Experiment (Chlorella and Crypto) on Phylum Level (a) and Genus Level (b)
在屬水平上,叢毛單胞菌屬(Comamonas)為試驗前的優勢菌種(57.4%),試驗后小球藻組和隱藻組分別降低至27.0%和19.0%,但仍為優勢菌種。試驗后,小球藻組中短波單胞菌屬(Brevundimonas)(22.7%)、鞘氨醇菌屬(Sphingopyxis)(12.5%)明顯增加,隱藻組中鞘氨醇單胞菌屬(Sphingomonas)(31.9%)、芽孢單菌屬(Blastomonas)(13.7%)明顯增加。此外,隱藻組中無色桿菌屬(Achromobacter)和產堿桿菌科(Alcaligenaceae)也明顯增加,分別從0.1%和0.1%提高到2.1%和2.1%。
2.2.4 菌藻共生系統中的氮、磷形態變化及菌藻作用分析
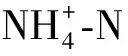

圖8 各處理組不同形態氮濃度的變化Fig.8 Changes of Nitrogen Concentration of Different Forms in Each Treatment Group
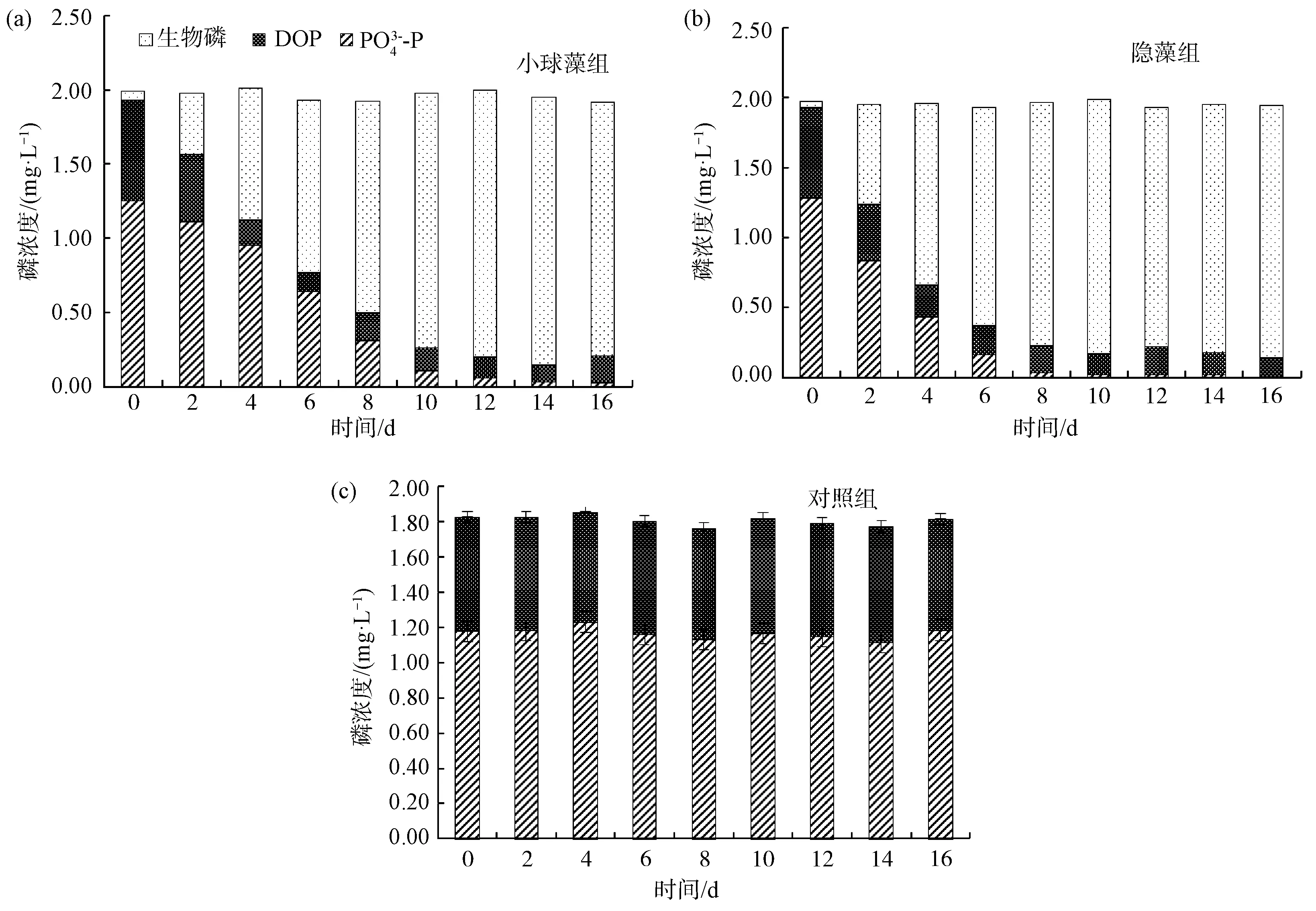
圖9 各處理組不同形態磷的變化Fig.9 Changes of Phosphorus Concentration of Different Forms in Each Treatment Group

3 結論
本研究基于針對水產養殖廢水處理的“高效菌藻共生單元-水生動物濾食單元-水耕蔬菜濾床單元”三級生物生態耦合處理工藝,對第一級“高效菌藻共生單元”進行研究,結果如下。
(1)綜合考慮溫度生長和動物濾食因素,冬春低溫季節和夏秋高溫季節分別適宜選用隱藻和小球藻作為水產養殖廢水處理藻種。
(2)以模擬水產養殖廢水培養的菌藻共生系統比純藻系統表現出更高的生物量及氮、磷去除率。不同微藻對細菌群落結構有重要影響。好氧異養菌首先快速生長導致pH、DO短時間大幅降低;亞硝態氮的短暫積累可能歸因于AOB和NOB的活性差異以及異養硝化-好氧反硝化細菌的作用。
(3)各組無菌純藻系統中氮、磷能夠達到收支平衡,微藻同化是純藻系統中DIN、DIP去除的唯一途徑;小球藻、隱藻菌藻共生系統中,生物同化是TDN、TDP去除的主要途徑,實現了溶解態氮、磷向顆粒態氮、磷的高效轉化;但2組菌藻共生系統中均出現了TN損失,推測是好氧反硝化細菌產生含氮氣體逸出體系的作用。

