宏微結合素養下的教學實踐探索
——以“鹽類的水解”為例
◎
一、問題提出
化學是在原子、分子水平上研究物質的組成、結構、性質、轉化及其應用的一門學科,其特征是從微觀層面認識物質,以符號形式描述物質。《普通高中化學課程標準[1](2017 年版)》(以下簡稱“課程標準”)中明確指出,化學學科核心素養包括了以“宏觀辨識與微觀探析”為首的五大核心素養。
對于化學學科而言,“宏觀辨識”指的是可以通過肉眼或者借助實驗或儀器等手段[2],對物質的性質及可存在狀態、轉化規律及現象的辨認和識別,“微觀探析”指的是從分子、原子、電子等極微小的粒子領域探究和分析物質的組成、結構和性質。
根據課程標準的闡述,“宏觀辨識與微觀探析”的核心要素主要包括以下內容:(1)能從不同層次認識物質的多樣性,并對物質進行分類;(2)能從元素和原子、分子水平認識物質的組成、結構、性質和變化,形成“結構決定性質”的觀念;(3)能從宏觀和微觀相結合的視角分析與解決實際問題。可見“宏觀辨識”與“微觀探析”并不是彼此孤立的,而是結合在一起的整體,并存在著如下圖一所示的進階關系:
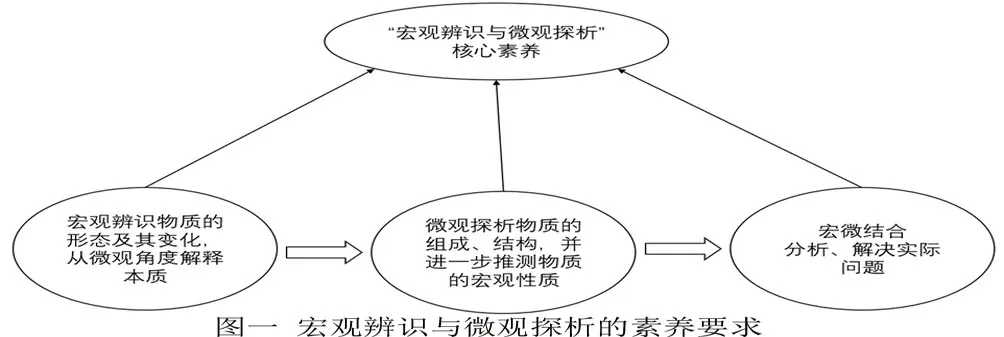
由此可見,在教學中滲透宏微結合的化學思維,培養學生宏微結合的意識和應用宏微結合分析、解決實際問題的能力,是發展“宏觀辨識與微觀探析”核心素養[3]的重要基礎。筆者以“鹽類的水解”為例,嘗試了宏微結合素養下的教學實踐探索。
二、教學目標的確定
1.教材分析和學情分析 “鹽類的水解”位于滬教版高一化學第二學期第七章第三節,該內容的教學可以安排三課時,包括鹽類水解的原理、影響鹽類水解的主要因素以及鹽類水解的應用三方面內容。這一部分的知識綜合性較強,內容涉及電解質的電離、水的電離和溶液的酸堿性、化學平衡等知識,對于學生建立分析水溶液中微粒及微粒間相互作用的思路和方法等有著重要作用。
本節課的授課對象是高一年級的學生,學生在此之前已經學習了化學平衡、離子反應和電離的知識,能夠從微觀層面分析溶液中存在哪些微粒以及可能發生的相互作用,但對于涉及到溶質與溶劑間相互作用,并因此影響到水的電離和溶液酸堿性的這類綜合問題的分析面臨著思維上的挑戰。
2.教學目標 通過觀察FeCl3溶液的丁達爾效應、鐵鹽凈水的宏觀現象,嘗試從微觀角度分析原因。
知道鹽類水解的概念,理解鹽類水解的本質,能夠判斷哪些鹽在溶液中發生水解以及鹽溶液的酸堿性。
能夠初步應用鹽類水解的知識,解釋一些簡單的聯系工農業生產和日常生活的化學問題,培養宏微結合下分析、解決問題的能力。
三、教學過程
1.教學設計思路
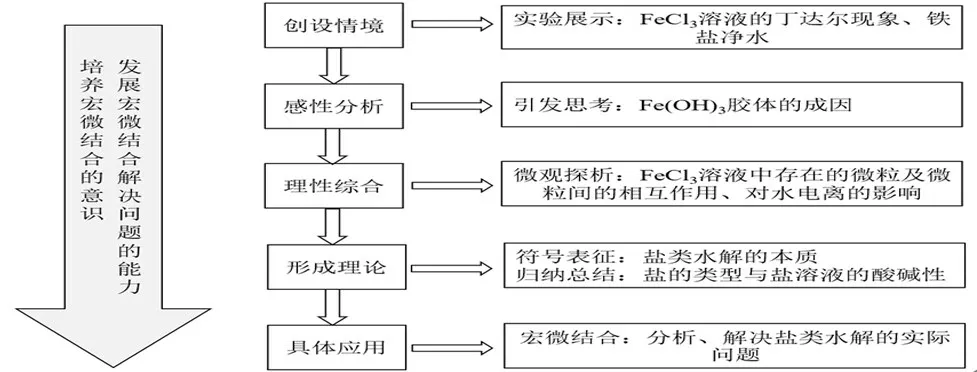
2.教學過程實施
學習任務一:宏觀視角下的情境創設
【學生實驗】①用激光筆照射FeCl3溶液,觀察現象;②將FeCl3溶液倒入渾濁的水中,靜置一段時間,觀察現象。
【實驗現象】①可以看到一條光亮的通路;②一段時間后水變澄清了
【教師提問】為什么會在FeCl3溶液中看到一條光亮的通路?FeCl3溶液為什么可以作為凈水劑?
【學生回答】因為在FeCl3溶液中存在Fe(OH)3膠體,所以會存在“丁達爾效應”,且Fe(OH)3膠體具有吸附水中懸浮物的作用,可用作凈水劑。
設計意圖:通過氯化鐵溶液的丁達爾效應及作為凈水劑這一宏觀事實,引發學生對FeCl3溶液中存在Fe(OH)3膠體的好奇心,為從微觀角度探析Fe(OH)3膠體的成因埋下伏筆。
學習任務二:微觀本質下的理性分析
【教師提問】FeCl3溶液中Fe(OH)3膠體是如何產生的?
【問題鏈引導】①FeCl3溶液中存在哪些微粒? ②哪些微粒間可以發生作用? ③作用的結果如何? ④對水的電離平衡有什么影響?
【小組討論】
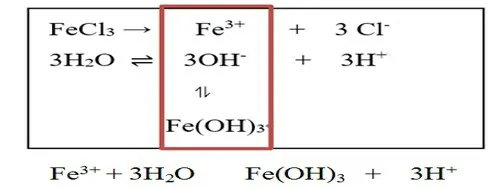
【學生歸納總結】FeCl3電離出的Fe3+與水電離出的OH-結合,生成Fe(OH)3膠體。
【教師提問】Fe3+與OH-結合,此時對溶液的酸堿性有何影響?
【學生猜測】因為Fe3+與OH-結合,可能會破壞水的電離平衡,導致溶液中C(H+)>C(OH-),使得溶液顯酸性。
【實驗證實】測定FeCl3溶液的酸堿性,證實溶液顯酸性。
【教師補充講解】通過前面有關電解質的電離以及電解質在溶液中的化學反應的學習,我們知道Fe(OH)3是弱電解質,這也是Fe3+能夠與水電離出的OH-結合的原始動力。像這種,在溶液中鹽電離出的某種離子跟水電離出的H+或OH-離子結合生成弱電解質的反應,就叫做鹽類的水解。
設計意圖:設計一組相互關聯、層層遞進的問題鏈,引導學生從微觀角度分析粒子間可能發生的作用,建立宏觀、微觀及符號三個層面上的有效轉換,發展學生從微觀、動態、平衡的視角認識水溶液中微粒及微粒間相互作用的分析思路和方法。
學習任務三:宏微結合分析物質組成、結構和性質的關系
【教師提問】從鹽的類型上分析,FeCl3屬于強酸弱堿鹽,其溶液顯酸性。鹽溶液的酸堿性與鹽的類型有怎樣的關系?
【學生活動】提供如下鹽溶液FeCl3、Al2(SO4)3、NH4Cl、NaHCO3、K2CO3、CH3COONa、NaCl、KNO3、Na2SO4,先從鹽的類型角度進行分組,再用pH 計或pH 試紙測定某幾份溶液的酸堿性(可不必全部測定)。
【歸納總結】鹽溶液的酸堿性與鹽的類型的關系

表1 鹽溶液的酸堿性與鹽的類型的關系
【學生交流】請同學們兩人一組,參照剛剛對于FeCl3溶液的分析,嘗試分析其他鹽溶液顯酸性或堿性的原因。
【教師提問】NaCl、KNO3、Na2SO4這類強酸強堿鹽溶液顯中性,這是為什么呢?
【學生回答】這類鹽在水中電離產生的都是強酸陰離子,或者是強堿陽離子,沒有辦法與水電離出H+或者OH-離子結合生成弱電解質,所以不會破壞水的電離平衡,不會發生鹽類的水解,所以溶液顯中性。
【歸納總結】鹽類水解的規律:有弱才水解,無弱不水解。誰強顯誰性,同強顯中性。
【教師提問】綜合以上對于鹽類水解的學習,鹽類水解的本質是什么? 對水的電離和溶液pH 有怎樣的影響?
【歸納總結】鹽類水解的本質:鹽與水“復分解”生成弱電解質的反應。其結果是:①促進水的電離;②改變溶液的pH。
設計意圖:通過對鹽的類型以及對不同鹽溶液酸堿性的分析、推理、測定,進一步完善學生對“鹽溶液的水解模型”的認知。在此基礎上,建構宏微結合視角下解決鹽溶液水解問題的一般思路:寫出鹽的電離方程式、水的電離方程式→判斷微粒間的相互作用→明確水電離平衡的移動→推斷鹽溶液的酸堿性。
學習任務四:知識遷移與運用,分析、解決實際問題
(1)利用簡易實驗裝置,模擬泡沫滅火器滅火。
【演示實驗】可供選擇的儀器和藥品:泡沫滅火器簡易發生裝置、NaHCO3溶液、Al2(SO4)3溶液。
【現象分析】觀察到兩者混合后劇烈反應,產生大量的二氧化碳和氫氧化鋁,并以泡沫的形式噴出,可以覆蓋在燃燒物體的表面,達到滅火的效果。請運用鹽類水解的知識加以解釋。
(2)草木灰是農村常用的鉀肥,它含有碳酸鉀。試解釋草木灰不宜與銨態氮肥混合使用的原因。
(3)實驗室中盛裝NaHCO3、CH3COONa 溶液的試劑瓶使用橡膠塞而不用玻璃塞?
設計意圖:通過鹽類水解知識解決一些日常生產、生活中的應用實例,進一步體會從物質的宏觀特征入手,聯系物質的組成和結構,解釋宏觀現象,并從宏觀與微觀結合的視角對物質及其變化進行分類和表征,發展核心素養。同時,理解化學源于生產、生活,化學必將服務于生產、生活的理念,培養學生的社會責任意識。
四、教學反思
1.基于真實問題情境的創設,培養學科思維 真實問題情境的創設更能激起學生的好奇心和興趣,有利于培養學生的學科思維。用激光筆照射FeCl3溶液出現一條光亮的通路,渾濁的水中加入鐵鹽一段時間后可以變澄清,是什么引起了這些有趣的現象? 學生在問題解決的過程中,分析問題情境,提取有用信息,不斷地整合已有的知識、技能,學科知識和技能不斷結構化,學科思維模式得以發展并逐漸形成。
2.基于學習任務發展“宏觀辨識與微觀探析”的核心素養 本節課通過設計4 個學習任務,層層推進,從宏觀現象下的情境引思到微觀本質下的探究剖析,運用化學符號等手段說明物質的組成及其變化,形成并發展學生的宏觀辨識與微觀探析能力,并在解決實際生產、生活問題的過程中,促進學生認識水溶液中的離子反應與平衡對生產、生活和社會發展的重要作用,深刻理解化學、技術與社會之間的相互關系,發展學生的化學學科核心素養。

