美國兒童藥品上市審批情況分析及其對我國兒童用藥保障工作的啟示
王雅君 韓容 岳志華 許馨文 趙志剛


摘 要 目的:為完善我國兒童藥品品種、保障兒童用藥安全提供借鑒。方法:總結美國在兒童藥品上市審批方面的政策法規歷史沿革及相關政策實施效果;結合我國兒童藥品發展現狀,提出保障我國兒童用藥可及性和安全性的相關建議。結果與結論:美國自1994年起就出臺了一系列的政策法規以鼓勵發展兒童藥品,目前其兒童藥品上市審批主要依據《最佳兒童藥品法》(BPCA)和《兒科研究平等法》(PREA)兩部法律。1998-2019年,美國藥品說明書兒童用藥信息的補充數量總體呈現波動性增長;截至2020年4月,已經有854種藥品進行了兒科說明書的修改,其中792種藥品進行了上市后兒科臨床研究,其兒科說明書信息不全等問題得到了很大改善。目前,我國對兒童藥品制定的政策主要包括鼓勵研發創新、優先審評審批,以及加強研發技術指導等,雖取得了一定的成績,但仍存在相關政策法規不完善、開展兒童藥品臨床試驗困難較大等問題。建議我國借鑒美國兒童藥品相關政策法規、兒科研究及兒童藥品目錄,建立和完善適合我國國情的兒童藥品制度和目錄,提高兒童藥品的安全性、有效性和可及性。
關鍵詞 兒童藥品;上市審批;政策法規;美國;啟示
ABSTRACT? ?OBJECTIVE: To provide suggestions for improving the variety of pediatric drugs and ensuring the safety of pediatric drug use in China. METHODS: The historical evolution of laws and regulations on the marketing approval of pediatric drugs in the United States and the implementation results of relevant policies were summarized. Combined with the current situation of the development of pediatric drugs in China, some suggestions were put forward to ensure the accessibility and safety of pediatric drug use in China. RESULTS & CONCLUSIONS: Since 1994, the United States had issued a series of laws and regulations to encourage the development of pediatric drugs. At present, the marketing approval of pediatric drugs were mainly based on the two laws of Best Pediatric Drug Act (BPCA) and Pediatric Research Equality Act (PREA). From 1998 to 2019, the amount of supplements of pediatric drug information in drug instructions of the United States showed a fluctuating growth. As of April 2020, 854 kinds of drugs had been modified in pediatric instructions, 792 of which had been carried out post marketing pediatric clinical research, and the problem of incomplete pediatric instructions had also been greatly improved. At present, Chinas policies on pediatric drugs mainly included encouraging R&D innovation, giving priority to review and approval, and strengthening R&D technical guidance. Although certain achievements had been made, there were still some problems, such as imperfect policies and regulations, and great difficulties carrying out pediatric drug clinical trials. It is suggested that our country should draw lessons from the American regulations on pediatric drugs, pediatric research and the catalogue of pediatric drugs, and establish a system and catalogue of pediatric drug use suitable for Chinas national conditions, so as to improve the effectiveness, safety and accessibilityof pediatric drugs.
KEYWORDS? ?Pediatric drugs; Marketing approval; Policy and regulation; the United States; Enlightenment
中圖分類號 R95;R985 文獻標志碼 A 文章編號 1001-0408(2021)02-0133-06
DOI 10.6039/j.issn.1001-0408.2021.02.02
醫學上,兒童是指0~14周歲的人群。目前,市場上兒童專用或者有比較詳細的兒童用藥安全信息的藥品數量較少。兒童使用成人藥品的現象較為普遍[1]。由于兒童正處于生長發育階段,器官尚未發育完全,其肝臟代謝酶活性、腎臟清除率、血腦屏障情況、神經系統功能、脂肪含量、血容量等均與成人存在較大差異,且不同生長階段的兒童對藥物的代謝和清除能力也具有非線性的差異,不能簡單地使用體質量來進行兒童劑量的等比例換算[2]。因此,兒童患者在使用成人藥物進行治療的過程中極有可能出現用藥不適宜的情況,從而誘發藥物不良事件。根據國內相關機構發布的《2016年兒童用藥安全調查報告》數據顯示,我國每年約有3萬名兒童因用藥不當而導致耳聾,給患者及其家庭造成了嚴重的傷害和負擔[3]。
兒童作為一個特殊群體,其用藥研究在倫理和技術方面都面臨著巨大的困難,因此世界各國在進行臨床試驗時都避免納入兒童患者,也由此造成了兒童藥品安全性、有效性信息不全的局面。面對這一問題,歐美國家率先轉變觀念,由“避免臨床試驗來保護兒童”轉變為“通過臨床試驗來保護兒童”[4],通過制定相應的政策法規,鼓勵進行兒科研究,以完善兒童用藥信息,保障其藥物治療的安全性和有效性,并根據相關研究成果進行藥品的審評審批;而我國在兒科研究方面尚未建立相關制度。為此,本研究總結美國在兒童藥品審批上市方面的政策法規歷史沿革及相關政策實施效果,并結合我國國情和兒童藥品的發展現狀提出相關建議,以期為完善我國兒童藥品品種、保障兒童用藥安全提供借鑒。
1 美國兒童藥品審批上市的政策與法規
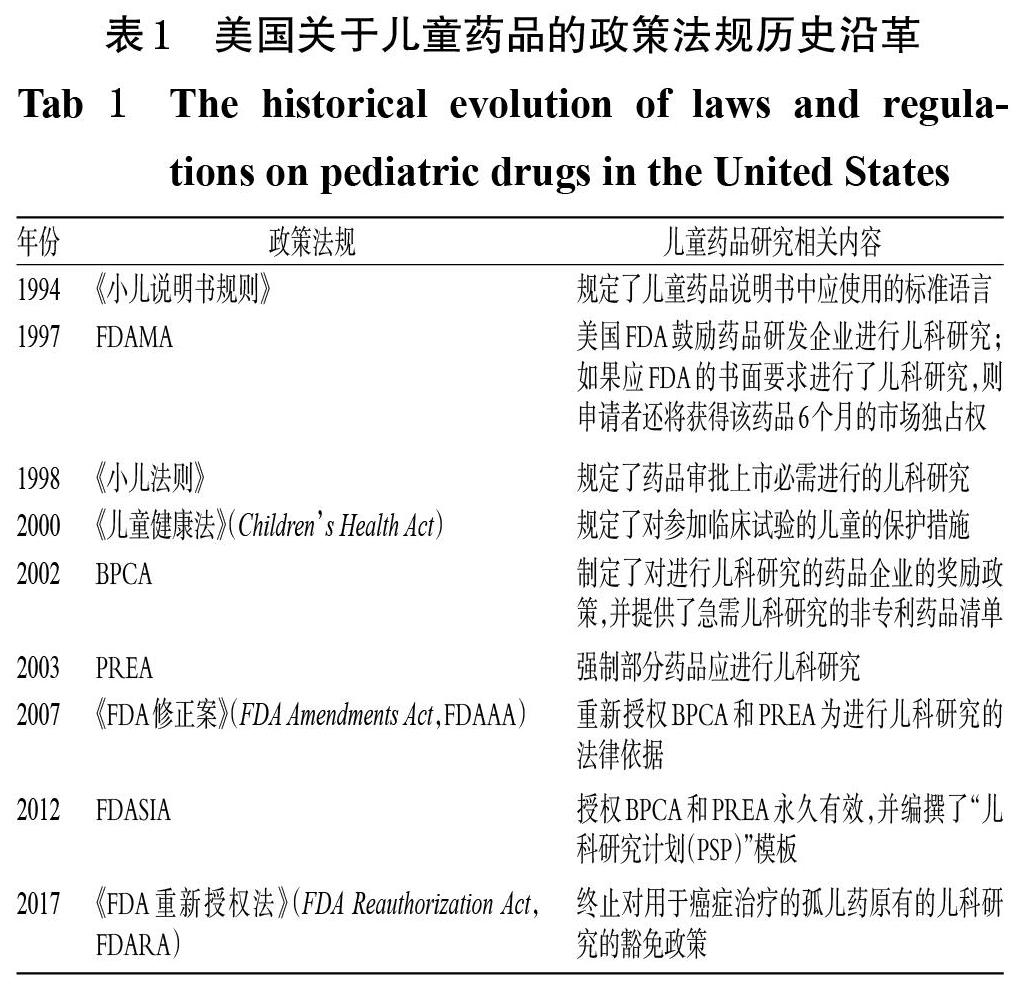
針對兒童藥品品種不足的情況,美國率先采取立法的形式從根本上著力改善兒童藥品的可及性和安全性問題。早在20世紀90年代,美國便陸續出臺了一系列政策法規,如《小兒說明書規則》(The Pediatric Labeling Rule)、《FDA現代化法案》(FDA Modernization Act,FDAMA)、《小兒法則》(The Pediatric Rule)等。其中,FDAMA中明確提出了多項鼓勵發展兒童藥品的舉措,更是首次提出了國家為制藥企業開發兒童藥品提供經濟鼓勵。為了促使更多的企業進行兒科研究,獲取更多兒童用藥的相關數據,美國又于2002年和2003年相繼制定了《最佳兒童藥品法》(Best Pharmaceuticals for Children Act,BPCA)和《兒科研究公平法》(Pediatric Research Equity Act,PREA)[5],且《FDA安全與創新法》(Food and Drug Administration Safety and Innovation Act,FDASIA)授權上述兩法案長期有效[6]。此外,FDASIA還規定,研究者應當在新藥研制的早期階段就遞交藥品的初期研究計劃,目的是在研制新藥期間,盡早考慮未來能否適用于兒童,并根據計劃開展同步的兒科研究。美國關于兒童藥品的政策法規歷史沿革[4]見表1。
目前,美國兒童藥品審批上市的主要依據為BPCA與PREA。BPCA規定,對已向FDA提交有關兒童用藥信息的藥品,可額外授予其6個月的市場獨占權[7],前提是滿足以下條件:(1)該藥品經美國FDA批準上市且保護期尚未結束,即6個月的市場獨占權必須續加在該藥品現有的專利保護期或其他獨占保護期后面才能生效,相當于是對原有專利的保護或獨占保護的延續;(2)藥品生產企業依據PSP完成兒科研究并將研究報告提交給美國FDA,只要研究報告符合FDA的規定,無論最終的研究結果是否支持該藥品應用于兒童;(3)研究報告的內容應包含不同種族兒童的使用效果;(4)藥品生產企業對藥品說明書的修改應在法定時間內獲得美國FDA的批準。
另一方面,PREA要求,除特殊情況外[例如用于治療僅在成年人中發生的疾病的藥物或用于治療罕見病的藥物(孤兒藥)等],具有新的有效成分、適應證、劑型、給藥方案或給藥途徑的藥物均必須在兒科人群中進行相關研究,批準的藥品說明書中也必須包括適用于兒童的用法用量、安全性等內容。藥品生產企業在Ⅱ期臨床試驗完成之后、Ⅲ期臨床試驗開始之前,需向FDA提交概述其PSP,FDA審查部門在與兒科審查委員會(PeRC)協商后,給出兒科研究的建議或要求。 PSP可以在藥品上市許可之前開始,但實際上申請人通常會要求將兒科試驗推遲到藥品上市許可之后,以免影響或延誤用于成人疾病治療藥物的批準。在兒科研究完成后,無論其是否在兒科人群中有效,藥品說明書中均應添加兒科研究的結果。對于主要供兒童使用的藥物,兒童以及青少年試驗的相關數據可作為新藥申請或生物制品許可申請的一部分進行提交;如果成人和兒童的病程和藥物作用足夠相似,則可以考慮從成人的臨床試驗中推論功效,但需在兒科人群中補充安全性數據和藥動學數據;對于旨在治療威脅生命或有嚴重傷害的疾病的藥物,應在藥物開發階段盡早同FDA商討PSP。總之,PREA規定,制藥企業應盡早考慮兒童藥品發展和評估計劃。
BPCA和PREA兩部法規的目標都是促使藥品生產企業研發兒童藥品,提供新的兒童用藥信息,完善藥品說明書,為兒童患者選擇合適的治療藥物提供參考和依據,但其適用對象和執行方式有所不同[4],詳見表2。
由上述分析可見,BPCA和PREA兩部法規使政府激勵機制和企業義務實現了有機結合[8-9]。上述兩部法規出臺后,美國FDA又對其進行了更新和授權;除此之外,美國參加了國際人用藥品注冊技術要求協調委員會(ICH),并遵守其發布的《ICH E11兒科人群藥物臨床試驗》指導原則,以加強國際間關于兒童用藥的交流,共同促進兒童藥品的研究和發展。
2 美國兒童藥品相關政策實施的效果
美國一系列兒童藥品相關政策的實施很大程度上促進了其兒童藥品臨床試驗的開展和兒童藥品說明書的修改和完善,增加了通過審批上市的兒童藥品品種,為臨床上兒童患者的治療提供了更多的選擇。
2.1 美國藥品說明書中兒童藥品信息補充數量顯著上漲
美國FDA官網顯示,其藥品說明書兒童用藥信息的修改首次出現于1998年,其后總體呈現出波動上升的趨勢,其中在2007年和2012年美國FDA對BPCA和PREA進行授權和更新之后,藥品說明書兒童用藥信息的補充數量呈現不同幅度的增長,極大地改善了兒童用藥信息不全的局面。 1998-2019年美國藥品說明書中兒童用藥信息的補充數量統計見圖1(因2020年尚無全年數據,故暫未統計)。
2.2 促進兒科研究的開展
據美國FDA發布的數據顯示,2007-2012年,藥品生產企業按照BPCA的要求開展的兒科研究總數為28項,按照PREA要求開展的兒科研究總數為105項,另有31項兒科研究同時按照BPCA和PREA的要求開展[10];2012年之后,相關研究快速發展,據美國FDA的統計顯示,2012年1月-2020年4月,按照BPCA要求開展的兒科研究總數為55項,按照PREA要求開展的兒科研究總數為289項,同時按照BPCA和PREA要求開展的兒科研究總數為9項[11]。1998年1月-2020年4月,已經有854種藥品說明書中的兒童用藥部分被修改,其中多達792種(92.7%)藥品在原有臨床試驗的基礎上重新進行了新的兒科研究。在854種修改了說明書的藥品中,各有199、475種藥品分別按照BPCA和PREA的要求開展了相關臨床研究,有131種藥品同時按照BPCA和 PREA的要求開展了兒科研究,另有49種藥品的說明書參照1998年出臺的《小兒法則》進行了修改[12]。筆者發現,美國進行兒科研究并進行說明書補充的品種較多、覆蓋范圍較廣,包括呼吸、消化、循環、免疫、泌尿系統用藥以及診斷試劑等多種藥品,其中排名前3位的是抗感染藥、神經精神疾病用藥和免疫系統用藥,在抗感染藥中又以抗病毒藥最多(高達105種)。
美國出臺的一系列舉措促使藥品生產企業和相關機構大力開展兒童用藥的研究,進而使得大量藥品說明書中的兒童用藥信息得到補充和完善。這不僅有利于不同年齡兒童患者的精準用藥,而且也有利于更新兒童給藥方案、發現藥品的新適應證等,進一步提高了兒童用藥的安全性及有效性。例如,英國GlaxoSmithKline公司在阿昔洛韋注射劑(凍干粉)治療皰疹病毒感染的新生兒患者的臨床試驗中發現,將治療劑量由“每8小時10 mg/kg”更新為“每8小 時20 mg/kg”,其有效率更高、病死率更低。因此,美國FDA于2019年1月批準了該藥說明書的更新;瑞士Roche公司在上市后發現,其生產的用于治療兒童注意缺陷多動障礙的鹽酸哌甲酯有造成4~6歲兒童體質量顯著減輕的風險,且治療收益并未高于安全風險,因此該公司于2019年6月將上述內容寫入該藥說明書[13]。
2.3 其他
美國FDA要求,藥品生產企業開展兒科臨床試驗不僅要報告兒童用藥的有效性和安全性信息,也要報告兒科臨床試驗中的無效信息,旨在避免或減少對患病兒童的無效治療;同時,這些舉措也在一定程度上豐富了兒科人群的適用劑型,也提高了美國兒童臨床試驗的參與率,從而有利于更多兒科試驗的開展與實施。
3 我國兒童用藥保障工作的現狀分析
我國兒童用藥保障工作相關政策的出臺和實施相對較晚,雖取得了一定的成果,但同時也存在一些亟待解決的問題。
3.1 我國兒童用藥保障工作的發展和成果
2003年,我國頒布《藥物臨床試驗質量管理規范》首次將兒童納入臨床試驗對象,為兒科試驗的進行奠定了基礎。隨后在2011-2013年,我國相繼出臺了多項鼓勵兒童藥品研發的相關政策,旨在加快具有臨床試驗數據支持的兒童藥品的注冊申請審評。2014年,國家衛生計生委等六部委共同印發了《關于保障兒童用藥的若干意見》,為保障兒童基本用藥需求、促進兒童用藥安全科學合理使用以及兒童藥品的發展指明了方向。后續幾年,國家頻頻出臺多項政策,先后成立了兒童用藥專家委員會,以指導兒童藥品的審批及使用;要求醫療機構配備兒童藥品,增加兒童用藥的可及性;對兒童藥品實施優先審評審批等,陸續制定了3批鼓勵研發申報兒童藥品清單,以鼓勵我國兒童藥品的研發與試驗,促進我國兒童藥品行業的快速健康發展。2020年最新版的《藥物臨床試驗質量管理規范》中又特別強調了對兒科臨床試驗中兒童受試者的保護。一系列政策的出臺,充分彰顯了我國政府部門鼓勵研發申報兒童藥品的決心和力度,也使我國兒童藥品的行業發展目標更加具體。近年來出臺的我國兒童藥品保障工作相關的政策與法規見表3。
目前,我國對兒童藥品制定的政策主要為:鼓勵研發創新、優先審評審批,該政策體現在上述多部法律法規中。根據國家藥品監督管理局發布的報告,2016-2019年我國共有106種藥品進入優先審批流程,其中有21種兒童藥品通過優先審批上市[14](其數量統計如表4所示),這在一定程度上緩解了我國臨床兒童藥品不足的困境。
鑒于兒童在不同發育階段的特殊性,為規范兒童藥品的研究,除上述法律法規外,國家層面也較為重視加強對兒童藥品研發技術的指導,先后發布了多部技術指南[15],如《兒科人群藥代動力學研究技術指導原則》和《兒科人群藥物臨床試驗技術指導原則》。此外,科技部等部門還統籌考慮了國家級科研基地中是否需要布局兒童藥品臨床試驗基地、不良反應監測中心等,中央財政也結合具體情況給予了相應支持,符合國家相關稅收條件的兒童藥品研發生產企業,還可享受相應的稅收優惠政策[16]。
另外,為深化醫療改革,進一步做好兒童藥品保障工作,促進兒童適宜品種、劑型、規格的研發創制和申報審評,滿足兒科臨床用藥需求,國家衛生健康委員會、工業和信息化部、國家藥品監督管理局組織專家先后制定了3批鼓勵研發申報兒童藥品清單,共計106個藥物品種,覆蓋了神經精神疾病、內分泌疾病、感染以及腫瘤等多種疾病[17-18]。為方便兒童用藥,提高兒童患者的接受性和依從性,這3批清單中口服液體制劑最多,共46種,占總數量的43.40%,如華法林口服混懸液、地西泮口服液等;此外還有顆粒劑、散劑等適用于兒童的劑型,體現了我國關于兒童用藥的保障不僅重點考慮增加兒童藥品品種,還考慮到了兒童藥品的劑型、劑量以及方便使用等問題。
3.2 我國兒童用藥面臨的問題和相關建議
隨著國家一系列鼓勵政策的出臺,我國兒童藥品品種逐漸增多,為兒童疾病的臨床治療提供了更多、更安全的選擇,但是我國兒童藥品還存在著劑型規格缺乏、超說明書用藥、不良反應發生率高、藥品說明書兒童用藥的相關信息缺失率較高等問題[19]。我國可通過借鑒美國兒童藥品審批上市的先進經驗,促進兒童藥品的發展和完善。
3.2.1 完善相關政策法規體系 在兒童藥品方面,美國取得的成績與其相關的政策法規密切相關,鼓勵政策和強制實施并存的方式更有利于兒童藥品相關研究的開展。目前,我國制定的相關政策均為鼓勵政策,以起到激勵藥品研發企業的作用,但是仍然需要配套適當的強制措施才能從根本上有力促進兒童藥品的研發。我國可根據基本國情,以美國的PREA為參考制定強制性的開展兒童藥品研發的相關政策,完善政策法規體系。
3.2.2 促進開展兒童藥品臨床試驗 開展和推進兒童藥品臨床試驗是兒童藥品研發的關鍵環節,由于兒童受試者招募困難、風險高、配合度低、倫理問題復雜以及技術不成熟等,致使開展兒童藥物臨床試驗仍存在較大困難[20],這不僅僅是我國面臨的困難,也是世界各國共同的難題;此外,目前我國可進行兒童試驗的機構較少,兒童研究的難度進一步增大。又由于兒童特殊的生理病理特點、病程進展、藥物吸收-分布-代謝-排泄過程、依從性等與成人不同,需要特殊的配方、劑型、甚至口味,兒童藥品研發成本比普通藥品明顯增高[21]。面對上述問題,我國可加快完善兒童藥品管理條例,從法律法規層面對兒童藥品的研發、生產、臨床試驗、說明書管理等方面作出明確規定,出臺一系列指導兒童藥品研發及注冊指南等;成立兒童藥品審評委員會,給予技術方面的咨詢、建議、溝通等支持;政府還可以采取定向采購、財政資助等措施提高藥品研發企業的積極性,引導兒童藥品的研發和兒科試驗的進行。
美國對854種藥品說明書中兒童用藥內容的更新與補充使得兒童可用藥品的數量增長,使得兒童用藥的安全性得到了進一步保障,且美國兒科研究保持了很高的透明度,公開了研究結果等數據信息,為其他國家兒童藥品的研發、試驗提供了寶貴的經驗;但是,美國PREA要求所有藥品進行兒科試驗以完善藥品信息,這使得藥物的研發成本有所提高。為了使有限的臨床試驗資源得到充分利用,我國可建立兒童臨床用藥的綜合評價體系和臨床數據庫,制定需要進行兒科試驗的藥品目錄,對目錄中的藥品強制進行兒科研究并完善說明書中的兒童用藥相關信息;也可建立兒童藥品研發或兒科試驗的資源共享平臺,一方面可減少不必要的研究,避免資源的浪費,另一方面也便于有關部門對試驗過程及結果進行監督,保障研究的質量和可信度。我國在制定兒童藥品優先審核目錄和審評時,也可將美國的兒童藥品目錄及兒科試驗結果作為參考。
3.2.3 其他 為盡早緩解目前兒童藥品品種短缺的問題,我國可考慮通過進口國外兒童藥品以滿足我國兒童患者的治療需求。建議相關部門盡快商討兒童藥品的進口是否可制定相應的優先審批政策,加快藥品審批速度,盡早惠及我國兒童患者。
4 結語
兒童藥品的安全性、有效性、可及性等問題在藥品的研發、上市、供應、使用的整個環節都應被重視。為了提高現有兒童藥品的可及性,近期國家衛生健康委員會相關專家在《關于政協十三屆全國委員會第二次會議第0914號(社會管理類088號)提案答復的函》[22]中表示,將積極開展基本藥物目錄的評估,對新審批上市、療效較已上市藥品有顯著改善且價格合理的兒童藥品,適時啟動調入程序,將安全性能高、價格適宜的兒童藥品增加到國家基本藥物目錄和醫保目錄中,以提高藥品生產企業的積極性,引導兒童藥品研發和生產,更好地滿足兒科臨床用藥需求,提升我國兒童用藥水平,維護兒童健康權益。此外,在藥品使用過程中,健全兒童藥品不良反應監測體系,加強對包括兒童藥品在內的藥品不良反應監測及藥品安全性再評價工作,對發現的兒童藥品嚴重不良反應進行及時分析、評價也是確保兒童用藥安全的重要環節。
美國兒童藥品的發展領先于我國,我國可借鑒其相關政策法規、兒科研究及兒童藥品目錄,建立和完善適合我國國情的兒童藥品制度和目錄,提高我國兒童用藥的安全性、有效性和可及性。
參考文獻
[ 1 ] MURTHY S,MANDL KD,BOURGEOIS F. Analysis of pediatric clinical drug trials for neuropsychiatric conditions[J]. Pediatrics,2013,131(6):1125-1131.
[ 2 ] GUIMAR?ES M,STATELOVA M,HOLM R,et al. Biopharmaceutical considerations in paediatrics with a view to the evaluation of? orally administered drug products:a PEARRL review[J]. J Pharm Pharmacol,2019,71(4):603-642.
[ 3 ] 廣州標點信息股份有限公司. 2016年兒童用藥安全調查報告[EB/OL].(2016-09)[2020-09-09]. https://www.menet. com.cn/report/201711/201711171730333033_136488.shtml.
[ 4 ] BAUM VC,BAX R,HEON D,et al. Pediatric drug regulation:international perspectives[J]. Paediatr Anaesth,2019, 29(6):572-582.
[ 5 ] PFLIEGER M,BERTRAM D. Pediatric drug development:ICH harmonized tripartite guideline E11 within the United States of America,the European Union,and Japan[J]. Arch Pediatr,2014,21(10):1129-1138.
[ 6 ] THOMSEN M. Global pediatric drug development[J]. Curr Ther Res Clin Exp,2019. DOI:10.1016/j.curtheres.2019. 02.001.
[ 7 ] RIVERA DR,HARTZEMA AG. Pediatric exclusivity:evolving legislation and novel complexities within pediatric? therapeutic development[J]. Ann Pharmacother,2014,48(3):369-379.
[ 8 ] BUCCI-RECHTWEG C. Enhancing the pediatric drug development framework to deliver better pediatric therapies tomorrow[J]. Clin Ther,2017,39(10):1920-1932.
[ 9 ] KUEHN BM. Laws boost pediatric clinical trials,but report finds room for improvement[J]. JAMA,2012,307(16):1681-1682.
[10] FDA. Reviews of pediatric studies conducted under BPCA and PREA from 2007-2012[EB/OL].(2018-08-17)[2020- 09-09]. https://www.fda.gov/drugs/development-resources/ reviews-pediatric-studies-conducted-under-bpca-and-prea- 2007-2012.
[11] FDA. Reviews of pediatric studies conducted under BPCA and PREA from 2012-present[EB/OL].(2020-08-24)[2020-09-09]. https://www.fda.gov/drugs/developmentre- sources/reviews-pediatric-studies-conducted-under-bpcaand-prea-2012-present.
[12] FDA. New pediatric labeling information database[EB/OL].(2020-04-30)[2020-09-09]. https://www.accessdata.fda.gov/scripts/sda/sdnavigation.cfm?sd=labelingdatabase.
[13] 岳志華,王曉玲,張偉,等.美國兒童用藥法規、實施成效及啟示[J].臨床藥物治療雜志,2020,18(9):83-87.
[14] 國家藥品監督管理局. 2019年度藥品審評報告[EB/OL].(2020-07-30)[2020-09-09]. https://www.nmpa.gov.cn/yaopin/ypjgdt/20200731114330106.html.
[15] 李豐杉,余勤.兒童用藥研發及兒科臨床試驗的國際發展和國內現狀[J].中國新藥雜志,2020,29(17):1933-1938.
[16] 國家藥品監督管理局.對十三屆全國人大一次會議第3565號建議的答復:關于大力支持兒童專用藥、兒童專用醫療器械研發的建議[EB/OL].(2018-07-16)[2020-11-30]. https://www.nmpa.gov.cn/zwgk/jyta/rdjy/20180716182901747.html.
[17] THABET Y,KLINGMANN V,BREITKREUTZ J. Drug formulations:standards and novel strategies for drug administration in pediatrics[J]. J Clin Pharmacol,2018,58(S10):S26-S35.
[18] VAN RIET-NALES DA,SCHOBBEN AF,EGBERTS TC,et al. Effects of the pharmaceutical technologic aspects of oral pediatric drugs on? patient-related outcomes:a systematic literature review[J]. Clin Ther,2010,32(5):924-938.
[19] 許淑紅,張綺,張林琦,等.探討我國兒科用藥的發展現狀及政策層面的思考[J].中國臨床藥理學雜志,2020,36(12):1760-1767.
[20] WU W,TANG Z,CHEN J,et al. Pediatric drug development in China:reforms and challenges[J]. Pharmacol Res,2019. DOI:10.1016/j.phrs.2019.104412.
[21] 吳娟,張順國,黃詩穎,等.兒童藥物臨床試驗的發展及現狀[J].醫藥導報,2018,37(1):74-77.
[22] 國家衛生健康委員會.關于政協十三屆全國委員會第二次會議第0914號(社會管理類088號)提案答復的函[EB/OL].(2020-09-14)[2020-12-15]. http://www.nhc.gov.cn/wjw/tia/202009/9f90aca23fc74a62964d23482f800e7e.shtml.
(收稿日期:2020-09-14 修回日期:2020-12-24)
(編輯:孫 冰)

