基于化學學科觀念培養的教學設計

[摘要] 以“利用化學方程式的簡單計算”為例開展培養化學學科觀念的課堂教學,學生了解化學方程式的含義,利用已有知識更好地認識化學反應中各物質之間存在的質量關系;學習如何利用化學方程式進行簡單計算,加深對化學反應中元素不變和質量守恒的理解,形成“元素觀”“守恒觀”等學科基本觀念。
[關鍵詞] 化學;學科觀念;教學設計
一、教學分析
“利用化學方程式的簡單計算”是人教版化學教材九年級上冊第五章課題3的內容,屬于課標中一級主題“物質的化學變化”中的內容。該主題建議化學教師教學緊密聯系生產、生活實際,使學生真切地感受到發生的化學變化,從而引導學生通過化學實驗探究認識化學變化的規律,初步了解化學變化研究的科學方法;通過具體而生動的化學變化,激發學生學習化學的興趣,從而逐步形成“物質可以變化”的學科觀點。
在前兩節的基礎上,教師安排學生學習化學變化中存在一定的質量關系,使學生深刻認識到化學變化遵循質量守恒定律;并能依據質量守恒定律來正確書寫化學方程式。在此基礎上,學生再通過模仿、分析比較等方法學習利用化學方程式簡單計算,認識到定量研究化學變化在化學與生活中的重要作用,形成化學學科物質“變化觀”。
學生在前四章已經掌握了利用化學方程式計算化合物中某些元素質量分數的解題技巧,第五章還學習了質量守恒定律的運用和正確書寫化學方程式。因此,課堂教學中可以將這三者融合起來,引導學生以“化學計量”為主線建構新的化學學科觀念知識網絡,進一步加深對化學反應中“元素不變”和“質量守恒”的理解,漸漸形成“元素觀”“守恒觀”等化學學科基本觀念。
[教學目標]
1.尋找化學方程式中“量”的信息,體會從定量的角度認識化學變化;2.利用解題方法的討論,認識到化學變化中存在一定“量”的關系,并能從元素的觀點進一步認識化學變化,更好地認識化學變化的本質。
[重點難點]
1.從定量的角度更好地理解化學反應,探究利用化學方程式進行簡單計算的方法;2.建立化學反應中的元素守恒思想。
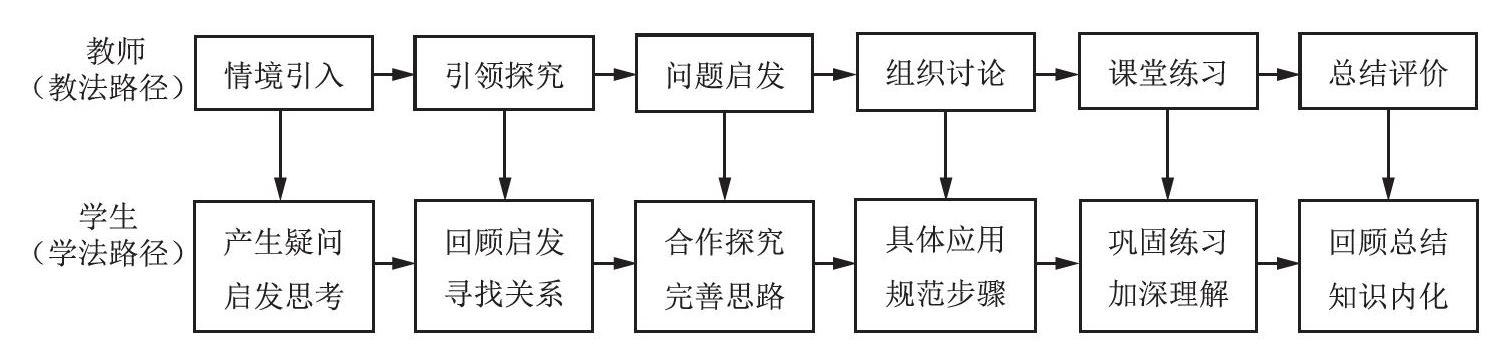
[教學流程]
二、教學過程
1.導入:視頻教學激發學生興趣
[活動1]引入氫能源汽車視頻,提問學生綠色鋼瓶中裝的是什么物質。
問題:(1)氫氣怎么樣獲取?(2)如何正確寫出制取氫氣的化學方程式?(3)如果要制取4 kg的氫氣,需要消耗水的質量至少是多少?
[設計意圖]在激發學生興趣的同時,引出了本節課的“主角”——氫能汽車,為整節課后面學生學習內容埋下伏筆,讓學生感受到化學就在我們身邊。在復習舊知的同時,讓學生體會到學習本節課內容的必要性。
2.探究活動一:尋找化學方程式中“量”的信息
[活動2]用紅色磁鐵釘代表氧原子模型、藍色磁鐵釘代表氫原子模型,要求學生在白磁板上搭出這個化學方程式的微觀示意圖。
問題:(1)觀察搭建的微觀結構示意圖,每2個水分子分解生成氫分子的數量是多少?生成氧分子的數量是多少?(2)上述反應中水分子、氫分子和氧分子的數量比是多少?(3)反應中微觀粒子的數量比等于化學方程式中什么數之比?
學生小組分工合作動手搭建水分子分解的微觀示意圖,仔細觀察和思考后回答問題。通過討論和交流,對依據化學方程式分析量的關系形成初步感悟。
[設計意圖]通過搭建微觀示意圖,讓學生直觀感知微觀方面的知識。在前面所學微觀知識的基礎上讓學生進一步從“粒子數量”的角度認識化學變化,知道粒子的數量比等于化學計量數之比。通過初步認識化學變化中微觀粒子之間存在一定的數量關系,學生逐步建立微粒觀。
[活動3]投影氫和氧的相對原子質量的近似值,得出原子質量很小的結論。從已知水由大量水分子構成,延伸到氫氣由大量氫原子構成、氧氣由大量氧原子構成。引導學生發現微觀粒子之間存在一定的數量關系,化學變化中宏觀物質間也存在一定的質量關系。
問題:(1)在這個分解反應中,水分子、氫分子以及氧分子三種分子的個數比是2:2:1,那么該分解反應中三種物質水、氫氣、氧氣的質量比呢?(2)應該怎么計算該化學反應中各物質的質量比?
學生經過宏觀和微觀相結合的比較、分析、計算回答問題。通過討論和交流,對依據化學方程式分析量的關系形成初步感悟。
[設計意圖]讓學生初步認識到化學變化中宏觀物質之間質量關系是存在的,學會計算化學反應中每種物質的質量比,深刻體會微觀粒子的數量關系與宏觀物質質量的關系之間的關聯。讓學生更好地感受從微觀到宏觀的過程,進一步體驗從微觀認識問題的必要性。
3.探究活動二:學習依據化學方程式計算的方法
[活動4]通過問題串讓學生感受化學變化中物質的質量關系,幫助學生建立對化學計算過程的正確認識,學會有關化學物質質量的正確計算。
問題:(1)計算出相關物質的質量。
(2)以上計算的依據是什么?
(3) 制取4 kg的氫氣,至少需要消耗水的質量是多少?
學生自己按照課本例題的解題樣式,在導學案上寫出該題完整的解題步驟。
師生互動:(1)學生說解答過程,教師板書;(2)其
他學生補充、討論出完整的解答格式和解題時的注意事項;(3)師生共同總結解題的步驟。
[活動5]投影例題,引導學生思考解決實際問題。
例題:電解氧化鋁10.2 t理論上可以生產出鋁的質量是多少?
學生思考,動筆計算后回答。
師生互動:(1)投影兩份學生的解答過程,其他學生“找不同”;(2)相鄰的學生之間互相“找不同”。
[設計意圖]讓學生體驗到學習后取得的進步,認識到可以依據物質的質量關系進行相關計算,同時進一步體會化學變化中物質的質量關系。引導學生自主建構解題的格式,鍛煉學生的交流、表達能力。
4.探究活動三:尋找計算的其他方法
[活動6]引導學生從其他角度思考解決探究活動二的問題,通過討論認識到從元素角度分析化學變化可以更方便解決此類問題。
問題:(1)從元素的角度分析化學方程式,氧化鋁中鋁元素全部轉化為什么物質?(2)氧化鋁中鋁元素的質量與生成的單質鋁質量之間關系如何?(3)如何計算10.2 t氧化鋁中鋁元素的質量?(4)計算的主要依據是什么?(5)如何計算出同時生成的氧氣質量呢?
學生思考回答,提升化學思維。
[設計意圖]教師應從學生已有的知識出發,逐步引導學生運用化學變化中元素質量不變的思想來解答問題,進一步體會到化學變化中元素守恒的觀念。讓學生認識到,要應用化學變化首先要認識、研究化學變化。
5.探究活動四:利用化學方程式簡單計算解決問題
[活動7]投影例題,播放視頻,使學生了解不同解法的差異。引導學生認識不同解法差異的本質原因,即指向解決此類問題的關鍵——元素守恒思想。根據“利用化學方程式判斷元素的變化情況”,突出化學方程式在解決簡單計算問題中的作用。
例題:化學實驗室用含H2O2 3.4 g的過氧化氫溶液來制取氧氣,最多可以產生多少氧氣?
學生比較兩種解法的差異,尋找差異的原因和正確解決問題的方法。
[設計意圖]學生根據自己的體會自主選擇解題的方法,進一步運用“量”的關系來解決問題。在此基礎上,讓學生將化學方程式的計算、化學式的計算融合起來,提升了學生的化學計算思維,更好地領悟元素守恒思想的運用。
6.總結:升華知識,重申重難點
[活動8]讓學生明確化學變化中量之間的關系,并對化學變化開展進一步的定量研究,以更好地認識、控制和利用化學變化,解決生活、生產以及科學研究中的某些具體問題。
[設計意圖]初步建立從定量的角度研究化學變化的意識。加深對化學反應中元素不變和質量守恒的理解,逐步形成“元素觀”“守恒觀”等學科基本觀念。
三、教學拓展
“利用化學方程式的簡單計算”教學關鍵是讓學生自己獨立思考、探究,得出從定性到定量的解題思路與方法。再從已學的有關化學式計算入手,找出隱含在化學方程式中的物質間數量關系,歸納出利用化學方程式進行簡單計算的思路和方法,深刻地領悟化學變化中的元素守恒思想。教師在化學方程式計算方法教學的過程中,一定要嚴格要求解題格式與解題步驟,這樣可以更好地培養學生一絲不茍的科學態度。
1.創設情境,深化學習體悟
創設一系列的情境,不僅可以調動學生學習化學的興趣,而且還讓學生潛移默化地深刻體驗到:利用化學方程進行的簡單計算,不是簡單的數學計算,而是建立在對化學變化中“量”的認識的基礎上。定量分析化學變化在生活、生產和科研中有著重要意義,要從定量的角度認識化學變化的必要性。
2.比較討論,促進微觀認知
通過歸納比較和交流討論,教師要引導學生體驗化學反應中的各粒子間的數量關系,確定宏觀物質的質量關系,從而得出化學方程式計算的依據。學生經歷了從微觀本質思考問題的化學學科思維過程,進一步從微觀角度、元素角度、定量角度等不同的方面認識化學變化,有效地促進基于元素觀、微粒觀和變化觀的認知方法的建構。
3.引導思維,理解化學本質
對于計算解題方法與思路的討論,不能只停留在計算的基本格式上,教師需要發展學生的思維能力,將宏觀與微觀、定性與定量在化學學習中融為一體,引導學生在“微觀粒子間的數量關系、宏觀物質間的質量關系、化學變化前后元素質量不變”三個方面對化學變化的本質有更深刻的理解。
4.開發教材,滲透研究方法
基于學科觀念方法教學的需要,教師要適時對教材進行二次開發和利用,在真實的情境中引領學生學習。這些情境包括了生活與實驗、科技與社會等方面,旨在開闊學生的眼界,讓其感受化學學科的魅力。在進行學科觀念教學的同時,注重科學研究方法的引領,讓學生體驗到定量研究化學變化的價值所在,引導學生掌握科學研究的正確方法。
5.融合實驗,體驗學科價值
教學中,教師要以基礎實驗為依據,符合學生的認知規律。要將化學實驗儀器生活化,拉近科學與生活的距離,讓學生認識到實驗探究無處不在;同時將化學計量與化學實驗有機融合,還原真實情景,使學生一方面進一步感知化學變化的魅力,另一方面也體驗到化學計量的實際意義和價值。
采有余? ?江蘇省南京市揚子第一中學松楊路分校。

