依達拉奉加強PC12細胞氧化損傷自噬防護的機制研究
郭道宇 劉昊 李冬

【摘要】 目的:研究依達拉奉防護過氧化氫(H2O2)損傷神經細胞PC12的分子機制,為依達拉奉在腦出血疾病的治療利用提供理論依據。方法:本研究設置對照組(PC12細胞)、損傷組[PC12細胞+H2O2(600 μmol/L)]和處理組[PC12細胞+H2O2(600 μmol/L)+依達拉奉(0.5 mmol/L)]。觀察依達拉奉對PC12細胞氧化損傷防護效果。結果:損傷組PC12細胞繁殖下降,而處理組細胞數量接近對照組。細胞流式實驗顯示:處理組PC12細胞沒有發生明顯的凋亡,而損傷組細胞凋亡率稍高。與對照組比較,損傷組細胞內ROS的熒光強度顯著升高,損傷組細胞培養上清液中SOD、GSH-Px活性均顯著降低,而MDA含量顯著升高(P<0.05)。與損傷組比較,處理組細胞內ROS的熒光強度顯著降低,處理組細胞培養上清液中SOD、GSH-Px的活性均顯著提高,MDA水平顯著降低(P<0.05)。Western blot實驗分析結果顯示:處理組中ATG7表達顯著增強,同時,LC3Ⅰ含量減少,而LC3Ⅱ含量增加。結合KEGG富集分析發現:在損傷組和對照組間,有4條信號通路發生了顯著性變化,其中mTOR信號通路和Caspase介導的信號通路被激活;在處理組和對照組間,有12條信號通路發生了顯著性變化,其中mTOR信號通路和MAPK信號通路被激活,而與細胞凋亡密切相關的Caspase信號通路沒有顯著增強。結論:依達拉奉通過增強PC12細胞自噬而防護氧損傷。該研究為依達拉奉在氧損傷對神經元細胞保護機制的研究提供了一定的理論參考。
【關鍵詞】 PC12細胞 依達拉奉 H2O2脅迫 自噬 轉錄組學
Study on the Mechanism of Edaravone Enhancing Autophagy Protection in PC12 Cells from Oxidative Injury/GUO Daoyu, LIU Hao, LI Dong. //Medical Innovation of China, 2021, 18(36): 0-030
[Abstract] Objective: To study the molecular mechanism of Edaravone protecting nerve cell PC12 from hydrogen peroxide (H2O2) injury, so as to provide a theoretical basis for the treatment and utilization of edaravone in intracerebral hemorrhage. Method: In this study, the control group (PC12 cells) and the injury group [PC12 cells + H2O2 (600 μmol/L)] and treatment group [PC12 cells + H2O2 (600 μmol/L) + Edaravone (0.5 mmol/L)]. The protective effect of Edaravone on oxidative damage of PC12 cells was observed. Result: The proliferation of PC12 cells in the injury group decreased, while the number of cells in the treatment group was close to that in the control group. Flow cytometry showed that there was no obvious apoptosis in PC12 cells in the treatment group, but the apoptosis rate in the injury group was slightly higher. Compared with the control group, the fluorescence intensity of ROS in the injured group increased significantly, the activities of SOD and GSH-Px in the cell culture supernatant decreased significantly, and the content of MDA increased significantly (P<0.05). Compared with the injury group, the fluorescence intensity of ROS in the treatment group decreased significantly, the activities of SOD and GSH-Px in the cell culture supernatant in the treatment group increased significantly, and the level of MDA decreased significantly (P<0.05). The results of Western blot analysis showed that the expression of ATG7 was significantly increased in the treatment group, while the content of LC3Ⅰ decreased and the content of LC3Ⅱ increased. Combined with KEGG enrichment analysis, it was found that there were significant changes in four signal pathways between the injury group and the control group, in which mTOR signal pathway and caspase mediated signal pathway were activated; There were significant changes in 12 signal pathways between the treatment group and the control group, in which mTOR signal pathway and MAPK signal pathway were activated, but caspase signal pathway closely related to apoptosis was not significantly enhanced. Conclusion: Edaravone protects PC12 cells from oxygen injury by enhancing autophagy. This study provides a theoretical basis for the action of edaravone protection of neurons from oxygen-induced injury.
[Key words] PC12 cells Edaravone H2O2 stress Autophagy Transcriptomics
First-author’s address: North China University of Science and Technology Affiliated Hospital, Hebei Province, Tangshan 063009, China
doi:10.3969/j.issn.1674-4985.2021.36.007
腦出血(intracerebral hemorrhage,ICH)是由血管壁病變或腦血管導致顱內血液凝結功能障礙或血液動力學改變的一種非創傷性的腦實質出血[1]。腦出血可引起多種類型的神經元損傷,氧化應激損傷是其中之一[2]。大腦細胞中含有豐富的脂質且抗氧化能力較弱,因此很容易成為氧化應激損傷的靶點[3-4],因此,腦出血后神經元細胞凋亡、死亡、自噬等都與氧化應激損傷后過度出現的自由基和ROS有關[5-6],這些自由基和ROS等的過度化打破了神經元細胞抗氧化防御機制的最強能力,從而導致細胞發生損傷[7]。
先前研究表明在氧化應激的狀態下,Keap1/Nrf2復合物中解離下的轉錄因子Nrf2進入細胞核,結合在抗氧化反應元件(ARE)上激活許多抗氧化酶[8-9]。而腦保護劑依達拉奉,一種自由基清除劑[10],可以有效提高Nrf2的表達從而抑制氧化應激對神經元細胞的損傷[8]。但是Nrf2基因是怎樣被依達拉奉增強轉錄的機制尚不清楚,本研究構建腦出血后氧化應激神經細胞模型(H2O2脅迫PC12細胞),通過RNA-seq技術深入解析依達拉奉對神經細胞的保護作用。現報道如下。
1 材料與方法
1.1 試劑與儀器 依達拉奉( Edaravone,Mitsubishi Chemical Corporation,日本),DMEM培養基,胎牛血清(Gibco,美國),超凈工作臺(蘇州凈化),CO2培養箱(ESCO),高速低溫離心機,全波長酶標儀(SPECTROstar Nano),流式細胞儀(伯樂S6e)等。蛋白提取試劑(碧云天生物科技有限公司),MDA和SOD活性檢測試劑盒(北京索萊寶生物科技有限公司)、Western blot抗體(Abcam)、RNA-seq實驗(上海生工生物工程有限公司)。
1.2 細胞分組與處理 本實驗所用PC12細胞購自中國科學院典型培養物保藏委員會細胞庫,然后齊魯醫藥學院保存。本實驗中將PC12細胞分為對照組、損傷組和處理組,每組5個重復,對照組采用DMEM培養基培養,損傷組在培養基中加入H2O2(終濃度為600 μmol/L)[11],處理組在培養基中加入終濃度為600 μmol/L的H2O2后12 h,加入依達拉奉注射液(終濃度為0.5 mmol/L)[12]。將三組細胞置于37 ℃,5% CO2培養箱孵育24 h。
1.3 細胞存活率檢測 將三組PC12細胞以1×103個/孔的細胞量接種于96孔板,37 ℃、5% CO2培養箱中培養24 h,然后每孔加入MTT(5 mg/mL),37 ℃繼續孵育4 h。去掉培養基,用PBS緩沖液清洗一次,去掉PBS后再每孔加入100 μL二甲基亞砜(dimethyl sulfoxide,DMSO)溶解甲瓚晶體。待結晶完全溶解后,吸棄DMSO,用PBS緩沖液清洗3遍后,加入100 μL PBS緩沖液,置于酶標儀中測定波長490 nm處吸光值。
1.4 細胞凋亡檢測 將三組細胞以1×106個/孔的細胞量接種至6孔板中,37 ℃、5% CO2孵箱中孵育培養72 h,胰酶消化后,用Annexin V-FITC和Propidium Iodide(PI)雙染法在流式細胞儀上進行細胞凋亡檢測并進行數據分析。
1.5 細胞氧化應激水平檢測 PC12細胞被藥物處理后,加入0.5%的胰酶消化細胞,收集細胞到15 mL離心管,4 ℃ 1 000 r/min離心沉淀細胞,吸取并保存上清液。將上清液與熒光探針DCFH-DA 1 mmol/L在室溫孵育30 min,然后用酶標儀檢測熒光強度。根據熒光強度及試劑盒說明書上的計算方法評估細胞上清液中MDA含量和SOD活性。
1.6 Western blot檢測細胞自噬相關蛋白 取處理后的細胞樣品裂解提取總蛋白,并用Qubit 3.0熒光儀測定蛋白濃度。取20 μg總蛋白進行10%的SDS-PAGE電泳,然后進行轉膜至PVDC膜。用5%脫脂牛奶室溫封閉蛋白2 h,隨后加入一抗(ATG7 1︰500,LC3Ⅱ 1︰1 000,LC3Ⅰ 1︰500,Actin 1︰1 000)置于4 ℃環境進行過夜封閉,第2天加入對應二抗(1︰2 000)室溫封閉1 h,最后滴加ECL。以Actin作為內參,在暗室壓片曝光分析。
1.7 轉錄組基因富集分析 取處理后的細胞樣品提交給Beyotime生物技術公司進行RNA-seq。使用Qubit? 3.0熒光儀(Invitrogen)對RNA定量后,上機RNA樣品按照QuantSeq 3’mRNA-Seq文庫試劑盒FWD(illumina)說明進行處理,然后使用NextSeq 500測序系統(illumina)進行分析。數據FASTQ文件被上傳到隨機軟件BaseSpace進行分析[13]。使用BaseSpace軟件中的Cufflinks Assembly和DE application (Version 2.1.0)對輸出文件進行分析,以確定差異表達基因(DEGs),這些差異表達基因用于生成表達熱圖和FPKM散點圖。此外,數據基因的分析還使用ClueGO(2.3.3版)、CluePedia(1.3.3版)、Cytoscape(3.5.1版)等軟件。生物過程(BPs)的功能分組是基于Kappa評分進行的。下載基因本體數據進行分析。基因集富集分析(3.0版)用于測定實驗組中差異富集的BPs[14]。
1.8 統計學處理 采用SPSS 18.0 (SPSS Inc.,Chicago,IL,USA)軟件對所得數據進行統計分析,計量資料用(x±s)表示,比較采用t檢驗;計數資料以率(%)表示,比較采用字2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 依達拉奉對PC12細胞氧化損傷防護效
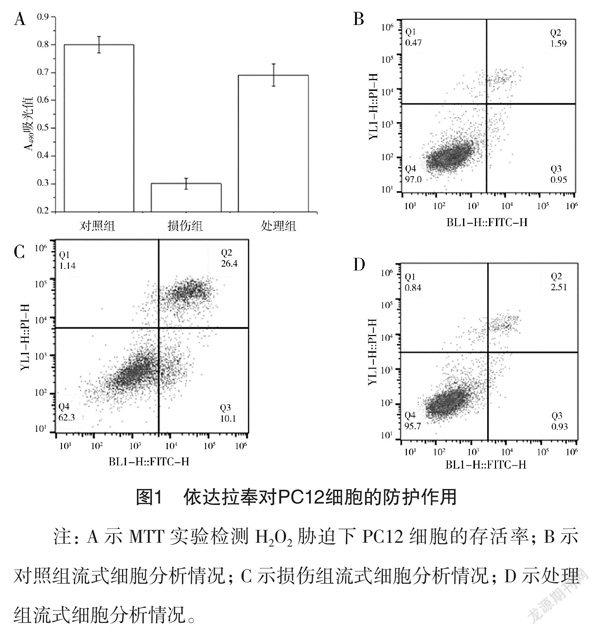
果 對照組吸光值為(0.80±0.03),損傷組吸光值為(0.31±0.02),處理組吸光值為(0.69±0.04)。損傷組PC12細胞繁殖下降,可能是因為H2O2引起細胞死亡或凋亡,而處理組細胞數量接近對照組,見圖1A。細胞流式實驗顯示:處理組PC12細胞沒有發生明顯的凋亡,而損傷組細胞凋亡率稍高,見圖1B、1C、1D。
注:A示MTT實驗檢測H2O2脅迫下PC12細胞的存活率;B示對照組流式細胞分析情況;C示損傷組流式細胞分析情況;D示處理組流式細胞分析情況。
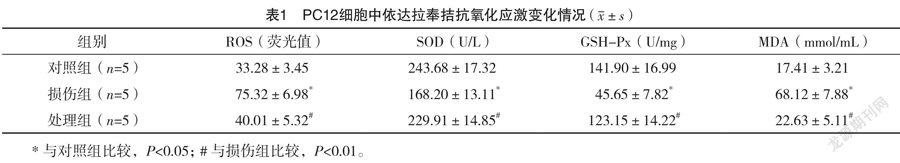
2.2 PC12細胞中依達拉奉拮抗氧化應激變化情況 與對照組比較,損傷組細胞內ROS的熒光強度顯著升高,損傷組細胞培養上清液中SOD、GSH-Px活性均顯著降低,而MDA含量顯著升高(P<0.05)。與損傷組比較,處理組細胞內ROS的熒光強度顯著降低,處理組細胞培養上清液中SOD、GSH-Px的活性均顯著提高,MDA水平顯著降低(P<0.05)。見表1。
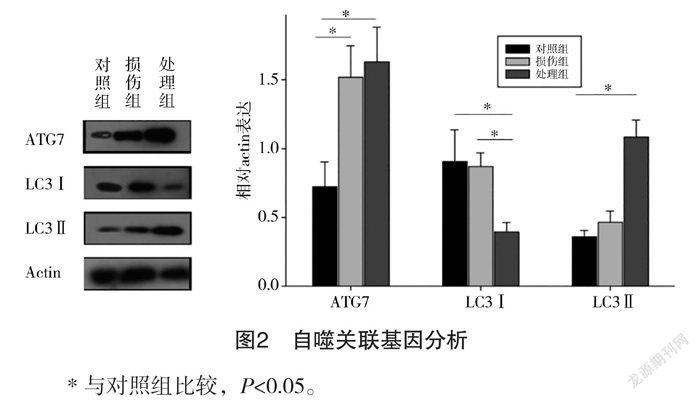
2.3 依達拉奉促進PC12細胞自噬情況 通過Western blot實驗分析依達拉奉對PC12細胞的防護作用,對每條條帶灰度值采用ImageJ軟件分析,以actin蛋白灰度值為基準,計算各蛋白的相對表達,對照組ATG7表達量為(0.72±0.20),損傷組ATG7表達量為(1.52±0.23),處理組ATG7表達量為(1.63±0.25);對照組LC3Ⅰ表達量為(0.93±0.23),損傷組LC3Ⅰ表達量為(0.87±0.10),處理組LC3Ⅰ表達量為(0.39±0.05);對照組LC3Ⅱ表達量為(0.36±0.05),損傷組LC3Ⅱ表達量為(0.46±0.08),處理組LC3Ⅱ表達量為(1.08±0.12)。結果顯示:處理組中ATG7表達顯著增強,同時,LC3Ⅰ含量減少,而LC3Ⅱ含量增加。見圖2。
2.4 依達拉奉激活mTOR信號通路 本研究將RNA-seq結果借助KEGG數據庫進行注釋和分析,結果表明:損傷組相對于對照組有4條信號通路發生了顯著性變化,其中mTOR信號通路和Caspase介導的信號通路被激活(圖3A),說明損傷組細胞的凋亡被啟動,氧化損傷增加了細胞凋亡;而處理組與對照組相比,有12條信號通路發生了顯著性增強,其中mTOR信號通路和MAPK信號通路被激活,而與細胞凋亡密切相關的Caspase信號通路沒有顯著增強(圖3B),說明處理組的依達拉奉降低了細胞凋亡,而增強了細胞自噬。
3 討論
MAPK/JNK信號通路被激活后會影響應激損傷狀態下細胞的存活。先前諸多實驗證實細胞自噬以及細胞內MAPK/JNK信號通路活化在缺血性腦卒中等多種神經系統疾病的病理過程中發揮了重要作用[15]。其中mTOR-MAPK信號通路對下游JNK因子有正調控作用。文獻[16]顯示細胞內氧自由基的增高是影響細胞自噬關鍵因素之一,而且尤為重要,且氧自由基能調節MAPK/JNK等多種信號轉導途徑。自由基增高是引起神經細胞凋亡和神經組織水腫的主要原因[17],本研究也觀察到了氧化損傷可引起細胞凋亡。
細胞自由基清除劑依達拉奉通過降低細胞內自由基濃度實現抗腦水腫和保護神經系統免受傷害的作用[18]。盡管目前依達拉奉被廣泛應用于腦出血的治療中,但是其抑制腦出血后MAPK/JNK/Caspase-3表達機制尚不清楚,該機制與細胞自噬的發生及疾病的緩解密切相關。
本研究結果顯示:損傷組PC12細胞繁殖下降,而處理組細胞數量接近對照組,表明H2O2給PC12神經元細胞造成損傷并抑制了細胞的生長,但是在添加依達拉奉后,細胞的繁殖情況明顯變好,說明依達拉奉能夠有效保護PC12細胞免受氧化損傷,具有拮抗氧化劑和細胞氧化應激的能力。而后進一步的流式細胞儀實驗顯示,處理組PC12細胞沒有發生明顯的凋亡,而損傷組細胞凋亡率稍高,表明H2O2誘發了PC12細胞凋亡,但是添加依達拉奉后觀察到細胞的凋亡率很低,接近對照組,猜測可能是依達拉奉降低了氧自由基,同時降低了細胞凋亡。為了深入分析其凋亡降低的機制,采用Western blot分析PC12細胞是否發生了自噬,結果顯示:處理組中ATG7表達顯著增強,同時,LC3Ⅰ含量減少,而LC3Ⅱ含量增加。在添加依達拉奉后,細胞自噬標記性基因的表達明顯上升。說明依達拉奉可能通過誘發細胞自噬啟動細胞存活的自我保護機制,避免受到氧損傷而死亡。
為了進一步說明依達拉奉加強了細胞自噬,進行了RNA-seq研究,轉錄組數據利用生物信息學進行KEGG分析,KEGG是涵蓋基因組信息、化學信息和生化系統功能的綜合數據庫,擁有16個子數據庫[19]。結果顯示在損傷組中細胞凋亡和自噬等關聯信號通路都被激活,而添加依達拉奉后自噬關聯信號通路被顯著激活而凋亡途徑沒有顯著差異,說明依達拉奉激活了細胞自噬。基于上述實驗,筆者認為依達拉奉對氧損傷神經元具有顯著防護作用,其通過增強細胞自噬功能而對細胞進行防護。
參考文獻
[1] ZHANG C,XIA B J,GE H,et al.Long-Term Mortality Related to Acute Kidney Injury Following Intracerebral Hemorrhage: A 10-Year (2010-2019) Retrospective Study[J].Journal of Stroke and Cerebrovascular Diseases,2021,30(5):105688.
[2] XU X,ZHANG J,YANG K,et al.Prognostic prediction of hypertensive intracerebral hemorrhage using CT radiomics and machine learning[J].Brain and Behavior,2021,11(5):e02085.
[3] Shoamanesh A,Katsanos A H.Combatting Secondary Injury From Intracerebral Hemorrhage With Supplemental Antioxidant Therapy[J].Stroke,2021,52(4).
[4] Salim S.Oxidative Stress and the Central Nervous System[J].
J Pharmacol Exp Ther,2017,360(1):201-205.
[5] Ozkul A,Akyol A,Yenisey C,et al.Oxidative stress in acute ischemic stroke[J].Journal of Clinical Neuroscience,2007,14(11):1062-1066.
[6] Magid-Bernstein J,Beaman C B,Poyraz F C,et al.Impacts of ABO Incompatible Platelet Transfusions on Platelet Recovery and Outcomes after Intracerebral Hemorrhage[J].Blood,2021,137(19):2699-2703.
[7] Sies H.Oxidative stress: oxidants and antioxidants[J].Experimental Physiology,1997,82(2):291-295.
[8] Vries H,Witte M,Hondius D,et al.Nrf2-induced antioxidant protection: a promising target to counteract ROS-mediated damage in neurodegenerative disease?[J].Free Radic Biol Med,2008,45(10):1375-1383.
[9] Wei R,Enaka M,Muragaki Y.Activation of KEAP1/NRF2/P62 signaling alleviates high phosphate-induced calcification of vascular smooth muscle cells by suppressing reactive oxygen species production[J].Sci Rep,2019,9(1):10366.
[10]祝丹丹,夏磊,陳泉,等.依達拉奉對腦出血血腫周圍水腫的影響[J].心腦血管病防治,2021,21(1):90-92.
[11]王力波,貝赟,秦東旭,等.依達拉奉通過Nrf2信號分子調節氧化應激減輕腦缺血再灌注誘導的神經損傷[J].中國生物化學與分子生物學報,2020,36(3):328-336.
[12] LIU X,WU Y,ZHOU D,et al.Nlinoleyltyrosine protects PC12 cells against oxidative damage via autophagy: Possibleinvolvement of CB1 receptor regulation[J].International Journal of Molecular Medicine,2020,46(5):1827-1837.
[13]李福記,梁靖梅,段秀萍,等.苦參堿對TGF-β1誘導的人腹膜間皮細胞ETS2表達的影響[J].中國現代醫生,2020,58(6):30-33.
[14]于瑜,王鐘興.基于生物信息學途徑篩選缺血性腦卒中關鍵基因及藥物預測[J].中山大學學報(醫學科學版),2021,42(1):42-50.
[15] Schellino R,Boido M,Vercelli A.JNK Signaling Pathway Involvement in Spinal Cord Neuron Development and Death[J].Cells,2019,8(12):1576.
[16] LI N,LU X Y,SHI W Y,et al.Combined mTOR/MEK inhibition prevents proliferation and induces apoptosis in NF2-mutant tumors[J].Eur Rev Med Pharmacol Sci,2019,23(13):5874-5883.
[17] Paasz A,Segovia Y,Skowronek R,et al.Molecular neurochemistry of the lanthanides[J/OL].Synapse,2019,73(9):e22119.
[18] MIAO H,JIANG Y,GENG J,et al.Edaravone Administration Confers Neuroprotection after Experimental Intracerebral Hemorrhage in Rats via NLRP3 Suppression[J].Journal of Stroke and Cerebrovascular Diseases,2019,29(1):104468.
[19]郭俊愷,趙承磊,趙興旺,等.通過生物信息學分析鑒定干燥綜合征的關鍵基因[J].中國麻風皮膚病雜志,2021,37(3):131-135,152.
(收稿日期:2021-04-07) (本文編輯:姬思雨)

