β-內酰胺酶血培養瓶對含抗菌素模擬兒童菌血癥標本的檢測效能
陳 楠,沈永明,張 瑩,李國旭,閆曉丹,劉 洋
(1.天津醫科大學兒童臨床學院/天津市兒童醫院檢驗科,天津 300134;2.天津醫科大學研究生院,天津 300070;3.天津醫科大學兒童臨床學院/天津市兒童醫院新生兒內科,天津 300134)
膿毒癥(sepsis)是導致全球范圍內成人和兒童死亡的主要原因之一[1],其發病率和病死率在新生兒和兒童中最高,并且在過去幾十年沒有顯著下降[2,3]。調查顯示[4],兒童膿毒癥在兒科重癥病房的發病率為8.2%,住院病死率達25%,細菌約占病原的55%。關于膿毒癥處理的指南,幾乎都強調了在使用抗菌素之前采集血液進行血液培養的重要性[5],但超過40%的住院患者采血培養前應用了抗菌素[6],約20%患者在入院時已經使用口服抗菌素[7],兒科診療水平的差異及抗菌素的不合理應用,使得上述現象在兒科尤為突出。目前,常采用含有樹脂或活性炭的培養瓶清除血標本中的抗菌素殘留提高血培養的檢出陽性率,縮短陽性報菌時間(TTP),但是也存在如干擾檢驗結果、增加基層醫療機構運行負擔等不足。由于兒童抗菌素選擇以β-內酰胺類抗菌素為主,本研究通過對比三種不同血培養瓶對含抗菌素模擬菌血癥標本的檢測能力,驗證添加β-內酰胺酶的培養瓶用于兒童菌血癥檢測的可行性,現報道如下。
1 材料與方法
1.1 標本來源 參考既往研究[8-10],選用有代表性的臨床常見病原菌種,獲得標準菌株。革蘭氏陽性菌:金黃色葡萄球菌ATCC 29213(天津市臨床檢驗中心);革蘭氏陰性菌:大腸埃希菌ATCC 25922(天津市臨床檢驗中心)。全血為健康人群的志愿獻血,獻血前2 周未應用抗菌素。
1.2 儀器與試劑 美國BD 公司BACTECTM 9240 全自動血液培養系統及其配套需氧微生物培養瓶[BD BACTECTM Peds PlusTM/F Culture Vials(BD-F瓶)],標準需氧微生物培養瓶[BD BACTECTMTM FX(BD-S 瓶)];法國梅里埃公司BACT/ALERT 3D全自動細菌及分枝桿菌培養監測系統,及其配套需氧和兼性厭氧微生物培養瓶[BACT/ALERT?PF(BTC 瓶)],標準需氧微生物培養瓶[BacT/ALERT SA(BT-S 瓶)]。本研究使用的每種培養瓶均為同一批次、且在有效期內。參考既往報道選擇臨床常用抗菌素[11,12]:注射用青霉素鈉(哈藥集團制藥總廠,批號:18020608-1,80 萬U/支);注射用頭孢呋辛鈉(75萬U/6ml/支,麗珠集團麗珠制藥廠,批號:J180201)。β-內酰胺酶:青霉素酶(600 萬U/2 ml/支,中國食品藥品檢定研究院,批號130441-201907);頭孢菌素酶(200 萬U/支,上海源葉生物科技有限公司,批號:J02M9F54980)。
1.3 方法 試驗方法參考文獻建立[6,13-15],培養瓶分為BD-S 瓶、BD-F 瓶、BD-SE 瓶和BT-S 瓶、BT-C 瓶、BT-SE 瓶兩類,按照所選菌株和抗菌素,兩類培養瓶分別分成金黃色葡萄球菌-青霉素鈉和大腸埃希菌-頭孢呋辛鈉,其中BD-SE 瓶和BT-SE 瓶為對照標本分別加入10 μl 上述濃度的青霉素酶或頭孢菌素酶,以達到試劑說明要求。每組重復10 份。實驗前,將菌株用血瓊脂平板37 ℃隔夜傳代2 次,用肉湯稀釋法測定其最小抑菌濃度(MIC)。將傳代后的實驗菌株(金黃色葡萄球菌及大腸埃希菌)配制成1.5×104CFU/ml 濃度備用,并用同一菌株的同一稀釋菌液完成全部實驗。按照藥劑說明書,分別制備抗菌素制劑,青霉素鈉1000 mg/L、頭孢呋辛鈉2500 mg/L備用;β-內酰胺酶制劑,青霉素酶7500 mg/L、頭孢菌素酶5000 mg/L 備用。在培養瓶中加入1 ml 無菌新鮮血液,再加入10 μl 上述濃度菌懸液,使血中菌濃度達到1.5×102CFU/ml;在含抗菌素組的培養瓶中分別加入10 μl 和20 μl 上述濃度抗菌素,使抗菌素濃度分別達到藥品說明書中的血藥中點(C1/2)和血藥峰濃度(Cmax)。將模擬標本培養瓶制備完成后,同時放入各自血液培養系統內,檢測時間為120 h。培養瓶記錄陽性報警時間,并涂片進行革蘭氏染色。
1.4 統計學分析 本次研究所有統計分析均采用SPSS 23.0 軟件完成。計數資料采用(%)表示,行χ2檢驗;計量資料采用()表示,組內比較行配對t檢驗,采用析因設計的方差分析評價因素的主效應及交互作用,進一步的多重比較采用LSD-t檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 金黃色葡萄球菌-青霉素鈉組與大腸埃希菌-頭孢呋辛鈉組陽性檢出率比較 不同抗菌素血藥濃度的陽性檢出率比較,差異有統計學意義(P<0.05);隨著抗菌素血藥濃度的增加,不同培養瓶中陽性檢出率逐漸降低;按照抗菌素血藥濃度進行分層,不同培養瓶的陽性檢出率比較,差異有統計學意義(P<0.05)。所有培養瓶對于不含抗菌素標本的檢出陽性率比較,差異無統計學意義(P>0.05);兩種抗菌素在血藥峰濃度時,BD-F 瓶、BD-SE 瓶的檢出陽性率均高于BD-S 瓶,差異有統計學意義(P<0.05);而BDF 瓶與BD-SE 瓶比較,差異無統計學意義(P>0.05);在血藥中點濃度時,BD-F 瓶、BD-SE 瓶與BD-S 瓶檢出陽性率比較,BD-F 瓶與BD-SE 瓶檢出陽性率比較,差異均無統計學意義(P>0.05)。頭孢呋辛鈉在血藥峰濃度時,BT-C 瓶、BT-SE 瓶的檢出陽性率優于BT-S 瓶,差異有統計學意義(P<0.05);而BT-C 瓶與BT-SE 瓶比較,差異無統計學意義(P>0.05);青霉素鈉在血藥峰濃度時,BT-C 瓶、BTSE 瓶的檢出陽性率與BT-S 瓶比較,BT-C 瓶與BT-SE 瓶比較,差異無統計學意義(P>0.05);兩種抗菌素為血藥中點濃度時,BD-F 瓶、BD-SE 瓶的檢出陽性率與BD-S 瓶比較,BD-F 瓶與BD-SE 瓶比較,差異無統計學意義(P>0.05),見表1、表2。
2.2 金黃色葡萄球菌-青霉素鈉組與大腸埃希菌-頭孢呋辛鈉組陽性檢出時間比較 析因設計的方差分析顯示,兩組不同培養瓶、不同抗菌素血藥濃度的TTP 比較,差異均有統計學意義(P<0.05)。對不含有抗菌素的標本,不同培養瓶的TTP 比較,差異無統計學意義(P>0.05);兩種抗菌素在血藥峰濃度和中點濃度時,BD-F 瓶、BD-SE 瓶的TTP 均優于BD-S瓶,差異有統計學意義(P<0.05);當青霉素鈉在血藥峰濃度時,BD-SE 瓶的TTP 優于BD-F 瓶,差異有統計學意義(P<0.05);當青霉素鈉在血藥中點濃度時,BD-SE 瓶與BD-F 瓶的TT 比較,差異無統計學意義(P>0.05);當頭孢呋辛鈉在血藥峰濃度和中點濃度時,BD-F 瓶與BD-SE 瓶的TTP 比較,差異無統計學意義(P>0.05)。兩種抗菌素在血藥峰濃度和中點濃度時,BT-C 瓶、BT-SE 瓶的TTP 均優于BTS 瓶,差異有統計學意義(P<0.05);當青霉素鈉在血藥峰濃度和中點濃度時,BT-C 瓶的TTP 均優于BT-SE 瓶,差異有統計學意義(P<0.05);當頭孢呋辛鈉在血藥峰濃度和中點濃度時,BT-C 瓶與BT-SE瓶的TTP 比較,差異無統計學意義(P>0.05),見表3和表4。
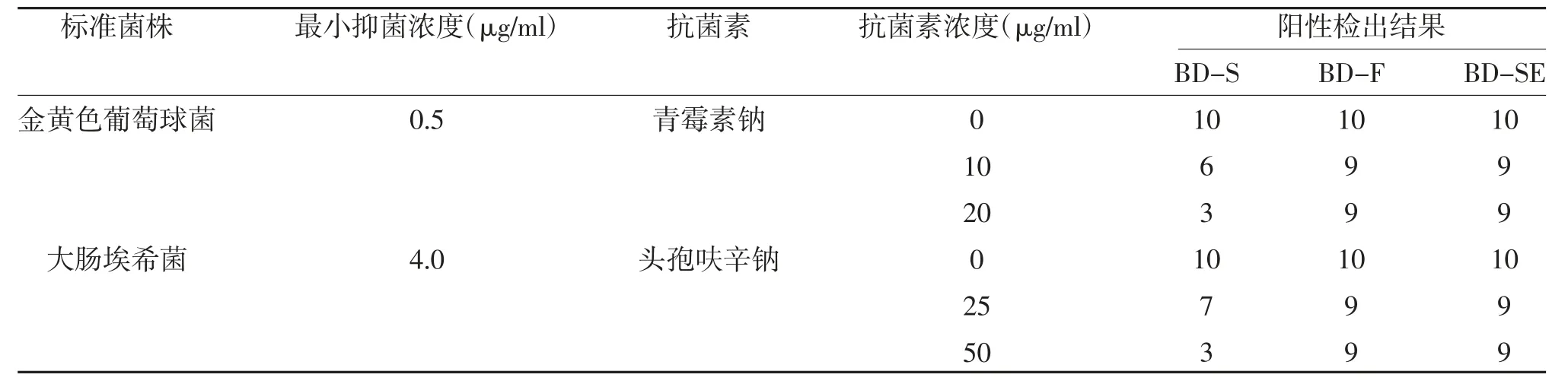
表1 不同細菌在BD-S、BD-F 與BD-SE 的陽性檢出結果
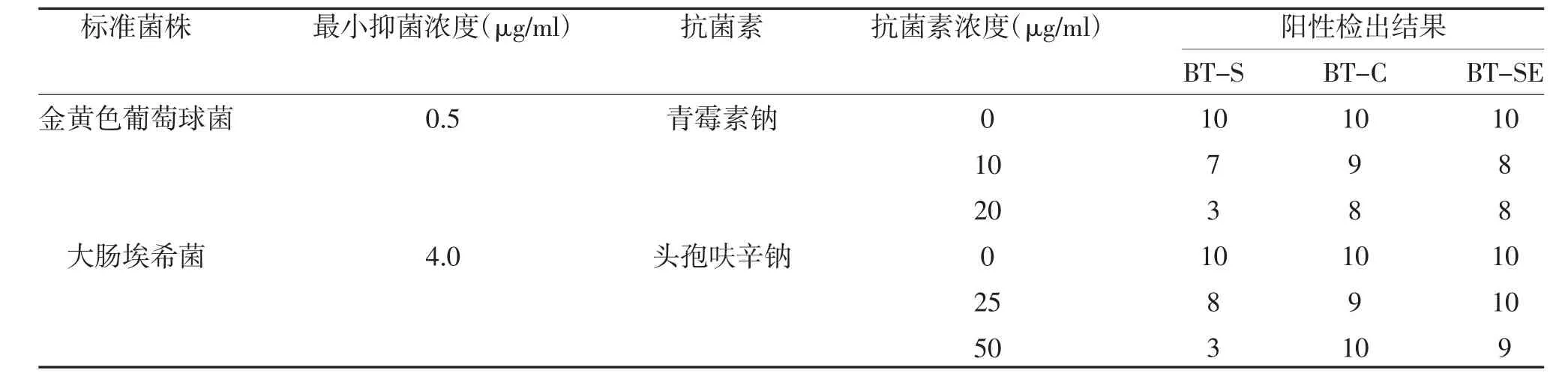
表2 不同細菌在BT-S、BT-C 與BT-SE 的陽性檢出結果

表3 不同細菌在BD-S、BD-F 與BD-SE 的陽性檢出時間

表4 不同細菌在BT-S、BT-C 與BT-SE 的陽性檢出時間
3 討論
2017 年,世衛組織已將膿毒癥列為未來十年衛生保健的重點之一[1]。我國5 歲以下兒童的主要死因中,膿毒癥的死亡率不降反升,有效降低膿毒癥的病死率也成為我國政府高度重視的工作。血液培養對感染性疾病的診斷、治療和預后有重要的臨床意義。但是,我國兒科診療水平差異較大,兒童膿毒癥病原檢出率約為23.5%~82.8%[9],且存在不同程度的不合理應用抗菌素,在獲得血培養標本之前應用抗菌素,會降低標本中細菌的載量,抑制細菌的生長,最終影響血培養陽性檢出率和TTP。
既往研究[13]已經證實了在培養瓶中添加樹脂、活性炭或聚美珠等抗菌素結合劑或吸附劑,可以有效中和血培養標本的抗菌素殘留,提高培養陽性率,縮短TTP。然而,該方法也存在一些局限性,如活性炭的存在可能是應用革蘭氏染色、直接質譜分析、分子方法和直接抗菌素敏感測試的主要限制因素。中低收入國家廣泛應用該技術尚存在一定困難[5]。研究顯示[14],美羅培南及少數頭孢菌素的峰值血藥濃度可能會超過樹脂培養瓶的中和能力。而由于特殊的生理特點和多數抗菌素的毒副作用,兒童的抗菌治療以頭孢菌素類和青霉素類為首選[11]。基于此,本研究通過添加可以分解頭孢菌素類和青霉素類抗菌素的β-內酰胺酶制劑的方式,實現提高血培養陽性檢出率,縮短TTP 的目的,為兒童膿毒癥患者的診治提供幫助。
目前,體外模擬實驗評估不同培養瓶清除標本中抗菌素能力的方法已經被廣泛開展[6,13,14]。本研究分別選用具有代表性的金黃色葡萄球菌-青霉素鈉、大腸埃希菌-頭孢呋辛鈉的組合,完成體外模擬實驗。結果顯示,抗菌素的殘留的確降低了血培養的陽性率,延長了TTP,并且隨著抗菌素濃度的增加,影響更加明顯。對于青霉素鈉、頭孢呋辛鈉兩種β-內酰胺類抗菌素,添加了樹脂、活性炭及β-內酰胺酶的三種培養瓶,均可通過清除血標本中的殘留抗菌素,達到提高陽性檢出率和縮短TTP 的效果。在陽性檢出率和TTP 方面,添加了β-內酰胺酶的培養瓶幾乎達到了與添加了樹脂或活性炭的培養瓶相接近的效能。因此,通過添加β-內酰胺酶清除血培養標本內殘留的β-內酰胺類抗菌素具有一定可行性,同時也可以嘗試作為樹脂培養基的有益補充,為兒童膿毒癥患者以及中低收入國家的醫務人員解決血培養標本中抗菌素殘留問題提供了新的選擇。另外,操作中需嚴格遵循無菌操作,以避免在培養瓶中添加β-內酰胺酶而導致的標本污染。
綜上所述,添加了β-內酰胺酶的培養瓶對于含抗菌素模擬兒童菌血癥標本檢驗效能優于普通培養瓶,并且與含有樹脂、活性炭的培養瓶檢驗效能接近。

