基于網絡藥理學探討敗醬草治療大腸癌的作用機制*
吳夢雪,彭濤,崔亞新,趙麗君
山西中醫藥大學 山西 太原 030024
中藥是我國寶貴的資源,在豐富的中醫理論指導下,從整體與局部關聯的角度出發,通過藥物中有效成分的體內代謝,實現藥物對機體的系統調控[1]。運用網絡藥理學的方法研究中藥的藥效成分、潛在作用靶點,突破了傳統研究的不足,具有快速靈活、準確率更高的特點[2]。敗醬草又稱鹿腸、澤敗、苦菜等,始載于《神農本草經》,味辛、苦,性微寒,具有清熱解毒、消癰排膿、祛瘀止痛之功,常用于腸癰、肺癰、疔瘡腫毒等。王登等[3]通過數據挖掘發現,敗醬草常與赤芍、蒲公英等清熱解毒、化瘀止血類的中藥配伍,治療以帶下病、腹痛及淋證最為常見,證候以濕熱下注、瘀血內阻為主。孫桂芝教授[4]運用紅藤、敗醬草作為治療大腸癌的藥對,有清熱解毒、活血祛瘀的功效。姜良鐸教授[5]運用敗醬草配赤、白芍等作為治療大腸癌的核心用藥。張冰教授[6]根據腫瘤患者正邪之氣偏盛的不同,將治療分為“扶正固本法、祛邪法和護肝腎”三法,認為邪氣偏盛的癌癥患者常伴有痰瘀、熱毒等特點,選用魚腥草、敗醬草、白花蛇舌草等。張青教授[7]以“肺與大腸相表里”為理論基礎,以薏苡敗醬三仁湯為主,應用方中敗醬草改善腸道炎性環境治療直腸癌術后患者的前切除綜合征。成分是中藥發揮作用的基礎,靶點是藥物與疾病的紐帶。本文將應用網絡藥理學的方法研究敗醬草治療大腸癌的主要活性成分和作用靶點,并對其作用機制進行探索與分析。
1 資料與方法
1.1 篩選敗醬草關鍵成分通過中藥系統藥理學數據庫與分析平臺(traditional chinese medicine systems pharmacology database and analysis platform,TCMSP)獲取敗醬草化合物,根據藥動學特性參數,以口服生物利用度(oral bioavailability,OB)≥30%、類藥性(drug-likeness,DL)≥0.18為篩選條件,其中OB是指藥物經口服給藥后被機體吸收進入血液循環的相對量和速率;DL反映化合物中的特定功能基團與已知藥物的相似性;二者對中藥化學成分活性的評估具有重要意義[8]。同時對敗醬草的作用靶點進行篩選,將所收集的靶點匯總并去除重復靶點,即為藥物的關鍵靶點。
1.2 篩選敗醬草與大腸癌基因名稱在Uniprot數據庫中,輸入敗醬草關鍵靶點對應的基因名稱,限定物種為“human”,將得到的結果導出并整理。在Drugbank、OMIM與TTD數據庫中以“colorectal cancer”為關鍵詞查詢大腸癌的基因,并取三者合集。
1.3 藥物—靶點網絡構建與分析將敗醬草關鍵活性成分與靶點分別編秩,將編好的網絡文件導入Cytoscape3.8.0軟件,建立藥物成分-靶點網絡,分析敗醬草成分中起關鍵作用的靶點。
1.4 蛋白互作網絡構建為了闡明關鍵蛋白質之間的相互作用,將篩選出的關鍵靶點導入STRING數據庫,以高置信度≥0.700為條件導出,并導入Cytoscape3.8.0軟件進行網絡可視化分析,其中靶點的度值表示相互作用的靶點數。
1.5 GO功能、KEGG通路富集分析運用Metascape3.8.0數據庫對敗醬草抗大腸癌的靶點蛋白進行GO功能和KEGG富集通路分析,篩選P<0.05的GO功能和KEGG通路。
2 結果
2.1 敗醬草化合物與靶點篩選結果通過TCMSP數據庫查詢到敗醬草全部活性成分共52種,以 OB≥30%、DL≥0.18為篩選條件,得到關鍵成分13種,見表1。同時查詢TCMSP數據庫的敗醬草關鍵成分對應的靶點,獲得422個靶點,去除重復靶點,得到209個靶點,其中一種成分黃草烏堿丙(vilmorrianineC)無對應靶點,故舍棄。
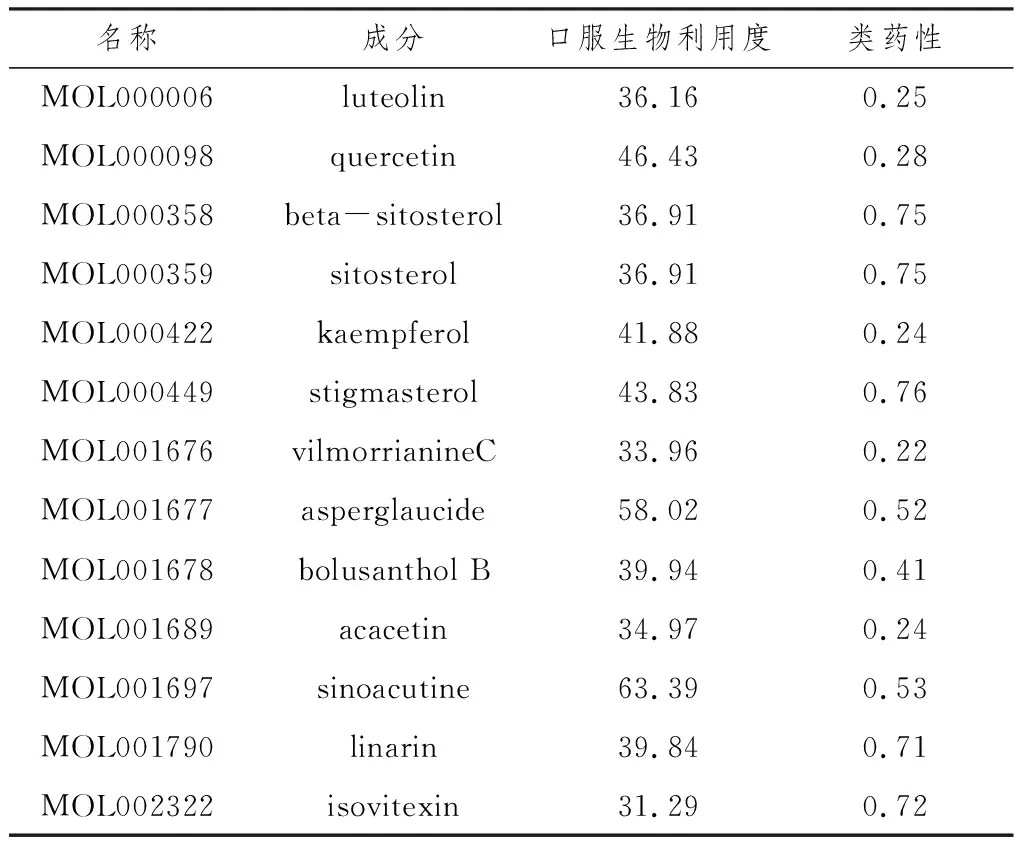
表1 敗醬草關鍵成分篩選結果
2.2 敗醬草治療大腸癌的基因匯集運用Uniprot數據庫將與敗醬草靶點進行基因名匹配,去除無法匹配的基因后,共406個基因,去除重復基因后,共209個。在GeneCards、Drugbank、OMIM與TTD數據庫中以“colorectal cancer”為關鍵詞查詢大腸癌基因,分別查詢到25、200、87個基因名。對以上基因去重復,得到295個相關基因合集,與敗醬草209個靶點基因進行交集后,得到33個共同基因,見圖1。

圖1 藥物-疾病靶點交集
2.3 敗醬草成分-靶點網絡構建運用Cytoscape 3.8.0軟件構建藥物活性成分-靶點網絡。以敗醬草12個主要活性成分及其去重后靶點共計209個,在該成分-靶點網絡中,共有222個節點,418條邊,以度值大小作為敗醬草活性成分與靶點、靶點與靶點間相互聯系的程度,度值越大,說明該成分或靶點在敗醬草作用機制中有重要作用。如圖2所示,黃色為藥物,綠色為敗醬草活性成分,橘色為藥物靶點,成分中MOL000098(槲皮素)度值為150,MOL000422(山柰酚)度值為61、MOL000006(木犀草素)度值為57、MOL000358(β谷甾醇)度值為37、MOL000449(豆甾醇)度值為31,說明敗醬草在治療大腸癌時,槲皮素、山柰酚等成分起關鍵作用。同時,PTGS 2(前列腺素內過氧化物合成酶2)度值為10、NCOA2(核受體共激活劑2)度值為8,TOP2A(DNA拓撲異構酶2A)度值為7,AR(雄激素受體)度值為7,說明敗醬草一個成分對應多個靶點,一個靶點對應多個成分,體現了敗醬草多組分、多靶點治療大腸癌的特點。

圖2 敗醬草成分-靶點網絡
2.4 構建蛋白互作網絡STRING數據庫構建的蛋白互作網絡中,含有33個蛋白質節點,其中F7為游離節點不參與蛋白互作,共140條邊,平均節點度值8.48。將網絡導入Cytoscape3.8.0軟件進行可視化分析,紅色圓圈代表蛋白質節點,圓圈越大說明度值越大,也就是與其相互作用的蛋白質越多。根據網絡拓撲學參數,共篩選出14個蛋白,敗醬草靶點中TP53(腫瘤P53蛋白,度值25)、AKT1(絲氨酸/蘇氨酸蛋白激酶,度值19)、CASP3(半胱氨酸蛋白酶,度值16)、CCND1(G1/S特異性細胞周期蛋白D1,度值16)、VEGFA(血管內皮生長因子,度值15)、PTEN(磷脂酰肌醇-3,4,5-三磷酸3-磷酸酶和雙特異性蛋白磷酸酶PTEN,度值15)、MYC(MYC原癌基因蛋白度,值15)等蛋白質間連線密集,說明敗醬草在治療大腸癌,這些蛋白相互作用較為密切,是關鍵蛋白,見圖3。

圖3 蛋白互作網絡
2.5 敗醬草GO功能分析根據lgP值篩選的得到的前20條生物過程,顯示敗醬草的生物過程主要有對雌二醇應答、細胞對藥物應答、上皮細胞增殖、凋亡信號通路、細胞增殖的負調控、蛋白質絲氨酸/蘇氨酸激酶活性的調節、DNA結合轉錄因子活性的調節、細胞分化的負調控、凋亡過程中半胱氨酸型內肽酶活性的調節等,見圖4。其細胞組分表示其作用部位可能在細胞內細胞器腔、膜筏、核染色體、細胞質等。
2.6 KEGG富集分析結果KEGG的分析結果中,經lgP值篩選后,富集信號主要集中在癌癥通路、乙肝、癌癥中的p53信號通路、流體剪切應力與動脈粥樣硬化、TNF信號通路、FoxO信號通路等,見圖5。涉及基因數目最多的前10條通路為Pathways in cancer癌癥的途徑、Hepatitis B(乙型肝炎)、MicroRNAs in cancer(癌癥中的微小RNA)、Proteoglycans in cancer(癌癥中的蛋白聚糖)、HTLV-I infection(HTLV-I感染)、PI3K-Akt signaling pathway(PI3K-Akt信號傳導途徑)、Prostate cancer(前列腺癌)、Pancreatic cancer(胰腺癌)、Endocrine resistance(內分泌抵抗力)、Breast cancer(乳腺癌),與各種惡性腫瘤通路相關密切,見表2。
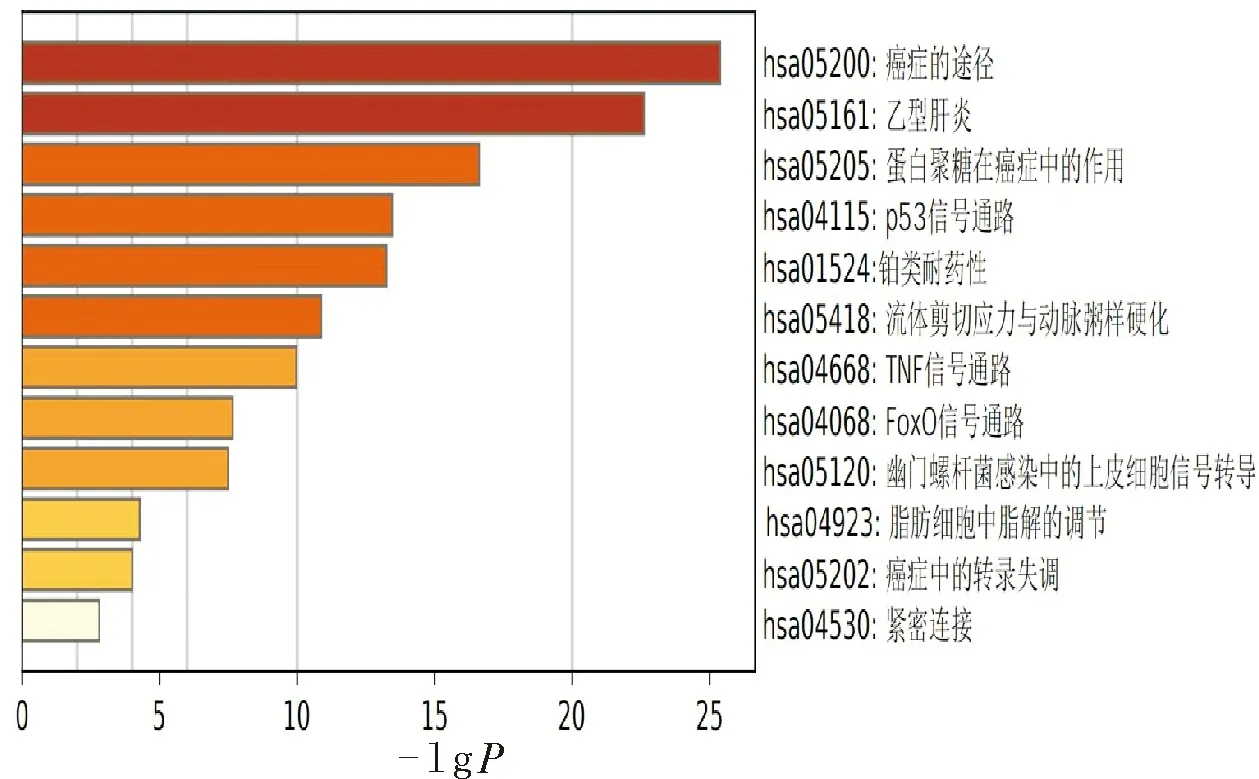
圖5 敗醬草KEGG富集分析

表2 靶點富集較多的通路
3 討論
結直腸癌是常見的惡性腫瘤之一,據數據統計顯示[9],低收入國家和中等收入的國家發病率較發達國家增長趨勢更明顯,城市發病率比農村高,東部地區比西部地區高,男性比女性高。研究顯示[10],結直腸癌發病率的上升速度與社會經濟的發展密切相關,人類發展指數升高,疾病的發病率也隨之升高。研究表明,敗醬草含有氨基酸、蛋白質、酚類、黃酮類、香豆素、皂苷等等多種活性成分[11],其對多種腫瘤細胞有抑制增殖、誘導凋亡的作用,如人肝癌細胞(HepG2)、人乳腺癌(MCF7)、宮頸癌細胞(U14)、人宮頸癌Hela細胞[12-14]。劉洋成[15]發現,白花敗醬草可促進HepG2、A549細胞凋亡,與濃度成正比,且能損傷人非小細胞肺癌細胞(A549)的DNA染色體、誘導其停滯于細胞周期的G2/M期。沈德鳳等[16]發現,黃花敗醬草總苷水提取物可抑制荷瘤小鼠的腫瘤生長。鄭昌杰[17]發現,黃花敗醬提取物能促進大鼠腸道蠕動,且其對減輕小鼠疼痛有良好的效果,還可減輕腸道的炎癥環境[18]。騰陽等[19]用敗醬草合劑聯合電針治療潰瘍性結腸炎有改善作用。毛俊琴等[20]發現,敗醬草中的環烯醚萜苷元可抑制小鼠的腫瘤細胞株增殖。孫燕[21]發現,敗醬草能抑制HEPAL-6細胞的增殖。錢彩云等[22]發現,敗醬草聯合救必應可緩解DNA甲基化導致的結腸炎癥相關性腸癌。根據“成分-靶點”網絡圖顯示,槲皮素、山柰酚、木犀草素、β谷甾醇、豆甾醇等成分可作用多個藥物靶點。藥理研究已證明[23],黃酮、黃酮醇類化合物能通過調控自噬相關基因達到殺傷癌細胞的作用,如槲皮素主要通過抑制 COX-2的表達、抑制C(PKC)的活性、誘導癌細胞分化來發揮抗癌作用[24-25];山柰酚則通過影響癌細胞周期、抑制癌細胞增殖、激活細胞表面凋亡受體誘導細胞凋亡[26-27];木犀草素主要能抑制結直腸癌細胞的增殖[28]。化合物靶點中的TP53是人體的抑癌基因之一,在DNA損傷或癌基因表達時被激活,通過誘導細胞周期的阻滯、損傷的修復及細胞凋亡的過程,從而維持基因組的穩定與機體的穩態[29]。AKT1是ATK家族一個重要的亞型,能抑制上皮癌的侵襲和轉移。CCND1是一種調節細胞周期的蛋白,基因此沉默可以阻滯G1-S的細胞周期進程,削弱癌細胞增殖,并促進癌細胞凋亡[30]。PTEN的抑癌主要通過去磷酸化細胞質膜上的脂質分子PIP3,從而拮抗P13K-AKT通路,抑制細胞生長、増殖,促進細胞調亡,達到抑癌[31]。MYC是人體中可將成纖維細胞誘導為干細胞的轉錄因子之一,與VEGFA啟動子結合,促進VEGFA產生并隨后萌發血管生成,與腫瘤干細胞有密切關系[32]。
本研究發現,敗醬草對大腸癌的活性成分主要是黃酮類,如槲皮素、木犀草素、山柰酚等,且這些成分能作用于多個疾病靶點,但此文只對符合藥動學參數的成分進行了分析,對某些敗醬草中有確切治療意義,卻不符合篩選條件的成分可能有遺漏,需要進一步的研究。

