大黃素調控NF-κB信號通路抗缺氧缺糖/復氧復糖誘導的PC12細胞損傷
劉炳園 羅婷婷 劉柳芳
心腦血管疾病已經成為威脅中老年人生命健康的重要原因,其中腦缺血再灌注損傷最為常見[1]。腦缺血再灌注損傷是由多種因素引起的,包括氧化應激、細胞凋亡等[2]。細胞內過量的氧自由基可以激活Caspase凋亡反應,促進細胞凋亡發生[3]。大黃素主要來源于蓼科植物掌葉大黃根莖,其是大黃的主要活性成份,大黃素屬于蒽醌類衍生物,傳統中醫認為大黃素具有抗菌、消炎、保肝、抗腫瘤等功效[4]。大黃素還具有抗氧化功能,其可以清除機體內多余的氧自由基,促進氧化平衡[5]。以前的研究顯示,大黃素處理后的腦缺血再灌注損傷大鼠模型腦組織中細胞凋亡水平降低,腦梗死面積減小,大黃素還可以改善大鼠記憶功能[6]。大黃素抑制過氧化氫誘導的PC12細胞損傷[7]。現階段對于大黃素的作用機制還不明確,大黃素可以通過抑制核因子-κB(nuclear factor-κB,NF-κB)減輕巨噬細胞損傷和大鼠脊髓損傷[8,9]。本次實驗以明確大黃素對缺氧缺糖/復氧復糖PC12細胞氧化應激和細胞凋亡的影響和機制為目的,以期為大黃素治療腦缺血再灌注損傷提供理論資料。
1 材料與方法
1.1 材料 超氧化物歧化酶(SOD)含量檢測試劑盒(WST-8法)購自北京普利萊基因技術有限公司;PC12細胞購自上海弘順生物科技有限公司;谷胱甘肽(GSH)含量檢測試劑盒(比色法)購自上海通蔚生物有限公司;大黃素購自上海寶曼生物科技有限公司;CCK-8細胞活力檢測試劑盒購自大連美侖生物技術有限公司;乳酸脫氫酶(LDH)含量測定試劑盒(L-P法)購自上海嵐派生物科技有限公司;NF-κBp65抗體購自湖南艾佳生物科技股份有限公司;丙二醛(MDA)含量檢測試劑盒(TBA法)購自上海銘博生物科技有限公司;Cleaved Caspase-3抗體購自美國Abcam;活性氧(ROS)水平檢測試劑盒(DCFH-DA法)購自上海聯邁生物工程有限公司。
1.2 實驗分組處理方法
1.2.1 PC12細胞用含有10%胎牛血清的High-DMEM細胞培養液培養,培養條件設置為:37℃,5% CO2培養箱。缺氧缺糖/復氧復糖模型構建方法[10]為:將PC12細胞種植到96孔板中,細胞接種密度為6×104個/ml,48 h以后,在細胞中添加無糖Earles培養液體外模擬缺血,將細胞放在37℃含有5% CO2、1%O2、94%N2的培養箱中缺氧培養,缺氧缺糖培養3 h以后,將培養液更換成含有10%胎牛血清的High-DMEM細胞培養液,放在37℃,5% CO2培養箱中培養12 h。
1.2.2 PC12細胞分成Normal、Model、EMO-L、EMO-M、EMO-H組,處理方法如下:Model組為缺氧缺糖/復氧復糖模型細胞;EMO-L、EMO-M、EMO-H組細胞在缺氧缺糖/復氧復糖處理之前的24 h,以30、60、90 mmol/L的大黃素處理;Normal組細胞為空白對照。
1.3 CCK-8測定細胞活力 Normal、Model、EMO-L、EMO-M、EMO-H組按照上述處理方法缺氧缺糖/復氧復糖處理以后,在超凈工作臺中加入10 μl的CCK-8溶液,放在37℃繼續孵育3 h以后,用多功能酶標儀檢測各孔490 nm的OD值。OD值代表細胞活力。
1.4 LDH、MDA、SOD、GSH和ROS水平檢測 Normal、Model、EMO-L、EMO-M、EMO-H組按照上述處理方法缺氧缺糖/復氧復糖處理以后,收集細胞和培養液上清,LDH含量測定試劑盒(L-P法)檢測培養液上清中LDH含量,MDA含量檢測試劑盒(TBA法)檢測細胞中MDA水平,SOD含量檢測試劑盒(WST-8法)檢測細胞中SOD活性,GSH含量檢測試劑盒(比色法)檢測細胞中GSH活性,ROS水平檢測試劑盒(DCFH-DA法)檢測細胞中ROS水平,步驟均參照試劑盒說明書。
1.5 流式細胞術測定細胞凋亡 Normal、Model、EMO-L、EMO-M、EMO-H組按照上述處理方法缺氧缺糖/復氧復糖處理以后,收集細胞(每組收集106個細胞),添加PBS溶液反復洗滌細胞2次,最后將細胞懸浮在500 μl的結合緩沖液中,吸取5 μl的PI和Annexin V-FITC添加到細胞中,充分混合后,用流式細胞儀測定凋亡變化。
1.6 Western blot測定NF-κBp65、Cleaved Caspase-3蛋白表達 將RIPA同PMSF按照100∶1的比例混合,添加到 Normal、Model、EMO-L、EMO-M、EMO-H組細胞中,放在冰上裂解30 min,期間每隔5 min渦旋1次,在4℃,12 000 g條件下離心15 min。取2 μl的蛋白用BCA法測定蛋白濃度,剩余的蛋白中加入Loading Buffer混合煮沸5 min。將制好的濃縮膠和分離膠放入電泳槽中,添加蛋白電泳緩沖液,電泳參數設置為:濃縮膠70 V,30 min;分離膠90 V,2 h。PVDF膜裁剪成合適大小,以25 V電壓轉膜30 min。將PVDF膜放在提前配置好的5%牛血清白蛋白溶液中,在室溫孵育2 h。PVDF膜經過TBST洗滌以后,置于一抗溶液中,在4℃孵育過夜。TBST再次洗滌PVDF膜,放入二抗溶液中,在室溫中反應2 h。ECL發光。Image J分析灰度值。GAPDH作為內參,分析各目的蛋白表達水平。
1.7 NF-κB信號激活劑對大黃素影響缺氧缺糖/復氧復糖PC12細胞損傷作用檢測 PC12細胞用含有60 mmol/L的大黃素和20 ng/ml的NF-κB信號激活劑TNF-α共同處理24 h,然后給予缺氧缺糖/復氧復糖處置,記為EMO-M+TNF-α組,以EMO-M組作為參照,按照上述方法測定細胞活力(步驟同1.3)和LDH、MDA、SOD、GSH、ROS水平(步驟同1.4)、細胞凋亡(步驟同1.5)以及NF-κBp65、Cleaved Caspase-3蛋白水平(步驟同1.6)。

2 結果
2.1 大黃素對缺氧缺糖/復氧復糖PC12細胞OD值、LDH、MDA水平影響 與Normal組比較,Model組細胞OD值降低,LDH和MDA水平升高(P<0.05);與Model組比較,EMO-L、EMO-M、EMO-H組細胞OD值逐漸升高,LDH和MDA水平逐漸降低(P<0.05)。大黃素提高缺氧缺糖/復氧復糖PC12細胞活力,減少細胞損傷。見表1。
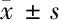
表1 大黃素處理后缺氧缺糖/復氧復糖PC12細胞OD值、LDH、MDA水平比較
2.2 大黃素對缺氧缺糖/復氧復糖PC12細胞SOD、GSH和ROS水平影響 與Normal組比較,Model組細胞SOD、GSH活性降低,ROS水平升高(P<0.05);與Model組比較,EMO-L、EMO-M、EMO-H組細胞SOD、GSH活性逐漸升高,ROS水平水平逐漸降低(P<0.05)。大黃素減少缺氧缺糖/復氧復糖PC12細胞中ROS水平,提高細胞中SOD、GSH活性。見表2。
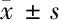
表2 大黃素處理后缺氧缺糖/復氧復糖PC12細胞中SOD、GSH和ROS水平比較
2.3 大黃素對缺氧缺糖/復氧復糖PC12細胞凋亡和Cleaved Caspase-3蛋白表達影響 與Normal組比較,Model組細胞凋亡率和Cleaved Caspase-3蛋白水平升高(P<0.05);與Model組比較,EMO-L、EMO-M、EMO-H組細胞凋亡率和Cleaved Caspase-3蛋白水平逐漸降低(P<0.05)。大黃素減少缺氧缺糖/復氧復糖PC12細胞凋亡。見圖1,表3。
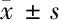
表3 大黃素處理后缺氧缺糖/復氧復糖PC12細胞凋亡率和Cleaved Caspase-3蛋白水平比較

圖1 大黃素對缺氧缺糖/復氧復糖PC12細胞凋亡和Cleaved Caspase-3蛋白表達影響;A 流式細胞術測定PC12細胞凋亡;B Western blot測定Cleaved Caspase-3蛋白表達
2.4 大黃素對缺氧缺糖/復氧復糖PC12細胞NF-κBp65蛋白表達影響 與Normal組比較,Model組細胞NF-κBp65蛋白水平升高(P<0.05);與Model組比較,EMO-L、EMO-M、EMO-H組細胞NF-κBp65蛋白水平逐漸降低(P<0.05)。大黃素減少缺氧缺糖/復氧復糖PC12細胞中NF-κBp65蛋白表達。見圖2,表4。
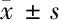
表4 大黃素處理后缺氧缺糖/復氧復糖PC12細胞NF-κBp65蛋白水平比較

圖2 Western blot測定大黃素對缺氧缺糖/復氧復糖PC12細胞中NF-κBp65蛋白表達影響
2.5 NF-κB激活劑對大黃素抗缺氧缺糖/復氧復糖PC12細胞損傷的影響 與EMO-M組比較,EMO-M+TNF-α組PC12細胞OD值降低,LDH、MDA、ROS水平升高,SOD、GSH活性下降,細胞凋亡率和NF-κBp65、Cleaved Caspase-3蛋白水平升高(P<0.05)。NF-κB激活劑逆轉大黃素抗缺氧缺糖/復氧復糖PC12細胞損傷作用。見圖3,表5。
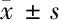
表5 大黃素和NF-κB激活劑TNF-α聯合處理后缺氧缺糖/復氧復糖PC12細胞OD 值、LDH、MDA、SOD、GSH、ROS、凋亡率和NF-κBp65、Cleaved Caspase-3蛋白水平比較

圖3 大黃素和NF-κB激活劑TNF-α聯合處理對缺氧缺糖/復氧復糖PC12細胞凋亡和NF-κBp65、Cleaved Caspase-3蛋白表達影響;A 流式細胞術測定細胞凋亡;B Western blot測定NF-κBp65、Cleaved Caspase-3蛋白表達
3 討論
研究報道顯示,缺氧缺糖/復氧復糖可以體外誘導神經細胞氧化損傷,降低細胞活力,促進細胞凋亡[11]。細胞在受到外界因素刺激以后,細胞中的抗氧化酶活性降低,使得存在于細胞內的ROS不能被及時降解而聚集在細胞內,過量的ROS可以將脂質過氧化,造成細胞膜損傷,使得原本存在于細胞內的LDH釋放至細胞外[12]。MDA是脂質發生過氧化的產物[13]。SOD、GSH是存在于機體內的抗氧化酶[14]。氧化應激可以誘導細胞凋亡發生,過量的氧自由基可以激活存在于細胞內的Caspase蛋白成員,誘導細胞凋亡發生[15]。Caspase是與細胞凋亡關系密切的促凋亡因子,其在正常情況下以沒有活性的酶原形式存在,只有被激活后才可以誘導細胞凋亡[16]。Caspase-3是細胞凋亡的執行因子,其活化后能夠形成Cleaved Caspase-3,激活細胞凋亡[17]。本次實驗表明,缺氧缺糖/復氧復糖處理后的PC12細胞活性下降,LDH和MDA水平升高,SOD、GSH活性降低,ROS水平升高,細胞凋亡和Cleaved Caspase-3蛋白表達水平升高,缺氧缺糖/復氧復糖誘導PC12細胞氧化損傷,促進細胞凋亡發生,說明成功構建了缺氧缺糖/復氧復糖PC12細胞損傷模型。
大黃素具有多種藥理學作用,具有抑制組織炎癥、清除氧自由基、殺菌等功效[5,8]。以前的研究報道顯示,大黃素對于心腦血管疾病具有明顯的改善作用[18]。大黃素能夠減少心肌缺血再灌注大鼠心肌細胞凋亡,減少氧化應激[19]。腦缺血再灌注大鼠模型經過大黃素治療以后,大鼠腦組織中Cleaved Caspase-3蛋白表達減少,細胞凋亡減少[20]。過氧化氫條件下的PC12細胞經過大黃素處理以后,細胞中ROS水平下降,細胞活性增加[21]。本次實驗顯示,大黃素可以減少缺氧缺糖/復氧復糖PC12細胞中ROS水平,提高細胞SOD、GSH活性和細胞活力,減少細胞凋亡,提示大黃素具有抗缺氧缺糖/復氧復糖PC12細胞氧化損傷,減少細胞凋亡的作用,這與上述研究結果相一致,提示大黃素具有保護缺氧缺糖/復氧復糖PC12細胞損傷作用。
NF-κB是一個與細胞凋亡、氧化平衡維持等有關的信號轉導通路,其在缺血再灌注損傷中過度激活[22]。NF-κBp65是NF-κB發揮作用的必需亞單位[23]。研究報道顯示,大黃素作用機制與NF-κB有關,其可以下調組織中NF-κBp65蛋白表達而發揮抗氧化損傷作用[24]。本次實驗顯示,大黃素處理后的缺氧缺糖/復氧復糖PC12細胞中NF-κBp65蛋白表達減少,并且NF-κB信號激活劑可以逆轉大黃素對缺氧缺糖/復氧復糖PC12細胞損傷保護作用,說明大黃素作用機制與下調NF-κB信號激活程度有關。
總而言之,大黃素可能具有抗腦缺血再灌注損傷的作用,其可以抑制缺氧缺糖/復氧復糖PC12細胞氧化損傷,減少細胞凋亡,作用機制與下調NF-κB信號通路的激活水平有關。本次實驗為研究大黃素在腦缺血再灌注損傷中的作用機制提供了參考,為大黃素治療腦缺血再灌注損傷提供了理論支持。

