血糖波動對2型糖尿病大鼠認知功能的影響
李 志 張 郡 戴悅萱 秦明陽 梁芙茹
(1. 內蒙古醫科大學包頭臨床醫學院,呼和浩特 010000; 2. 包頭市中心醫院神經內科,內蒙古包頭 014040; 3.鞍山市長大醫院神經內科,遼寧鞍山 114000;4.中國醫學科學院北京協和醫院神經內科,北京 100730; 5. 內蒙古呼倫貝爾第二人民醫院內二科, 內蒙古扎蘭屯 162650)
隨著糖尿病患病率的逐年遞增,糖尿病所導致的認知功能障礙日益受到廣泛重視。流行病學研究[1]已證實,2型糖尿病(type 2 diabetes mellitus, T2DM)與阿爾茨海默病(Alzheimer’s disease, AD)之間存在病理生理聯系。國際糖尿病聯盟2007年發布的《餐后血糖管理指南》[2]中曾明確指出波動性高血糖產生的危害遠高于慢性持續性高血糖,且血糖波動幅度越大,慢性并發癥的發病率越高,預后也越差。臨床研究[3]顯示,T2DM患者的認知功能與急性血糖波動有明顯的相關性。糖尿病患者日常生活中不可避免地存在異常的血糖波動,研究波動性高血糖影響認知功能的可能機制,探索新的治療靶點,對預防和治療糖尿病認知功能障礙具有重大的意義。
氧化應激損傷是機體或細胞內以氧自由基為代表的氧化性物質產生與消除的一種失平衡狀態。臨床試驗[4]顯示:與持續高血糖相比,糖尿病患者血糖波動更顯著增加氧化應激產物的生成,提示異常的血糖波動與氧化應激密切相關。關于血糖波動與氧化應激損傷的研究不多,主要集中于體外細胞培養:與持續高血糖環境相比,人臍靜脈內皮細胞培養在血糖波動環境中時,線粒體產生更多的活性氧簇[5],細胞外環境中的葡萄糖濃度上下波動比持續高糖濃度對細胞的危害更大,導致氧化應激產物過度生成,繼而引發細胞凋亡增加[6]。但糖尿病患者血糖波動所致的認知功能下降是否與體內氧化應激損傷相關,其具體機制尚未在動物模型體內實驗中驗證。由此本課題組建立了糖尿病血糖波動模型,觀察認知功能改變情況,并檢測其海馬氧化應激指標——丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)的活性,研究血糖波動是否導致認知下降,是否與氧化應激相關聯,為糖尿病合并認知功能障礙的防治提供一定的實驗依據。
1 材料與方法
1.1 實驗動物
36只Wistar大鼠:健康、雄性,體質量90~130 g,4~6周,由內蒙古大學動物中心提供[實驗動物使用許可證號:SCXK(蒙)2016-0001]。
1.2 2型糖尿病大鼠模型的制備
在溫度為22 ℃±2 ℃,相對濕度為50%~60%的環境中適應性喂養1周。將36只大鼠采用簡單隨機化分組法分為對照組(C組,n=10)及2型糖尿病組(T2DM組,n=26)。C組以維持飼料喂養,T2DM組以高糖高脂飼料喂養(豬油12%,糖10%,奶粉6%,雞蛋5%,油炸花生5%,鹽1%和麻油1%)。T2DM組高糖高脂飼料喂養6周后,過夜禁食不禁水15 h,用現配的檸檬酸緩沖液溶解鏈脲菌素(streptozotocin,STZ)粉末,配成質量分數為1%(質量分數)的STZ溶液,按30 mg/kg的劑量通過腹腔注射誘導2型糖尿病。1周后,禁食不禁水16 h,隨機測定兩次非同日空腹血糖,血糖濃度≥16.7 mmol/L的24只大鼠視為糖尿病模型成功[7],成功率為92.3%。
1.3 建立反復餐后血糖波動的糖尿病大鼠模型
選取造模成功的糖尿病大鼠24只,采用簡單隨機化分組法分為持續高糖組(sustained hyperglycemia group,SHG,n=12)和血糖波動組(intermittent hyperglycemia group,IG,n=12)。將所有大鼠均建立12 h的反向光/暗周期(暗:7:00~19:00;光:19:00~7:00),并對C組繼續以維持飼料不計時不計量喂養,SHG組繼續以高糖高脂飼料不計時不計量喂養,對IG組大鼠的進食時間進行限制,每個時間段1 h,每天兩個時間段(分別為9:00~10:00和15:00~16:00[8]),造成人為的餐后血糖波動模式。
1.4 指標觀察及檢測方法
1.4.1 各組大鼠日內9次血糖濃度及量化血糖穩定性指標檢測
血糖波動成模6周后,每周1次,測1 d內8時~12時、15時~18時中9個整點的血糖值,并繪制血糖變化趨勢曲線。用日內血糖波動評估參數——血糖日平均水平(mean blood glucose,MBG)、日平均血糖的標準差(standard deviation of daily average blood glucose, SDBG)、最大血糖波動幅度(largest amplitude of glycemic excursions, LAGE)量化各組大鼠血糖穩定性,并采用廣大學者公認的血糖波動金標準——平均血糖波動幅度(mean amplitude of glycemic excursion, MAGE)作為重要的血糖波動衡量參數,因其并非某個時間點或某個時間段的血糖數據的統計學離散特征,而是反映一天整個觀察時段的血糖波動情況。根據MAGE的原始定義,通過比較篩選數據的人工計算方法進行參數值計算。具體計算方法如下:
(1)繪制血糖數據曲線。利用EXCEL將日內所有血糖數據點繪制成血糖曲線,便于后續觀察篩選血糖波動數據點。
(2)計算日內所有血糖數據點的標準差(SDBG),作為血糖數據篩選的參考值。
(3)在血糖數據曲線圖中,標記出所有的峰谷血糖值點(即極值點)。
(4)從始到末,觀察并記錄連續兩個相鄰極值點的差是否均大于1個SDBG,若是則記錄為一個有效血糖波動,重復此步驟,直到觀察完所有的極值點。
(5)統計(4)中有效血糖波動的個數,根據第一個有效波動的方向(從波谷到波峰或從波峰到波谷)計算MAGE。計算公式如下:
式中,AGEi(i=1…n)(amplitude of glycemic excursions, AGE)表示根據第一個有效波動的方向(從波谷到波峰或從波峰到波谷)的所有有效血糖波動的波動幅度,n表示有效血糖波動個數[9]。
1.4.2 Morris 水迷宮實驗
血糖波動第10周進行Morris水迷宮實驗,每只動物每天訓練4次,共訓練4 d。將各組大鼠分別于相同時間段放入水中,測定大鼠對水迷宮學習和記憶的能力,并用攝像頭記錄結果。(1)定位航行試驗:前4天,每天將大鼠面向池壁依次從4個象限的中點放入水中,并記錄其120 s內尋找到隱藏在水面下平臺的時間——逃避潛伏期(escape latency),且每次訓練間隔60 s以上,記錄并比較各組第4天的逃避潛伏期。(2)空間探索實驗(spatial probe test):第5天任選1個入水點(本實驗采用平臺對面的象限中點為入水點),將大鼠放入水池中,并記錄大鼠在120 s內的游泳軌跡,考察大鼠對原平臺的記憶能力。
1.4.3 海馬區氧化應激指標 MDA、SOD、GSH-Px的測定
于血糖波動成模后第11周,從各組中隨機選取6只,斷頭法處死大鼠,取海馬組織,并用鑷子在冰冷的0.9%(質量分數)氯化鈉注射液(以下簡稱生理鹽水)中漂洗,除去血液,濾紙擦干,稱其質量。取雙側海馬組織按質量體積比1∶9加入預冷的勻漿介質[0.86%(質量分數)的氯化鈉注射液],用超聲波細胞粉碎機破碎組織,將制備好的10%(質量分數)的勻漿用4 ℃低溫離心機3 000 r/min離心12 min,用移液器吸出上清液,轉移至1.5 mL離心管中,測定各組上清液中MDA、SOD、GSH-Px濃度。
1.5 統計學方法
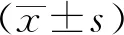
2 結果
2.1 血糖波動6周后各組大鼠日內血糖變化及血糖波動參數
與對照組相比,T2DM組(IG組和SHG組)血糖明顯增高,且IG組比SHG組血糖波動范圍大,IG組SDBG、LAGE、MAGE高于SHG組,差異有統計學意義(P<0.05),MBG低于SHG組,詳見表1。其中,IG組血糖值在10:00和11:00較高,然后呈現出下降趨勢至15:00,之后血糖持續上升至17:00左右達到高峰(圖1)。

表1 血糖波動6周后各組大鼠MBG、SDBG、LAGE、MAGE比較

圖1 血糖波動 6 周后各組大鼠日內血糖變化趨勢圖
2.2 各組大鼠學習記憶能力情況
血糖波動第10周時,通過Morris水迷宮實驗檢測發現,T2DM組大鼠第4天的潛伏期長于對照組(P<0.05)。與SHG組相比,IG組第4天的潛伏期呈現延長的趨勢,但差異無統計學意義(P>0.05),詳見表2。與C組相比,T2DM組大鼠第5天的穿越平臺次數、經過目標象限(定位航行實驗中平臺所在象限)的活動路程比(經過目標象限路程與運動總路程的比值)和活動時間比(經過目標象限時間與運動總時間的比值)均減少(P<0.05)。IG組與SHG組相比,第5天穿越平臺次數、經過目標象限的活動路程比與活動時間比均進一步降低(P<0.05)。C組大鼠與T2DM大鼠上臺前游動距離和平均速度之間的差異無統計學意義(P>0.05),詳見表3。

表2 Morris 水迷宮測試大鼠逃避潛伏期
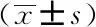
表3 Morris水迷宮實驗大鼠空間探索數據
2.3 各組大鼠海馬組織氧化應激指標的測定
與C組相比,T2DM大鼠MDA升高(P<0.05),SOD、GSH-Px降低(P<0.05)。與SHG組相比,IG組大鼠MDA升高(P<0.05),SOD及GSH-Px降低(P<0.05)(表4)。
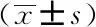
表4 大鼠海馬組織內MDA、SOD及GSH-Px測定
2.4 氧化應激指標與學習記憶能力的相關性
采用Pearson相關分析分別評價MDA、GSH-Px、SOD與3組大鼠(n=18)活動路程比、活動時間比的關系,結果顯示:MDA與大鼠活動路程比、活動時間比呈負相關;GSH-Px、SOD與大鼠活動路程比、活動時間比呈正相關。采用Spearman相關分析分別評價MDA、GSH-Px、SOD與大鼠穿越平臺次數的關系,結果顯示MDA與大鼠穿越平臺次數呈負相關;GSH-Px、SOD與大鼠穿越平臺次數呈正相關,詳見表5。

表5 氧化應激指標與大鼠活動路程比、活動時間比及穿越平臺次數的相關性
3 討論
文獻[10]報道,制備糖尿病大鼠模型的方法有單純腹腔注射大劑量的STZ(50~70 mg/kg)和高糖高脂飲食(4~8周)聯合小劑量STZ(30~50 mg/kg)兩種。后一種方法制備的動物模型類似2型糖尿病特點,如高糖高脂飲食會誘導胰島素抵抗,同時低劑量的STZ誘導胰島素分泌輕度損傷,這是T2DM后期的特征[11]。研究[12]顯示,高糖高脂飼料誘導時間過短或者STZ劑量過小都不容易誘導糖尿病模型的建立,而且STZ誘導成功后如果停止高糖高脂飼料的喂養,空腹血糖會在一周內又恢復到正常濃度。本試驗選擇高脂高糖飼料喂養聯合單次注射STZ(30 mg/kg)造成血糖相對較低的2型糖尿病模型,以注射后7 d后,測非同日2次隨機血糖濃度≥16.7 mmol/L作為糖尿病大鼠模型成功的標準[7],成模率為92.3%。
關于血糖波動模型的建立,有文獻[13]報道通過給予T2DM組大鼠皮下注射胰島素,人為造成血糖波動狀態。但有研究[14]報道經鼻胰島素的短期治療可以改善早期阿爾茨海默病特征性的病理沉積,從而改善認知功能,如若采用外源性胰島素來制造血糖波動模型,很可能人為影響大鼠的認知功能,無法對大鼠認知改變情況進行客觀評判。國外有報道[8]通過改變大鼠日常飲食習慣和生物節律的方式來模擬糖尿病患者隨進食而產生的血糖波動狀態,由此本實驗采用該方法造成血糖波動狀態,避免了外源性胰島素對T2DM大鼠認知水平可能造成的影響,從而能夠客觀體現血糖波動對T2DM大鼠認知功能的影響。在諸多血糖波動的評估參數中,MBG、SDBG、LAGE能夠比較直觀地反映血糖波動性,是主要體現血糖離散特征的衡量指標。而富有代表性的MAGE最早于2006年提出,它反映的血糖波動狀況具有其獨特優勢,是反映日內血糖波動的“金標準”。本實驗通過檢測日內9個整點的血糖值,得到日內MBG、SDBG、LAGE等量化指標來評價血糖的穩定性。實驗顯示,IG組大鼠SDBG、LAGE、MAGE高于SHG組,MBG低于SHG組。通過以上結果證實:改變大鼠日常飲食習慣和生物節律可以成功建立血糖波動模型,能夠有效地模擬臨床糖尿病患者的血糖波動狀況。
Morris水迷宮主要測試實驗動物對空間位置感和方向感(空間定位)的學習記憶能力,用于檢測動物的認知功能。本研究通過Morris水迷宮實驗發現,與C組相比,T2DM大鼠第4天逃避潛伏期延長,第5天穿越平臺次數、經過目標象限活動路程比和活動時間比減少,提示T2DM組大鼠存在學習記憶障礙。最近研究[15]顯示,T2DM可以累及中樞神經系統,進而導致認知功能損害,其機制可能與氧化應激、胰島素抵抗、腦血管病變、糖、能量代謝受損以及突觸的可塑性有關[16]。而且本研究顯示,IG組與SHG組相比,上述檢測指標均有顯著變化,表明血糖波動更易導致T2DM大鼠認知功能受損。為闡明具體機制,筆者進而檢測了大鼠海馬組織的氧化應激指標。正常情況下,機體內抗氧化系統和氧化系統處于動態平衡,而氧化應激損傷是細胞或機體內氧化性物質產生與消除失衡的一種狀態。常用的檢測指標MDA不但是膜脂過氧化反應的總產物,而且是反映機體氧化損傷的指標。SOD和GSH-Px是主要的抗氧化酶,其中SOD是評價機體的抗氧化能力的經典指標,GSH-Px的作用是保護細胞膜結構和功能完整。本實驗顯示:T2DM大鼠較正常對照組海馬組織MDA升高,而SOD、GSH-Px明顯下降,同時血糖波動組比持續高糖組變化更明顯。T2DM是AD公認的危險因素之一,T2DM的外周胰島素抵抗與AD患者腦內的胰島素抵抗非常相似,而且研究[17]顯示,T2DM與氧化應激密切相關。本實驗驗證了T2DM與氧化應激密切相關,并且提示血糖波動比持續高血糖更易誘發氧化應激,表現為氧化應激損傷更明顯、抗氧化能力也隨之降低。而且最近也有類似報道[18],經靜脈短時間(48 h)灌注葡萄糖的大鼠,波動性高糖灌注組比持續高糖灌注組的血管內皮細胞產生更多的氧化應激產物。
本研究通過相關與回歸分析發現:大鼠海馬組織氧化應激指標MDA、GSH-Px和SOD與大鼠活動路程比、活動時間比及穿越平臺次數明顯相關。MDA與大鼠的活動路程比、活動時間比及穿越平臺次數均呈負相關,即大鼠的學習記憶能力隨著MDA的增加而降低;而抗氧化酶GSH-Px、SOD與大鼠的活動路程比、活動時間比及穿越平臺次數均呈正相關,即隨著GSH-Px、SOD的增加,大鼠學習記憶能力表現越好。進一步說明了T2DM引發的認知功能受損很可能與海馬組織氧化應激失衡密切相關。
上述研究結果表明,在高糖高脂飲食聯合腹腔注射小劑量的STZ(30 mg/kg)基礎上,通過改變大鼠飲食習慣及生物節律可以建立血糖波動模型;血糖波動比持續高血糖更易影響T2DM大鼠的認知功能;血糖波動會加劇海馬區氧化應激損傷,氧化應激損傷很可能是引起T2DM認知功能受損的重要發病機制之一。

