ICIs單用或聯(lián)合常規(guī)化療藥物用于NSCLC患者致非免疫相關(guān)不良事件的Meta分析
張清樹 陳瑞祥 溫瑾 夏從龍 何姣 趙倩


摘 要 目的:系統(tǒng)評價免疫檢查點抑制劑(ICIs)單用或聯(lián)合常規(guī)化療藥物用于非小細(xì)胞肺癌(NSCLC)患者致非免疫相關(guān)不良事件(irAEs)的發(fā)生情況,為臨床用藥提供循證參考。方法:計算機(jī)檢索PubMed、Cochrane 圖書館、Embase、中國知網(wǎng)、中國生物醫(yī)學(xué)文獻(xiàn)數(shù)據(jù)庫、維普網(wǎng)和萬方數(shù)據(jù)等,檢索時限均為建庫至2020年10月。收集ICIs單用或聯(lián)合常規(guī)化療藥物(試驗組)對比常規(guī)化療藥物或安慰劑聯(lián)合常規(guī)化療藥物(對照組)的隨機(jī)對照試驗(RCT)。篩選文獻(xiàn)、提取數(shù)據(jù)后,采用Cochrane系統(tǒng)評價員手冊5.1.0推薦的偏倚風(fēng)險評估工具對納入文獻(xiàn)質(zhì)量進(jìn)行評價,采用Rev Man 5.3和Stata 15.0軟件進(jìn)行Meta分析;采用Stata 15.0軟件進(jìn)行敏感性分析;采用倒漏斗圖和Eggers檢驗進(jìn)行發(fā)表偏倚分析。結(jié)果:共納入20項RCT,共計12 283例患者。Meta分析結(jié)果顯示,試驗組患者總體所有級別和總體重度AEs發(fā)生率、貧血發(fā)生率、中性粒細(xì)胞減少癥、嘔吐、脫發(fā)發(fā)生率以及所有級別血小板減少癥、惡心、周圍神經(jīng)病變發(fā)生率均顯著低于對照組(P<0.05);而兩組患者終止治療、死亡、重度血小板減少癥、重度惡心和重度周圍神經(jīng)病變發(fā)生率以及所有級別和重度腹瀉發(fā)生率比較,差異均無統(tǒng)計學(xué)意義(P>0.05)。亞組分析結(jié)果顯示,試驗組單用ICIs患者的總體所有級別和總體重度AEs發(fā)生率、貧血發(fā)生率、中性粒細(xì)胞減少癥發(fā)生率、血小板減少癥發(fā)生率、臨床相關(guān)癥狀發(fā)生率(除重度腹瀉外)以及終止治療發(fā)生率、死亡發(fā)生率均顯著低于對照組(P<0.05);而試驗組使用ICIs+化療患者的終止治療發(fā)生率、死亡發(fā)生率以及所有級別惡心、嘔吐、腹瀉、脫發(fā)和重度腹瀉發(fā)生率均顯著高于對照組(P<0.05)。敏感性分析支持上述結(jié)果;發(fā)表偏倚分析結(jié)果顯示,本研究存在發(fā)表偏倚的可能性較小。結(jié)論:對于NSCLC患者,ICIs在治療相關(guān)AEs、血液系統(tǒng)毒性和臨床相關(guān)癥狀方面的安全性優(yōu)于常規(guī)化療藥物或安慰劑聯(lián)合常規(guī)化療藥物;但當(dāng)其聯(lián)合常規(guī)化療藥物時,因AEs終止治療和死亡的風(fēng)險以及所有級別惡心、嘔吐、腹瀉、脫發(fā)及重度腹瀉的風(fēng)險將有所增加。
關(guān)鍵詞 非小細(xì)胞肺癌;免疫檢查點抑制劑;非免疫相關(guān)不良事件;安全性;Meta分析
ABSTRACT ? OBJECTIVE: To systematically evaluate the occurrence of non-immune related adverse events (AEs) caused by immune checkpoint inhibitors (ICIs) alone or combined with routine chemotherapy in the treatment of non-small cell lung cancer (NSCLC), and to provide evidence-based reference for clinical medication. METHODS: Retrieved from PubMed, Cochrane Library, Embase, CNKI, CBM, VIP and Wanfang database during the inception to Oct. 2020, randomized controlled trials (RCT) about ICIs alone or combined with routine chemotherapy (trial group) versus routine chemotherapy or placebo combined with routine chemotherapy (control group) were collected. After literature screening and data extraction, the quality of included literatures were evaluated with bias risk evaluation tool recommended by Cochrane systematic evaluator manual 5.1.0. Meta-analysis was performed by using Rev Man 5.3 software and Stata 15.0 software. Sensitivity analysis was conducted with Stata 15.0 software. Inverted funnel plot and Eggers test were used to analyze publication bias. RESULTS: A total of 20 RCTs were included, involving 12 283 patients. Results of Meta-analysis showed that the incidence of all grades and severe AEs, anemia, neutropenia, vomiting and alopecia as well as the incidence of thrombocytopenia, nausea and peripheral neuropathy in all grades of trial group were all significantly lower than control group (P<0.05). There was no statistical significance in the incidence of termination of treatment, death, severe thrombocytopenia, severe nausea and severe peripheral neuropathy or all grades and severe diarrhea between 2 groups (P>0.05). Subgroup analysis showed that the incidence of all grade and total severe AEs, the incidence of anemia, neutropenia, thrombocytopenia, clinically relevant symptoms (except for severe diarrhea), termination of treatment and death of patients receiving ICIs alone in trial group were significantly lower than control group (P<0.05). The incidence of ermination of treatment and death, the incidence of nausea, vomiting, diarrhea and alopecia in all grade, severe diarrhea of patients receiving ICIs and chemotherapy in trial group were all significantly higher than control group (P<0.05). Sensitivity analysis supported the above results. Analyze publication bias results showed that the possibility of publication bias in this study was small. CONCLUSIONS: For NSCLC patients, the safety of ICIs is better than that of routine chemotherapy or placebo combined with routine chemotherapy in the treatment-related AEs, hematologic toxicity and clinically relevant symptoms; however, the risks of treatment discontinuation, AEs-induced deaths, and all-grade nausea, vomiting, diarrhea, alopecia and severe diarrhea will be increased in the ICIs combined with routine chemotherapy.
KEYWORDS ? Non-small cell lung cancer; Immune checkpoint inhibitors; Non-immune related adverse events; Safety; Meta-analysis
肺癌是常見的惡性腫瘤之一,也是全球發(fā)病率和病死率最高的腫瘤[1]。非小細(xì)胞肺癌(NSCLC)是肺癌的一種類型,屬于一種異質(zhì)性腫瘤,包括腺癌、鱗癌和大細(xì)胞癌。NSCLC約占所有新診斷肺癌患者的85%,由于篩查計劃不足和臨床癥狀出現(xiàn)較晚,患者確診時大多已為晚期,失去了手術(shù)治療的機(jī)會,以致其預(yù)后較差[2-3]。NSCLC的常規(guī)治療主要為手術(shù)切除和以鉑類藥物為主的化療、放療和靶向治療[4-5]。雖然,NSCLC的臨床治療已取得了巨大的進(jìn)展,但獲得性耐藥的發(fā)生導(dǎo)致了患者復(fù)發(fā)率高、總生存率低,最終預(yù)后不良[6]。
隨著免疫療法的迅速發(fā)展,免疫檢查點抑制劑(ICIs)在NSCLC患者免疫系統(tǒng)調(diào)節(jié)和免疫治療中取得了較大突破,包括程序性死亡蛋白1(PD-1)、程序性死亡蛋白配體1(PD-L1)和細(xì)胞毒性T淋巴細(xì)胞相關(guān)抗原4(CTLA-4)在內(nèi)的ICIs已在臨床實踐中被證實可通過調(diào)節(jié)T細(xì)胞介導(dǎo)的免疫反應(yīng)來清除晚期/難治性和轉(zhuǎn)移性NSCLC患者體內(nèi)的腫瘤細(xì)胞,延長了NSCLC患者的無進(jìn)展生存期和總生存期,極大地改善了患者預(yù)后,顯示出顯著的抗腫瘤效果,甚至有望在一線治療中成為有效的治療選擇[5,7]。但在臨床試驗中發(fā)現(xiàn),與化療或分子靶向治療不同,ICIs可引發(fā)嚴(yán)重的不良事件(AEs)——免疫相關(guān)不良事件(irAEs),其臨床表現(xiàn)為涉及多個器官和組織的自身免疫樣反應(yīng)和炎癥反應(yīng),包括皮膚、胃腸道、肝臟、胰腺、內(nèi)分泌系統(tǒng)、肺臟、腎臟、眼睛、神經(jīng)系統(tǒng)、心血管系統(tǒng)、肌肉骨骼等[5,7-8]。然而,常見的化療毒性,如惡心、嘔吐、腹瀉、脫發(fā)和血液系統(tǒng)不良反應(yīng)等傳統(tǒng)化療相關(guān)的AEs(即非irAEs)也在使用ICIs的患者中被發(fā)現(xiàn),嚴(yán)重影響了患者的生存質(zhì)量,臨床應(yīng)予以重視[9]。既往研究和Meta分析大多集中在ICIs引起的irAEs[10-11],而非irAEs的發(fā)生以及ICIs是否會增加非irAEs發(fā)生風(fēng)險的研究較少。雖然,既往有研究分析了ICIs引起的非irAEs,但研究樣本量較小,結(jié)論存在爭議[9],且缺乏相關(guān)的系統(tǒng)評價。基于此,本研究采用Meta分析的方法比較了ICIs單用或聯(lián)合常規(guī)化療藥物用于NSCLC患者致非irAEs的發(fā)生情況,旨在為臨床使用ICIs的安全性提供循證參考。
1 資料與方法
1.1 納入與排除標(biāo)準(zhǔn)
1.1.1 研究類型 國內(nèi)外公開發(fā)表的Ⅱ或Ⅲ期雙臂隨機(jī)對照試驗(RCT)。語種限定為中文和英文。
1.1.2 研究對象 經(jīng)病理證實為NSCLC,腫瘤分期不限;年齡大于18歲;地區(qū)、種族和性別不限。
1.1.3 干預(yù)措施 對照組患者給予常規(guī)化療藥物或安慰劑聯(lián)合常規(guī)化療藥物;試驗組患者單用ICIs或ICIs聯(lián)合常規(guī)化療藥物。兩組患者的用藥劑量、療程均不限。
1.1.4 結(jié)局指標(biāo) ①治療相關(guān)AEs發(fā)生率,包括總體所有級別和總體重度AEs、終止治療、死亡發(fā)生率(該項所有指標(biāo)均包含了因治療產(chǎn)生的AEs,即irAEs和非irAEs);②血液系統(tǒng)AEs發(fā)生率,包括所有級別和重度貧血、中性粒細(xì)胞減少癥、血小板減少癥發(fā)生率;③臨床相關(guān)癥狀發(fā)生率,包括所有級別和重度惡心、嘔吐、腹瀉、脫發(fā)、周圍神經(jīng)病變發(fā)生率(②③均為非irAEs)。AEs嚴(yán)重程度按美國國家癌癥研究所AEs通用術(shù)語標(biāo)準(zhǔn)(CTCAE4.0版)進(jìn)行分級,≥3級為重度AEs [12]。
1.1.5 排除標(biāo)準(zhǔn) ①綜述、評論、會議論文和生存質(zhì)量研究;②無本研究納入的任何一項結(jié)局指標(biāo)的研究或無法獲取全文的文獻(xiàn)。
1.2 文獻(xiàn)檢索策略
計算機(jī)檢索PubMed、Cochrane圖書館、Embase、中國知網(wǎng)、中國生物醫(yī)學(xué)文獻(xiàn)數(shù)據(jù)庫、維普網(wǎng)和萬方數(shù)據(jù)等。英文檢索詞為“NSCLC”“immunotherapy”“PD-1”“PD-l1”“CTLA-4”“immune checkpoint blockade”“pembrolizumab”“nivolumab”“atezolizumab”“durvalu- mab”“ipilimumab”“toripalimab”“camrelizumab”“cemiplimab”“sintilimab”“avelumab”“tremlimumab”;中文檢索詞為“非小細(xì)胞肺癌”“免疫療法”“免疫檢查點抑制劑”“帕博利珠單抗”“納武單抗” “阿特珠單抗”“阿維單抗”“度伐利尤單抗”“伊匹木單抗”“特瑞普利單抗”“卡瑞利珠單抗”“西米普利單抗”“信迪利單抗”“西木單抗”。采用主題詞與檢索詞相結(jié)合的方式檢索,檢索時限均為各數(shù)據(jù)庫建庫起至2020年10月。
1.3 文獻(xiàn)篩選與數(shù)據(jù)提取
由2名研究者獨立篩選文獻(xiàn)并交叉核對,如遇分歧,雙方進(jìn)行協(xié)商并請求第3位研究者裁定。提取信息包括第一作者、發(fā)表年份、臨床試驗分期、患者例數(shù)、干預(yù)措施、ICIs類型、臨床治療線數(shù)和結(jié)局指標(biāo)等。
1.4 文獻(xiàn)質(zhì)量評價
采用Cochrane系統(tǒng)評價員手冊5.1.0推薦的偏倚風(fēng)險評估工具對納入文獻(xiàn)質(zhì)量進(jìn)行評價。具體包括隨機(jī)序列生成、分配隱藏、盲法、結(jié)果數(shù)據(jù)的完整性和其他偏倚來源。每項內(nèi)容均分為高風(fēng)險、不清楚和低風(fēng)險[13]。
1.5 統(tǒng)計學(xué)方法
采用Rev Man 5.3和Stata 15.0軟件進(jìn)行Meta分析。計數(shù)資料以相對危險度(RR)及其95%置信區(qū)間(CI)表示。采用Q檢驗和I 2檢驗分析異質(zhì)性。若各研究間無統(tǒng)計學(xué)異質(zhì)性(I 2<50%,P>0.10),采用固定效應(yīng)模型進(jìn)行分析;反之,則采用隨機(jī)效應(yīng)模型進(jìn)行分析。同一結(jié)局指標(biāo)根據(jù)試驗組是否聯(lián)合常規(guī)化療藥物進(jìn)行亞組分析。采用Stata 15.0軟件進(jìn)行敏感性分析;采用倒漏斗圖和Eggers檢驗進(jìn)行發(fā)表偏倚分析。P<0.05為差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 文獻(xiàn)檢索結(jié)果與納入研究基本信息
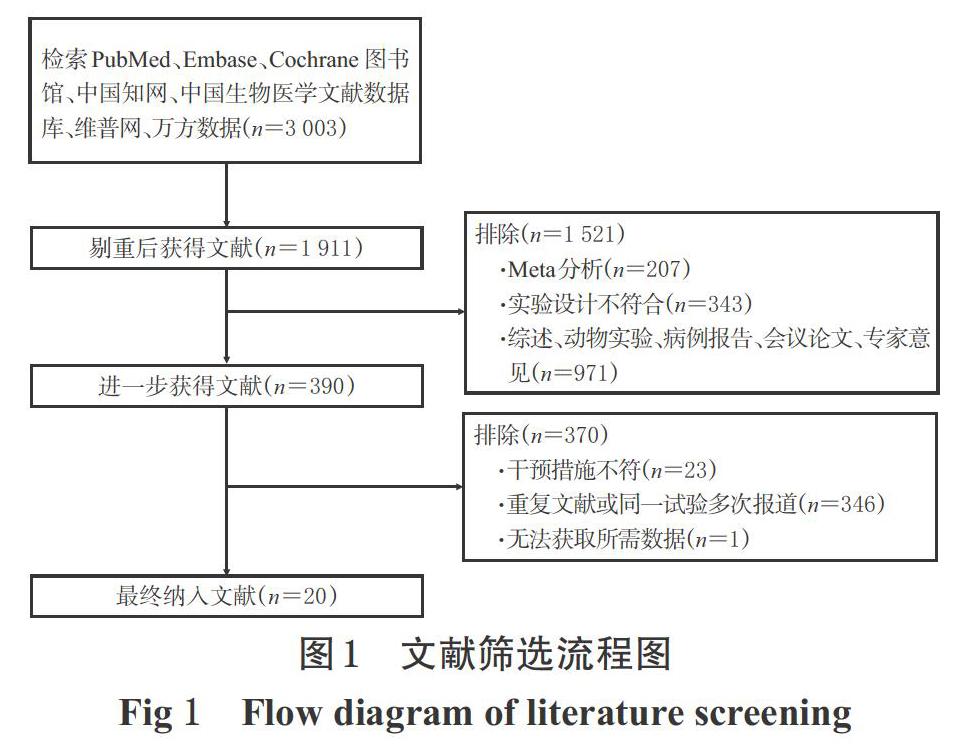
初檢共獲得相關(guān)文獻(xiàn)3 003篇,按納入與排除標(biāo)準(zhǔn)閱讀題目、摘要和全文后,最終納入20項研究[14-33],共計12 283例患者,其中對照組5 638例、試驗組6 645例;文獻(xiàn)篩選流程見圖1,納入研究基本信息見表1。
2.2 納入研究質(zhì)量評價結(jié)果
所有研究均為RCT[14-33]。19項研究描述了隨機(jī)序列產(chǎn)生的方法和分配隱藏[14-27,29-33];14項研究結(jié)局?jǐn)?shù)據(jù)完整[15-17,20-26,28-30,32];1項研究選擇性報告結(jié)果[29];4項研究對研究者和受試者采用盲法[25-26,28,31];5項研究在結(jié)局評估時使用盲法[21,24-25,28,31];所有研究均不存在其他偏倚來源,詳見圖2、圖3。
2.3 Meta分析結(jié)果
2.3.1 治療相關(guān)AEs發(fā)生率 總體所有級別AEs發(fā)生率——20項研究報道了總體所有級別AEs發(fā)生率[14-33]。Meta分析結(jié)果顯示,試驗組患者的總體所有級別AEs發(fā)生率[RR=0.87,95%CI(0.80,0.94),P<0.001]顯著低于對照組。總體重度AEs發(fā)生率——20項研究報道了總體重度AEs發(fā)生率[14-33]。Meta分析結(jié)果顯示,試驗組患者的總體重度AEs發(fā)生率[RR=0.60,95%CI(0.47,0.76),P<0.001]顯著低于對照組。終止治療發(fā)生率——17項研究報道了終止治療發(fā)生率[14-29,31]。Meta分析結(jié)果顯示,兩組患者的終止治療發(fā)生率比較,差異無統(tǒng)計學(xué)意義[RR=0.80,95%CI(0.55,1.17),P=0.25]。死亡發(fā)生率——20項研究報道了死亡發(fā)生率[14-33]。Meta分析結(jié)果顯示,兩組患者的死亡發(fā)生率比較,差異無統(tǒng)計學(xué)意義[RR=1.04,95%CI(0.80,1.35),P=0.78],詳見表2。
亞組分析結(jié)果顯示,試驗組單用ICIs患者的總體所有級別和總體重度AEs發(fā)生率、終止治療發(fā)生率、死亡發(fā)生率均顯著低于對照組(P<0.001);而試驗組使用ICIs+化療患者的終止治療發(fā)生率、死亡發(fā)生率均顯著高于對照組(P<0.05),詳見表3。
2.3.2 血液系統(tǒng)AEs發(fā)生率 貧血發(fā)生率——19項研究報道了所有級別和重度貧血發(fā)生率[14-18,20-33]。Meta分析結(jié)果顯示,試驗組患者的所有級別貧血發(fā)生率[RR=0.40,95%CI(0.29,0.56),P<0.001]、重度貧血發(fā)生率[RR=0.47,95%CI(0.31,0.74),P<0.001]均顯著低于對照組。中性粒細(xì)胞減少癥發(fā)生率——19項研究報道了所有級別和重度中性粒細(xì)胞減少癥發(fā)生率[14-18,20-33]。Meta分析結(jié)果顯示,試驗組患者的所有級別中性粒細(xì)胞減少癥發(fā)生率[RR=0.28,95%CI(0.18,0.44),P<0.001]、重度中性粒細(xì)胞減少癥發(fā)生率[RR=0.50,95%CI(0.45,0.56),P<0.001]均顯著低于對照組。血小板減少癥發(fā)生率——12項研究報道了所有級別和重度血小板減少癥發(fā)生率[18,20-21,24-28,30-33]。Meta分析結(jié)果顯示,試驗組患者的所有級別血小板減少癥發(fā)生率[RR=0.83,95%CI(0.75,0.93),P<0.001]顯著低于對照組,而兩組患者的重度血小板減少癥發(fā)生率比較差異無統(tǒng)計學(xué)意義[RR=0.91,95%CI(0.73,1.13),P=0.39],詳見表4。
亞組分析結(jié)果顯示,試驗組單用ICIs患者的所有級別和重度貧血、中性粒細(xì)胞減少癥、血小板減少癥發(fā)生率均顯著低于對照組(P<0.001),而試驗組使用ICIs+化療患者的上述指標(biāo)與對照組比較差異均無統(tǒng)計學(xué)意義(P>0.05),詳見表5。
2.3.3 臨床相關(guān)癥狀發(fā)生率 惡心發(fā)生率——18項研究報道了所有級別和重度惡心發(fā)生率[14-18,20-21,23-33]。Meta分析結(jié)果顯示,試驗組患者的所有級別惡心發(fā)生率[RR=0.60,95%CI(0.44,0.82),P=0.001]顯著低于對照組,而兩組患者的重度惡心發(fā)生率比較差異無統(tǒng)計學(xué)意義[RR=0.85,95%CI(0.61,1.18),P=0.34]。嘔吐發(fā)生率——17項研究報道了所有級別和重度嘔吐發(fā)生率[14-16,18,20-21,23-33]。Meta分析結(jié)果顯示,試驗組患者的所有級別嘔吐發(fā)生率[RR=0.64,95%CI(0.44,0.93),P=0.02]、重度嘔吐發(fā)生率[RR=0.63,95%CI(0.43,0.94),P=0.02]均顯著低于對照組。腹瀉發(fā)生率——19項研究報道了所有級別和重度腹瀉發(fā)生率[14-18,20-33]。Meta分析結(jié)果顯示,兩組患者的所有級別腹瀉發(fā)生率[RR=0.99,95%CI(0.78,1.25),P=0.94]、重度腹瀉發(fā)生率[RR=1.24,95%CI(0.82,1.89),P=0.31]比較差異均無統(tǒng)計學(xué)意義。脫發(fā)發(fā)生率——分別有15項[14-17,20-22,24-25,27-28,30-33]和14項[14-17,20-22,24-25,27-28,30,32-33]研究報道了所有級別和重度脫發(fā)發(fā)生率。Meta分析結(jié)果顯示,試驗組患者的所有級別脫發(fā)發(fā)生率[RR=0.50,95%CI(0.46,0.54),P<0.001]、重度脫發(fā)發(fā)生率[RR=0.16,95%CI(0.05,0.55),P=0.004]均顯著低于對照組。周圍神經(jīng)病變發(fā)生率——10項研究報道了所有級別和重度周圍神經(jīng)病變發(fā)生率[14-16,20-21,25,28,30-31,33]。Meta分析結(jié)果顯示,試驗組患者的所有級別周圍神經(jīng)病變發(fā)生率[RR=0.48,95%CI(0.29,0.80),P=0.005]顯著低于對照組,而兩組患者的重度周圍神經(jīng)病變發(fā)生率比較差異無統(tǒng)計學(xué)意義[RR=0.68,95%CI(0.41,1.12),P=0.13],詳見表6。
亞組分析結(jié)果顯示,除重度腹瀉外,試驗組單用ICIs患者的所有級別和重度臨床相關(guān)癥狀發(fā)生率均顯著低于對照組(P<0.05);試驗組使用ICIs+化療患者的所有級別惡心、嘔吐、腹瀉、脫發(fā)和重度腹瀉發(fā)生率均顯著高于對照組(P<0.05),而該組其余臨床相關(guān)癥狀發(fā)生率與對照組比較差異均無統(tǒng)計學(xué)意義(P>0.05),詳見表7(表中,“-”表示報道重度脫發(fā)的6項研究中僅1項研究[25]詳細(xì)記錄了患者重度脫發(fā)的發(fā)生情況,故無異質(zhì)性檢驗數(shù)據(jù))。
2.4 敏感性分析
經(jīng)亞組分析后,異質(zhì)性檢驗結(jié)果顯示,在單用ICIs亞組和使用ICIs+化療亞組患者的總體所有級別AEs發(fā)生率方面,各研究間仍存在明顯的異質(zhì)性,故采用Stata 15.0軟件中的“Metainf”命令,以總體所有級別AEs發(fā)生率為指標(biāo)進(jìn)行敏感性分析。結(jié)果發(fā)現(xiàn),在單用ICIs亞組中,Mok等[20]和Rizvi等[24]的研究對異質(zhì)性影響較大,去掉這兩項研究后,各研究間的異質(zhì)性改變較明顯(P=0.45,I 2=0),試驗組患者的總體所有級別AEs發(fā)生率與對照組比較仍有顯著性差異[RR=0.78,95%CI(0.75,0.80),P<0.001];在使用ICIs+化療亞組中,Govindan等[28]和Hellmann等[29] 的研究對異質(zhì)性影響較大,去掉這兩項研究后,各研究間的異質(zhì)性改變較明顯(P=0.35,I 2=10%),試驗組患者的總體所有級別AEs發(fā)生率與對照組比較無顯著性差異[RR=1.01,95%CI(0.99,1.03),P=0.32],詳見圖4。
2.5 發(fā)表偏倚分析
以總體所有級別AEs發(fā)生率為指標(biāo)繪制倒漏斗圖。結(jié)果顯示,單用ICIs亞組和使用ICIs+化療亞組vs.對照組的倒漏斗圖兩側(cè)基本對稱;Eggers檢驗結(jié)果顯示,PICIs=0.808,PICIs+化療=0.343,提示本研究存在發(fā)表偏倚的可能性較小,詳見圖5、圖6。以其余指標(biāo)進(jìn)行的發(fā)表偏倚分析所得結(jié)果相似(圖略)。
3 討論
ICIs在用于治療各種腫瘤的臨床研究中表現(xiàn)出顯著療效,其主要通過阻斷PD-1/PD-L1、CTLA-4信號通路來解除腫瘤細(xì)胞的免疫耐受狀態(tài),從而產(chǎn)生抗腫瘤活性[5]。隨著PD-1(如納武單抗和帕博利珠單抗)和PD-L1(如阿特珠單抗、度伐利尤單抗和阿維單抗)等多種ICIs被批準(zhǔn)用于惡性腫瘤的治療,使得患者的總生存期和無進(jìn)展生存期得到極大改善[34]。其中,納武單抗、帕博利珠單抗因用于NSCLC患者的療效顯著而被美國FDA批準(zhǔn)用于以鉑類為基礎(chǔ)的一線化療后效果不佳的晚期NSCLC患者[25-26,29]。雖然,ICIs的療效顯著,但其臨床表現(xiàn)出的與治療相關(guān)的AEs的風(fēng)險仍不能忽視[35]。研究者在ICIs用于治療NSCLC患者的臨床研究中發(fā)現(xiàn),除特殊的irAEs外,包括血液系統(tǒng)AEs(貧血、中性粒細(xì)胞減少癥、血小板減少癥)和臨床相關(guān)癥狀(惡心、嘔吐、腹瀉、脫發(fā)、周圍神經(jīng)病變)在內(nèi)的非irAEs也時有發(fā)生,且不同程度地影響患者預(yù)后[9,14,30]。有研究發(fā)現(xiàn),單用ICIs患者的嘔吐、腹瀉等非irAEs發(fā)生率與常規(guī)化療相當(dāng)[14,21];但也有研究認(rèn)為,非irAEs雖有發(fā)生,但其發(fā)生率低于常規(guī)化療[15];當(dāng)ICIs與常規(guī)化療藥物聯(lián)合使用時,腹瀉、周圍神經(jīng)病變等非irAEs發(fā)生率有所增加[25,32]。目前,現(xiàn)有研究對ICIs致非irAEs的結(jié)果不一致,而這些非irAEs與患者預(yù)后緊密相關(guān),臨床須予以重視。
本研究結(jié)果顯示,試驗組患者的總體所有級別和總體重度AEs發(fā)生率均顯著低于對照組,而兩組患者的終止治療、死亡發(fā)生率比較差異均無統(tǒng)計學(xué)意義。亞組分析結(jié)果顯示,試驗組單用ICIs患者的總體所有級別和總體重度AEs、終止治療、死亡發(fā)生率均顯著低于對照組;試驗組使用ICIs+化療患者的總體所有級別和總體重度AEs發(fā)生率與對照組比較差異均無統(tǒng)計學(xué)意義,但終止治療發(fā)生率、死亡發(fā)生率均顯著高于對照組。這提示ICIs在單一療法中的毒性較低,且聯(lián)合化療會增加終止治療和死亡的發(fā)生風(fēng)險。試驗組患者所有級別和重度貧血、中性粒細(xì)胞減少癥以及所有級別血小板減少癥發(fā)生率均顯著低于對照組。亞組分析結(jié)果顯示,試驗組單用ICIs患者的所有級別和重度貧血、中性粒細(xì)胞減少癥、血小板減少癥發(fā)生率均顯著低于對照組,而試驗組使用ICIs+化療患者的上述指標(biāo)與對照組比較差異均無統(tǒng)計學(xué)意義。這提示ICIs對血液系統(tǒng)的毒性較低,且聯(lián)合化療不會增加血液系統(tǒng)AEs的發(fā)生風(fēng)險。另外,試驗組患者所有級別惡心和周圍神經(jīng)病變以及所有級別和重度嘔吐、脫發(fā)發(fā)生率均顯著低于對照組;而兩組患者所有級別和重度腹瀉發(fā)生率以及重度惡心、周圍神經(jīng)病發(fā)生率比較差異均無統(tǒng)計學(xué)意義。亞組分析結(jié)果顯示,除重度腹瀉外,試驗組單用ICIs患者的所有級別和重度臨床相關(guān)癥狀發(fā)生率均顯著低于對照組;而試驗組使用ICIs+化療患者的所有級別惡心、嘔吐、腹瀉、脫發(fā)及重度腹瀉的發(fā)生率顯著高于對照組。這提示ICIs致所有級別和重度臨床相關(guān)癥狀的風(fēng)險較低,但聯(lián)合化療可增加所有級別惡心、嘔吐、腹瀉、脫發(fā)及重度腹瀉的發(fā)生風(fēng)險。既往研究發(fā)現(xiàn),ICIs可增加患者結(jié)腸炎的發(fā)生風(fēng)險,這可能是造成其使用ICIs聯(lián)合化療藥物時腹瀉發(fā)生率增加的原因[36]。雖然ICIs與各種自身免疫性神經(jīng)毒性有關(guān)[37],但當(dāng)前研究并沒有證據(jù)表明接受ICIs聯(lián)合化療的患者的周圍神經(jīng)病變發(fā)生率會升高。敏感性分析支持上述結(jié)果;發(fā)表偏倚分析結(jié)果顯示,本研究存在發(fā)表偏倚的可能性較小。
綜上所述,對于NSCLC患者,ICIs在治療相關(guān)AEs、血液系統(tǒng)毒性和臨床相關(guān)癥狀方面的安全性優(yōu)于常規(guī)化療藥物或安慰劑聯(lián)合常規(guī)化療藥物,但當(dāng)其聯(lián)合常規(guī)化療藥物時,因AEs終止治療和死亡的風(fēng)險以及所有級別惡心、嘔吐、腹瀉、脫發(fā)及重度腹瀉的風(fēng)險將有所增加。本研究的局限性為:(1)僅檢索了中英文數(shù)據(jù)庫,一些相關(guān)的研究可能由于語言的限制而未被納入;(2)為計算相關(guān)AEs發(fā)生率的RR值,本研究僅納入了雙臂RCT,部分單臂試驗被排除,導(dǎo)致納入研究有限、總體樣本量相對較小;(3)由于部分研究的化療方案、ICIs種類和治療劑量不盡相同,以致部分指標(biāo)在研究間的異質(zhì)性較大,研究結(jié)果具有不確定性;(4)納入研究未提供患者關(guān)于免疫治療的詳細(xì)信息,因此無法分析不同種族、民族或不同地區(qū)總體AEs和非irAEs的發(fā)生情況和風(fēng)險是否相似;(5)一項涉及ICIs相關(guān)AEs的報告表明,與PD-1/PD-L1抑制劑相比,CTLA-4單藥或聯(lián)合化療可能更易引發(fā)相關(guān)AEs[38]。由于CTLA-4的相關(guān)研究較少,本研究未對不同類別ICIs進(jìn)行亞組分析。因此,本文結(jié)論尚有待更多大樣本、多中心、高質(zhì)量的RCT進(jìn)一步證實。
參考文獻(xiàn)
[ 1 ] BRAY F,F(xiàn)ERLAY J,SOERJOMATARAM I,et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2018,68(6):394-424.
[ 2 ] GRIDELLI C,ROSSI A,CARBONE D P,et al. Non-small- cell lung cancer[J]. Nat Rev Dis Primers,2015,1:15009- 15025.
[ 3 ] TRAVIS W D,BRAMBILLA E,RIELY G J. New pathologic classification of lung cancer:relevance for clinical practice and clinical trials[J]. J Clin Oncol,2013,31(8):992-1001.
[ 4 ] NG T L,LIU Y,DIMOU A,et al. Predictive value of oncogenic driver subtype,programmed death-1 ligand(PD-L1)score,and smoking status on the efficacy of PD-1/PD-L1 inhibitors in patients with oncogene-driven non-small cell lung cancer[J]. Cancer,2019,125(7):1038-1049.
[ 5 ] WU Z,MAN S,SUN R,et al. Recent advances and challenges of immune checkpoint inhibitors in immunotherapy of non-small cell lung cancer[J]. Int Immunopharmacol,2020,85:106613-106623.
[ 6 ] MA J,LI J,QIAN M,et al. PD-L1 expression and the prognostic significance in gastric cancer:a retrospective comparison of three PD-L1 antibody clones:SP142,28-8 and E1L3N[J]. Diagn Pathol,2018,13(1):91-101.
[ 7 ] LIM S M,HONG M H,KIM H R. Immunotherapy for non-small cell lung cancer:current landscape and future perspectives[J]. Immune Netw,2020,20(1):e10-e24.
[ 8 ] LUO W,WANG Z,TIAN P,et al. Safety and tolerability of PD-1/PD-L1 inhibitors in the treatment of non-small cell lung cancer:a meta-analysis of randomized controlled trials[J]. J Cancer Res Clin Oncol,2018,144(10):1851- 1859.
[ 9 ] ABDEL-RAHMAN O. Toxicity patterns associated with chemotherapy/immune checkpoint inhibitor combinations:a meta-analysis[J]. Immunotherapy,2019,11(6):543- 554.
[10] SUN X,ROUDI R,DAI T,et al. Immune-related adverse events associated with programmed cell death protein-1 and programmed cell death ligand 1 inhibitors for non- small cell lung cancer:a PRISMA systematic review and meta-analysis[J]. BMC Cancer,2019,19(1):558-571.
[11] 秦僑西,王稼勁,王紅. ICIs治療晚期非小細(xì)胞肺癌免疫相關(guān)不良事件的系統(tǒng)綜述及Meta分析[J].中國肺癌雜志,2020,23(9):772-791.
[12] 皋文君,劉硯燕,袁長蓉.國際腫瘤化療藥物不良反應(yīng)評價系統(tǒng):通用不良反應(yīng)術(shù)語標(biāo)準(zhǔn)4.0版[J].腫瘤,2012,32(2):142-144.
[13] 谷鴻秋,王楊,李衛(wèi). Cochrane偏倚風(fēng)險評估工具在隨機(jī)對照研究Meta分析中的應(yīng)用[J].中國循環(huán)雜志,2014,29(2):147-148.
[14] RITTMEYER A,BARLESI F,WATERKAMP D,et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer(OAK):a phase 3,open-label,multicentre randomised controlled trial[J]. Lancet,2017,389(10066):255-265.
[15] BRAHMER J,RECKAMP K L,BAAS P,et al. Nivolu- mab versus docetaxel in advanced squamous-cell non- small-cell lung cancer[J]. N Engl J Med,2015,373(2):123-135.
[16] BORGHAEI H,PAZ-ARES L,HORN L,et al. Nivolu- mab versus docetaxel in advanced nonsquamous non- small-cell lung cancer[J]. N Engl J Med,2015,373(17):1627- 1639.
[17] HERBST R S,GARON E B,KIM D W,et al. Long-term outcomes and retreatment among patients with previously treated,programmed death-ligand 1-positive,advanced non-small-cell lung cancer in the keynote-010 study[J]. J Clin Oncol,2020,38(14):1580-1590.
[18] RECK M,RODRIGUEZ-ABREU D,ROBINSON A G,et al. Pembrolizumab versus chemotherapy for PD-L1-po- sitive non-small-cell lung cancer[J]. N Engl J Med,2016,375(19):1823-1833.
[19] FEHRENBACHER L,SPIRA A,BALLINGER M,et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer(POPLAR):a multicentre,open-label,phase 2 randomised controlled trial[J]. Lancet(London,England),2016,387(10030):1837- 1846.
[20] MOK T S K,WU Y L,KUDABA I,et al. Pembrolizumab versus chemotherapy for previously untreated,PD-L1-expressing,locally advanced or metastatic non-small-cell lung cancer(KEYNOTE-042):a randomised,open-label,controlled,phase 3 trial[J]. Lancet(London,England),2019,393(10183):1819-1830.
[21] CARBONE D P,RECK M,PAZ-ARES L,et al. First-line nivolumab in stage Ⅳ or recurrent non-small-cell lung cancer[J]. N Engl J Med,2017,376(25):2415-2426.
[22] WU Y L,LU S,CHENG Y,et al. Nivolumab versus docetaxel in a predominantly chinese patient population with previously treated advanced nsclc:checkmate 078 randomized phase Ⅲ clinical trial[J]. J Thorac Oncol,2019,14(5):867-875.
[23] HELLMANN M D,CIULEANU T E,PLUZANSKI A,et al. Nivolumab plus ipilimumab in lung cancer with a high tumor mutational burden[J]. N Engl J Med,2018,378(22):2093-2104.
[24] RIZVI N A,CHO B C,REINMUTH N,et al. Durvalumab with or without tremelimumab vs standard chemotherapy in first-line treatment of metastatic non-small cell lung cancer:the mystic phase 3 randomized clinical trial[J]. ? JAMA Oncology,2020,6(5):661-674.
[25] PAZ-ARES L,VICENTE D,TAFRESHI A,et al. A randomized,placebo-controlled trial of pembrolizumab plus chemotherapy in patients with metastatic squamous non- small-cell lung cancer:protocol-specified final analysis of keynote-407[J]. J Thorac Oncol,2020,15(10):1657- 1669.
[26] GANDHI L,RODR?GUEZ-ABREU D,GADGEEL S,et al. Pembrolizumab plus chemotherapy in metastatic non- small-cell lung cancer[J]. N Engl J Med,2018,378(22):2078-2092.
[27] LANGER C J,GADGEEL S M,BORGHAEI H,et al. Carboplatin and pemetrexed with or without pembrolizu- mab for advanced,non-squamous non-small-cell lung cancer:a randomised,phase 2 cohort of the open-label keynote-021 study[J]. Lancet Oncol,2016,17(11):1497- 1508.
[28] GOVINDAN R,SZCZESNA A,AHN M J,et al. Phase Ⅲtrial of ipilimumab combined with paclitaxel and carboplatin in advanced squamous non-small-cell lung cancer[J]. J Clin Oncol,2017,35(30):3449-3457.
[29] HELLMANN M D,PAZ-ARES L,BERNABE CARO R,et al. Nivolumab plus ipilimumab in advanced non-small- cell lung cancer[J]. N Engl J Med,2019,381(21):2020- 2031.
[30] SOCINSKI M A,JOTTE R M,CAPPUZZO F,et al. Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC[J]. N Engl J Med,2018,378(24):2288-2301.
[31] LYNCH T J,BONDARENKO I,LUFT A,et al. Ipilimu- mab in combination with paclitaxel and carboplatin as first-line treatment in stage ⅢB/Ⅳ non-small-cell lung cancer:results from a randomized,double-blind,multicenter phase Ⅱ study[J]. J Clin Oncol,2012,30(17):2046-2054.
[32] WEST H,MCCLEOD M,HUSSEIN M,et al. Atezolizu- mab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non- small-cell lung cancer(IMpower130):a multicentre,randomised,open-label,phase 3 trial[J]. Lancet Oncol,2019,20(7):924-937.
[33] JOTTE R,CAPPUZZO F,VYNNYCHENKO I,et al. Atezolizumab in combination with carboplatin and nab-paclitaxel in advanced squamous NSCLC(IMpower131):results from a randomized phase Ⅲ trial[J]. J Thorac Oncol,2020,15(8):1351-1360.
[34] GONG J,CHEHRAZI-RAFFLE A,REDDI S,et al. Development of PD-1 and PD-L1 inhibitors as a form of cancer immunotherapy:a comprehensive review of registration trials and future considerations[J]. J Immunother Cancer,2018,6(1):8-26.
[35] SAIGI M,ALBURQUERQUE-BEJAR J J,SANCHEZ- CESPEDES M. Determinants of immunological evasion and immunocheckpoint inhibition response in non-small cell lung cancer:the genetic front[J]. Oncogene,2019,38(31):5921-5932.
[36] LIN L L,LIN G F,LUO Q,et al. The incidence and relative risk of PD-1/PD-L1 inhibitors-related colitis in non- small cell lung cancer:a meta-analysis of randomized controlled trials[J]. Int Immunopharmacol,2019,77:105975.
[37] ELTOBGY M,OWEIRA H,PETRAUSCH U,et al. Immune-related neurological toxicities among solid tumor patients treated with immune checkpoint inhibitors:a systematic review[J]. Expert Rev Neurother,2017,17(7):725-736.
[38] WANG D Y,SALEM J E,COHEN J V,et al. Fatal toxic effects associated with immune checkpoint inhibitors:a systematic review and meta-analysis[J]. JAMA Oncol,2018,4(12):1721-1728.
(收稿日期:2021-01-27 修回日期:2021-05-05)
(編輯:陳 宏)

