基于網絡藥理學聯合GEO芯片分析百合烏藥湯治療胃癌的分子靶點及作用機制*
任雪童,狄紫蕊,付冰倩,張 哲,杜艷茹
(1.河北中醫學院研究生院,河北 石家莊 050091;2.河北中醫學院第一附屬醫院,河北 石家莊 050011)
胃癌現今仍然是全世界的一種重要癌癥,已成為第五位最常診斷的癌癥和第三大癌癥的死亡原因[1]。目前我國各年齡組的胃癌發病率已呈現出下降趨勢,全人群的發病率增長趨勢也有所緩解,但仍高于世界平均水平[2]。中醫藥治療胃癌效果越發顯著且副作用較小,采用中醫藥對胃癌防治成為一大研究熱點,深入探索中醫藥治療胃癌的分子機制,對于胃癌患者的精準治療具有重要臨床意義。
胃癌在中醫屬“胃脘痛”“噎膈”“反胃”“心腹痞”等范疇[3]。對胃癌的病機諸家學者認為其正氣虧虛為根本,痰、瘀、毒、邪相互搏結為基本病機[4]。百合烏藥湯首載于陳修園《時方妙用》[5],現代臨床中用于胃癌患者經放療、化療后出現的胃陰虧虛、虛火上炎等證頗有療效[6]。現代研究發現百合甲醇提取物、百合總生物堿能阻滯SGC-7901細胞于G2/M期,誘導SGC-7901細胞凋亡是抑制SGC-7901細胞增殖的主要機制之一[7]。
目前對于中藥復方治療胃癌的藥效基礎和作用機制尚不明確,加之研究手段存在檢測靈敏度低等局限性,難以全面闡述藥物作用機制[8]。本研究通過網絡藥理學聯合公共基因芯片數據庫GEO,獲取有關正常胃黏膜與胃癌標本的芯片,分析兩者中存在的差異表達基因,力求為胃癌腫瘤標記物的進一步研究提供參考。并對百合烏藥湯的主要活性成分進行篩選,分析活性成分的作用靶點及生物通路,從而闡明百合烏藥湯治療胃癌可能的作用機制。
1 材料與方法
1.1 藥物成分的篩選 在TCMSP數據庫(https://tcmspw.com/tcmsp.php)中以“百合”“烏藥”為關鍵詞進行檢索,按照口服利用度(OB)≥30%和類藥性(DL)≥0.18,限定物種為“Homo sapiens”為篩選條件,以得到活性成分[9]。
1.2 藥物靶點的篩選 在TCMSP數據庫中進行藥物靶點的收集,將所得靶點導入UniPort(https://www.uniprot.org/)數據庫中,校正所涉及的靶點信息和基因名稱。
1.3 胃癌GEO芯片差異分析 在GEO數據庫(https://www.ncbi.nlm.nih.gov/geo/)檢 索“gastric cancer”,篩 選 并 下 載GSE118916芯片和平臺數據,使用R軟件設定差異倍數(fold change,FC)絕對值>1,矯正后P值(adjPvalue)<0.05作為明顯差異基因的篩選條件,得出差異分析結果并導入到Excel表格中。熱圖繪制:安裝插件“packages”“pheatmap”及“Limma”包對芯片數據進行二次分析,并結合P值(adjPvalue)和FC的相關數值進行篩選,選取上調、下調最明顯的前20個基因,并定義分組(C.正常對照組,T.腫瘤組)顏色、高度等繪制熱圖。火山圖繪制:設置x軸與y軸最大值,先將基因統一設置為無差異基因,用“黑色”表示。再通過P、logFC進行篩選。當P<0.05,logFC>1,表示該基因上調,用“紅色”表示。當P<0.05,logFC<1,表示該基因下調,用“綠色”表示。
1.4 治療胃癌活性成分與作用靶點網絡圖的繪制“活性成分-靶點網絡”主要通過網絡圖像化軟件Cytoscape3.2.1進行構建和分析。本研究將從上述“1.2”獲得的活性成分及靶點關系進行導入以完成相關網絡構建,其中用“節點”(node)表示分子、靶蛋白,用“邊”(edge)表示成分與靶點之間的關系。然后采用Network analyzer插件進行網絡特征分析,以明確百合烏藥湯中較為重要的成分和靶點,尋找重要候選基因。
1.5 治療胃癌基因的蛋白互作和拓撲網絡的構建 蛋白質相互作用網絡主要借助BisoGenet和CytoNCA插件,其中Biso-Genet軟件主要從以下數據庫檢索:Biological General Repository for Interaction Datasets(BioGRID)、Biomolecular Interaction Network Database(BIND)、Molecular Interaction Database(MINT)、Human Protein Reference Database(HPRD)、Database of Interacting Proteins(DIP)等。設置計算度中心性(DC)>61,介度中心性(BC)>600,篩選重要基因(標紅的基因為候選基因)。獲得的相關活性成分及靶點則有可能直接或間接調控這些節點發揮重要作用。
1.6 治療胃癌基因GO富集分析 使用R軟件對百合烏藥湯治療胃癌的基因進行GO富集分析。根據富集的數目和顯著程度(p value閾值<0.05,q value閾值<0.05),取前20條富集過程,分別進行生物過程(biological process,BP)、細胞成分(cellular component,CC)、基因過程(molecular function,MF)的富集,繪制柱狀圖。
1.7 治療胃癌基因KEGG富集分析及通路網絡圖的繪制 使用R軟件,并安裝插件DOSE、clusterProfiler、enrichplot、colorspace、stringi、ggplot2進行分析。根據基因富集的數目和顯著程度(p value閾值<0.05,q value閾值<0.05)進行富集分析,取前20條KEGG通路,將得到的KEGG通路導入Cytoscape3.7.2,根據degree值大小,繪制通路基因網絡圖。
2 結 果
2.1 百合烏藥湯活性成分與靶點 按照口服利用度(OB)≥30%和類藥性(DL)≥0.18,得到與胃癌相關的百合烏藥湯活性成分16個,其中百合7個,烏藥9個。Drugbank顯示成分基因373個。(見表1)

表1 百合-烏藥主要成分
2.2 胃癌GEO芯片差異分析GEO數據庫下載GSE118916芯片與平臺文件,獲取有關正常胃黏膜與胃癌標本的芯片,分析兩者中存在的差異表達基因。樣本中正常對照組15個樣本,腫瘤組15個樣本。利用R軟件及相關軟件包對GSE118916表達譜數據進行過濾及標準化,篩選差異基因。差異基因篩選標準:使用R軟件設定logFC絕對值>1,矯正后P<0.05,得出正常對照組與腫瘤組差異基因1 143個,分別取上調和下調最明顯的前20個基因,分析并繪制熱圖與火山圖。熱圖中橫坐標為樣本名稱(正常對照組在前,腫瘤組在后),縱坐標為基因名稱。綠色:低表達,黑色:中表達,紅色:高表達。如差異基因FNDC1在腫瘤組高表達,在正常對照組低表達。(見圖1)火山圖中,橫坐標中logFC>0時,表示在腫瘤組上調。logFC<0時,表示在腫瘤組下調。用顏色表示為,黑色:在正常對照組與腫瘤組無差異基因;綠色:在正常對照組上調,在腫瘤組下調;紅色:在正常對照組下調,在腫瘤組上調。(見圖2)
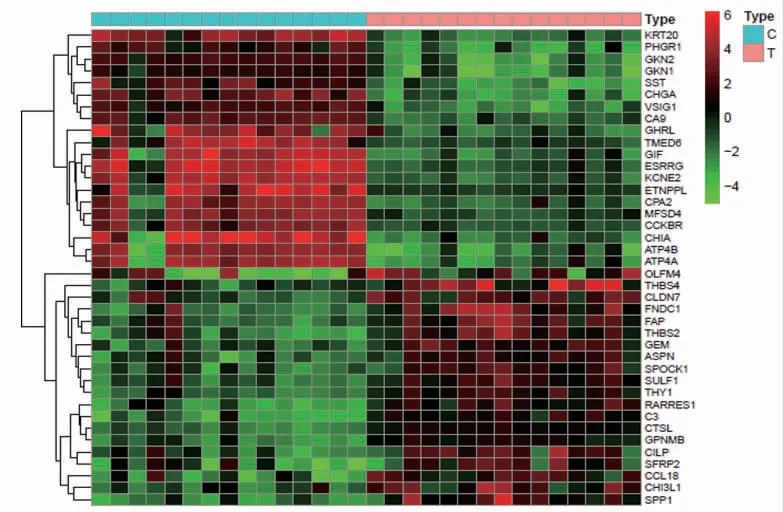
圖1 正常對照組與胃癌患者差異基因熱圖

圖2 正常對照組與胃癌患者差異基因火山圖
2.3 百合烏藥湯治療胃癌的活性成分與作用靶點網絡圖 將百合烏藥湯與胃癌差異基因取交集后,導入Cytoscape3.7.2,繪制分子基因網絡圖,根據不同靶點與有效成分對應關系的數目,進行分類展示。共得到潛在基因靶點31個,對應的有效成分10個。色原酮(Nubigenol、6,7-dimethoxy-2-(2-phenylethyl)、chromone)、豆蔻酰磷脂酰膽堿(DMPEC)、波爾定堿(Boldine)、去甲波爾定(Norboldine)、槲皮素(quercetin)、異松脂酸(Isopimaric acid)、去甲秋水仙堿(3-Demethylcolchicine)、谷固醇(beta-sitosterol),其中對應靶點較多的烏藥的活性成分槲皮素(對應27個靶點)及對應活性成分較多的PTGS2(對應8個活性成分)、ADRB2(對應8個活性成分)可能為百合烏藥湯治療胃癌關鍵活性成分。(見圖3)
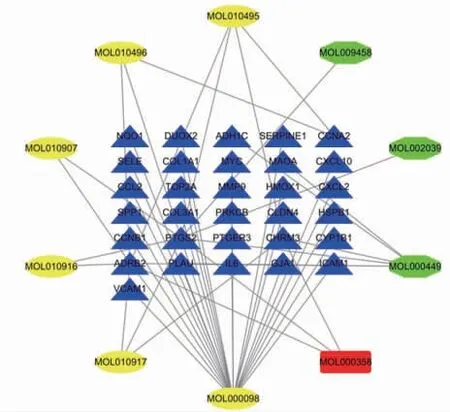
圖3 百合烏藥湯治療胃癌分子基因網絡圖
2.4 百合烏藥湯治療胃癌基因的蛋白互作網絡與拓撲網絡圖 網絡構建機體的內在調控往往是復雜的調控網絡,多見于直接調控靶點或間接調控相結合的調控方式,蛋白互作網絡則是為尋找直接或間接關系提供了可能[10]。將百合烏藥湯與胃癌差異基因取交集后,導入Cytoscape3.7.2,繪制PPI網絡圖。(見圖4)在分子基因網絡圖的基礎上,使用Bisogenet和CytoNCA插件,設置計算度中心性(DC)>61,介度中心性(BC)>600,構建拓撲網絡,共篩選出3個候選基因VCM1、HSPB1、MYC。可見VCM1、HSPB1、MYC靶點位于網絡的核心位置,在蛋白互作網絡中發揮著關鍵調控作用。(見圖5)
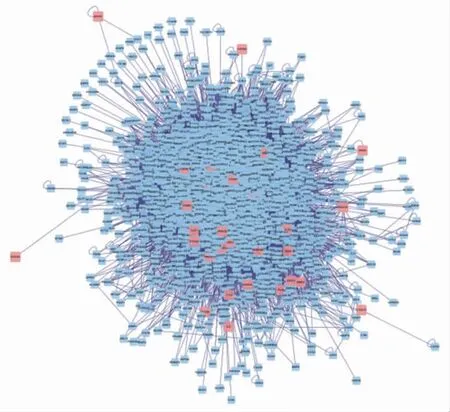
圖4 百合烏藥湯靶點蛋白相互作用網絡

圖5 百合烏藥湯治療胃癌基因拓撲網絡
2.5 百合烏藥湯治療胃癌基因GO富集分析 使用R軟件,根據百合烏藥湯治療胃癌的基因進行GO富集分析。根據富集條目和顯著程度,取前20條GO富集過程,分別繪制BP、CC、MF柱狀圖。GO富集分析可見,在生物過程方面,這些靶點涉及對脂多糖(response to lipopolysaccharide)、對細菌來源分子的反應(response to molecule of bacterial origin)、氧化應激反應(response to oxidative stress)、白細胞游走(leukocyte migration)、細胞外基質組織(extracellular matrix organization)、細胞外結構組織(extracellular structure organization)、對氧水平的反應(response to oxygen levels)等生物過程,在分子功能方面,靶點涉及細胞因子活性(cytokine activity)、整合素結合(integrin binding)、血紅素結合(heme binding)、蛋白激酶調節活性(protein kinase regulator activity)、激酶調節活性(kinase regulator activity)等分子功能。在細胞組分方面,靶點涉及內質網腔(endoplasmic reticulum lumen)、膜筏(membrane raft)、膜微結構域(membrane microdomain)、膜區域(membrane region)、細胞的頂端部分(apical part of cell)、膠原蛋白-包含細胞外基質(collagen-containing extracellular matrix)等組分。(見圖6~8)
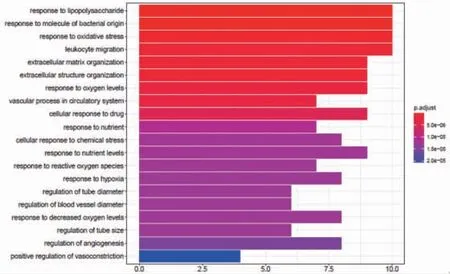
圖6 百合烏藥湯治療胃癌基因生物過程(BP)圖

圖7 百合烏藥湯治療胃癌基因細胞成分(CC)圖
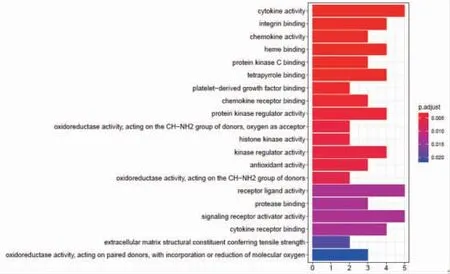
圖8 百合烏藥湯治療胃癌基因分子功能(MF)圖
2.6 百合烏藥湯治療胃癌基因KEGG富集分析及基因-通路網絡圖 使用R軟件,根據基因富集的數目和顯著程度(p value閾值<0.05,q value閾值<0.05)進行富集分析,共富集到34條通路關系。將KEGG通路導入Cytoscape3.7.2,取前20條通路。根據degree值大小,顯示通路與基因的富集程度,繪制通路基因網絡圖。(見圖9)其中AGE-RAGE信號通路(9個靶點29%),腫瘤壞死因子信號通路(9個靶點,29%),液體剪切應力和動脈粥樣硬化(7個靶點,22%),IL-17信號通路(6個靶點,19%),NF-κB信號通路(6個靶點,19%),癌癥中miRNA(7個靶點,22%),人類巨細胞病毒感染(6個靶點,19%),阿米巴病(6個,19%),EB病毒感染(5個,16%)等信號通路,對應的IL6、ICAM1、PRKCB、CCL2基因數目較多。
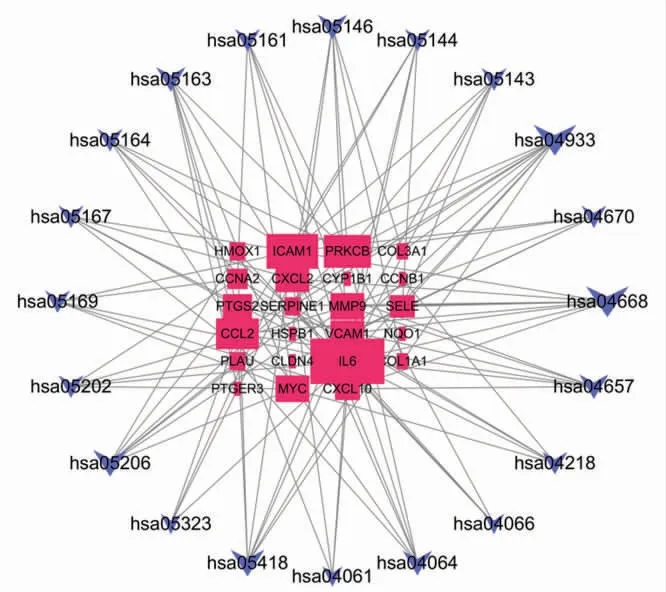
圖9 通路與基因網絡圖
3 討 論
中國作為胃癌的高發國家,在臨床發現時常是中晚期,發病年齡以中老年居多[10]。隨著病程的延長,胃癌多在寒邪凝滯的基礎上有“癌毒”積熱的臨床表現[5]。一方面脾胃虛弱,氣血虧虛,使正氣虛損加重,另一方面陰虛化熱,“癌毒”更熾,形成寒熱錯雜之證。百合烏藥湯其辨證關鍵為寒熱錯雜,氣機失調,在臨床中常加減應用于胃癌的辨證用藥,收效甚佳[11-12]。本文基于網絡藥理學,從分子機制角度,闡述百合烏藥湯治療胃癌的作用機制,為進一步研究提供理論參考。
本研究篩選得到百合烏藥湯活性成分16個,10個成分具有潛在的治療胃癌的作用。作用靶點較多的2個活性成分為槲皮素(27個靶點)和豆甾醇(5個靶點)[13-15],其中關于槲皮素、豆甾醇作用于胃癌的相關機制分析的文獻,也證實本研究的可行性。
構建拓撲網絡,共篩選出3個候選基因VCM1、HSPB1、MYC。其中關于熱休克蛋白(HSP)的研究發現,熱休克蛋白濃度升高與大多數癌癥類型的生存前景不佳有關[16]。HSP升高的意義在于其在介導腫瘤細胞內特性方面的重要作用。MYC是胃癌的一種癌基因,負責細胞過度生長,促進細胞周期調控、代謝和凋亡等基因的轉錄激活,并在胃癌中過度表達[17]。在一項胃癌細胞的研究中發現,MYC-調控基因的表達譜呈現出不同組織學亞型的胃癌細胞,在MYC調控的基因表達譜中,其共同特點為基因的改變,這一發現可能使MYC在胃癌的治療中成為一新藥靶點。
GO富集分析顯示,百合烏藥湯主要涉及脂多糖、氧化應激、血紅素結合、蛋白激酶調節等方面。脂多糖(LPS)為革蘭氏陰性桿菌外膜的組成部分,具有雙重生物學作用,作為免疫分子可以刺激機體的天然免疫反應,激發機體免疫功能,在胃癌的發展中發揮巨大作用。研究發現脂多糖可通過NF-κB激活促進胃癌細胞PD-L1的表達[18]。槲皮素可通過誘導細胞周期阻滯和促進凋亡細胞死亡而抑制腫瘤的增殖。研究發現槲皮素可明顯抑制LPS誘導的NO生成和誘導型一氧化氮合酶(INOS)的表達[19]。并通過抑制LPS來抑制NF-κB的激活。在氧化應激方面[20],槲皮素可增加活性氧(ROS)的產生,降低線粒體膜電位水平,增加AGS細胞的凋亡細胞數,并通過凋亡細胞死亡降低細胞總活力。在血紅素結合方面,研究表明斛皮素可引起血紅素氧化酶-1(HO-1)mRNA和蛋白質水平顯著升高[19]。豆甾醇則可通過抑制細胞遷移、細胞周期阻滯、線粒體介導凋亡和抑制JAK/STAT信號通路達到對人胃癌細胞的抗腫瘤作用[21]。
KEGG富集通路顯示,百合烏藥湯治療胃癌主要涉及AGE-RAGE、TNF、IL-17、NF-κB等信號通路,以及癌癥中miRNA、液體剪切應力和動脈粥樣硬化、人類巨細胞病毒感染、EB病毒感染等。其相對應靶點基因以IL-6、ICAM1、PRKCB、CCL2為主。有研究發現IL-6是化療耐藥的關鍵因素。這些發現提示IL-6抑制劑的潛在治療可應用于提高胃癌細胞對化療的反應[22]。最新研究表明,在試圖找出調控早期胃癌(EGC)的樞紐基因的研究中發現,ICAM1與胃癌的預后不良有關,因此ICAM1可能是ECG的一個有價值的預后和診斷生物標志物[23]。研究發現HSACIRC 0092306(一種新的環狀RNA)能抑制MKN-45細胞miR-197-3p表達,促進腫瘤啟動子蛋白激酶Cβ(PRKCB)的表達,從而加速胃癌的發展[24]。研究發現CCL2既能維持耐藥癌細胞的耐藥,又能使敏感的癌細胞產生耐藥性,CCL2的敲除或自噬誘導成功地逆轉了腫瘤細胞的耐藥性,在化療耐藥的生物標志物和干預靶標上具有潛在價值[25]。在TNF-α信號通路在胃癌組織中的表達及其相互關系的研究中發現,細胞存活基因可上調TNF、TNFR2、Tradd、TRAF2、CFLIP和NFKB2,而細胞凋亡的介導因子如TNFR1和CASP3被下調[26]。其結果表明,TNF/TNFR2結合介導的細胞存活基因在GC中表達上調,有利于其促腫瘤作用,而CASP3和TNFR1等促凋亡基因表達下調,提示腫瘤細胞凋亡與細胞增殖過程不平衡。這個過程也可能受到復雜的miRNA調控網絡的影響。EBV相關性胃癌(EBVaGC)約占胃癌全部病例的9%,EB病毒在胃癌的進展中具有重大作用[27]。在槲皮素治療EB病毒相關性胃癌的研究中發現,槲皮素可誘導SNU719細胞的凋亡,對DNMT1和DNMT3A表達的完全抑制作用明顯,提高了F啟動子的使用頻率,降低EB病毒的潛伏期,槲皮素有可能成為抗EBV和胃癌的抗病毒和抗腫瘤藥物[28]。
本文基于網絡藥理學探討百合烏藥湯治療胃癌靶點的相互網絡關系,可有效顯示其有效成分與疾病靶點的作用機制,為進一步實驗提供更合理具體的指導。但是本研究也存在一定的局限性,藥物有效成分篩選不全面,以及部分有效成分和信號通路有待進一步實驗考證。

