幽門螺桿菌陽性胃黏膜病變和胃癌中miR-93的表達及與臨床病理特征的相關性研究
白忠秀,王 艷,孟紅軍
幽門螺桿菌(H.pylori)攜帶者慢性淺表性胃炎(CSG)、慢性萎縮性胃炎(CAG)及腸上皮化生(IM)風險增高,胃癌(GC)患者中H.pylori陽性比例也較高[1]。有研究認為,H.pylori感染是胃黏膜癌前病變發展為GC的重要誘發因素[2],但機制尚不清楚。miRNA在腫瘤惡性行為中具有重要的調控作用,介導惡性腫瘤的發生及發展。有研究顯示,miRNA及其靶基因是H.pylori相關病變的重要調控因子[3]。miR-93在胃癌組織中表達上調[4],但在H.pylori不同狀態下miR-93表達程度可能不同。本研究檢測miR-93在H.pylori不同狀態下GC、CSG、CAG和IM等胃黏膜病變中的表達水平,并分析H.pylori不同狀態下GC中miR-93與臨床病理特征的關系,目的在于評價miR-93在H.pylori陽性GC中的表達及意義,為進一步探討miR-93與H.pylori在胃癌發生及發展中的作用及機制提供前期實驗數據。
1 資料與方法
1.1一般資料 收集2017年1月—2019年6月我院CSG患者12例、CAG患者12例、IM患者12例及GC患者23例胃鏡標本,23例GC均經過手術治療。病變組織中H.pylori陰性及陽性例數分別為CSG(5/7)、CAG(6/6)、IM(4/8)及GC(8/15)。GC患者術中切取0.5 cm3腫瘤組織及距離腫瘤2 cm以上的癌旁正常組織,置于液氮罐中保存。本研究經本院醫學倫理委員會審核通過。
1.2研究方法
1.2.1細胞培養:低分化胃癌細胞HGC-27及胃正常黏膜上皮GES-1細胞(購自中科院上海細胞庫)采用貼壁培養,在沈陽醫學院科學試驗中心進行培養及傳代。選擇生長數量>5×105的原代細胞進行傳代。細胞培養條件為5% CO2、95%空氣、37 ℃。
1.2.2H.pylori感染HGC-27細胞及GES-1細胞:H.pylori標準菌株NCTC11637購自美國ATCC,0.2~0.5 ml培養液溶解活化細菌凍干粉,后接種在2個平板上進行復蘇,培養基為改良布氏培養基,培養條件為10% CO2、3%~5% CO2、37 ℃。取融合度75%以上的對數生長期細胞,以細胞︰菌落為1︰100的比例感染各組細胞,未感染細胞為對照組,繼續培養24 h后行qRT-PCR檢測miR-93表達。
1.2.3qRT-PCR檢測:采用qRT-PCR試劑盒進行miR-93檢測。首先處理組織及細胞后按照試劑盒說明書進行總RNA抽提,并進行純度及完整性檢驗,繪制標準曲線DNA模板,配置PCR反應液,應用RT-PCR儀進行擴增,以2-ΔΔCT法進行溶解曲線分析。
1.2.4相關性分析:采集GC患者臨床病理參數,分析H.pylori不同狀態下胃癌組織miR-93相對表達量與臨床病理參數的相關性。
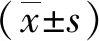
2 結果
2.1生物信息學分析miR-93表達與GC的相關性 生物信息學分析顯示miR-93在GC組織中表達高于癌旁正常組織,為GC正相關基因,且相關性極強,經P值校正后FDR<0.01,miR-93在ID-73524與ID-72398數據集中表達差異有統計學意義(P<0.01),見圖1。
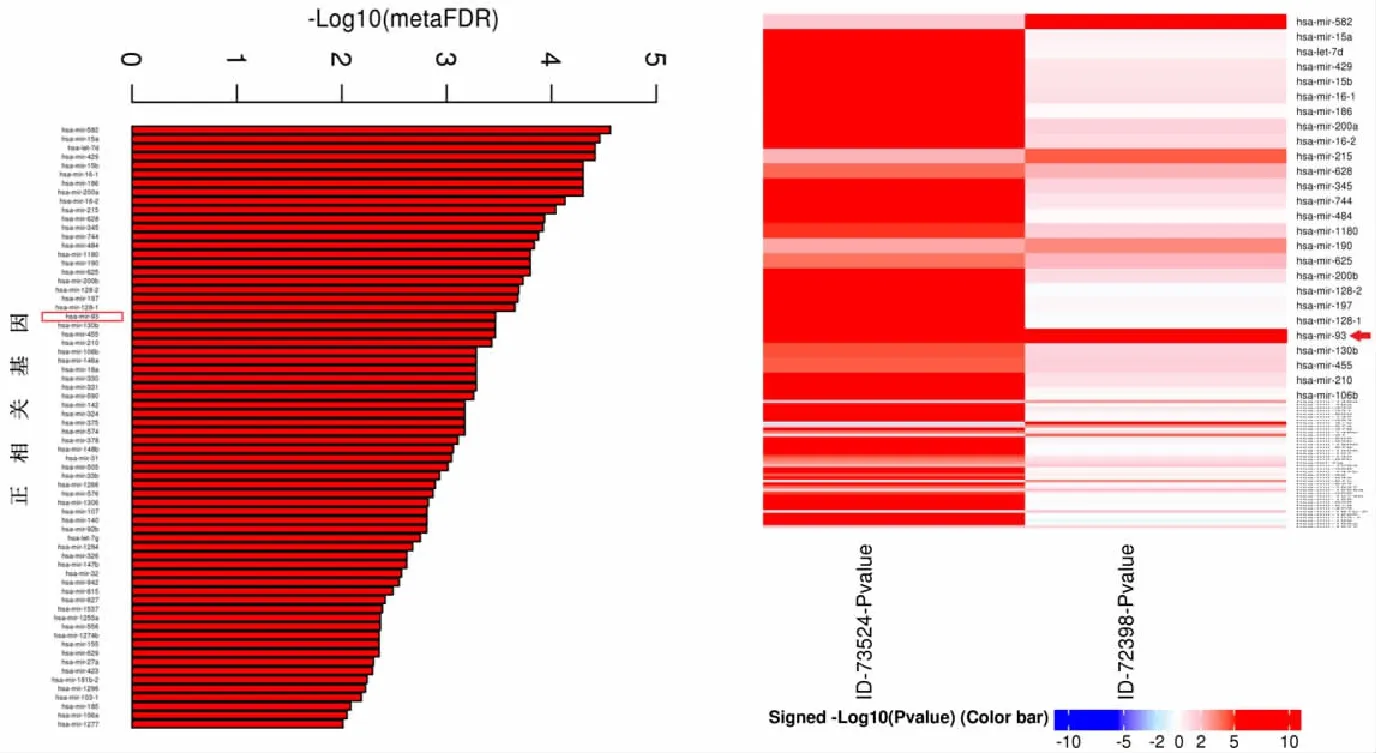
圖1 生物信息學分析miR-93與胃癌的相關性柱狀圖及熱圖
2.2miR-93在H.pylori不同狀態下胃黏膜病變及GC組織中的表達 H.pylori陽性狀態下較陰性狀態下CSG、CAG、IM及GC組織miR-93表達上調(P<0.05,P<0.01)。組間比較,H.pylori陽性狀態下,GC組織miR-93表達高于CSG、CAG及IM組織(P<0.01),IM組織miR-93表達高于CSG組織(P<0.01);H.pylori陰性狀態下,GC組織miR-93表達高于CSG、CAG及IM組織(P<0.05,P<0.01),IM組織miR-93表達高于CSG組織(P<0.01)。見圖2。
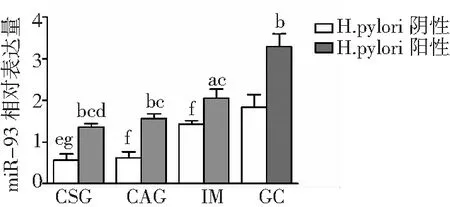
圖2 miR-93在H.pylori不同狀態下CSG、CAG、IM及GC組織中的表達CSG為慢性淺表性胃炎,CAG為慢性萎縮性胃炎,IM為腸上皮化生,GC為胃癌,H.pylori為幽門螺桿菌;與H.pylori陰性比較,aP<0.05,bP<0.01;與GC組織H.pylori陽性比較,cP<0.01;與IM組織H.pylori陽性比較,dP<0.01;與GC組織H.pylori陰性比較,eP<0.05,fP<0.01;與IM組織H.pylori陰性比較,gP<0.01
2.3H.pylori不同狀態下GC組織與癌旁正常組織中miR-93的表達 H.pylori陽性GC組織miR-93表達顯著高于癌旁正常組織(P<0.05),見圖3A;H.pylori陰性GC組織miR-93表達與癌旁正常組織比較無差異(P>0.05),見圖3B。
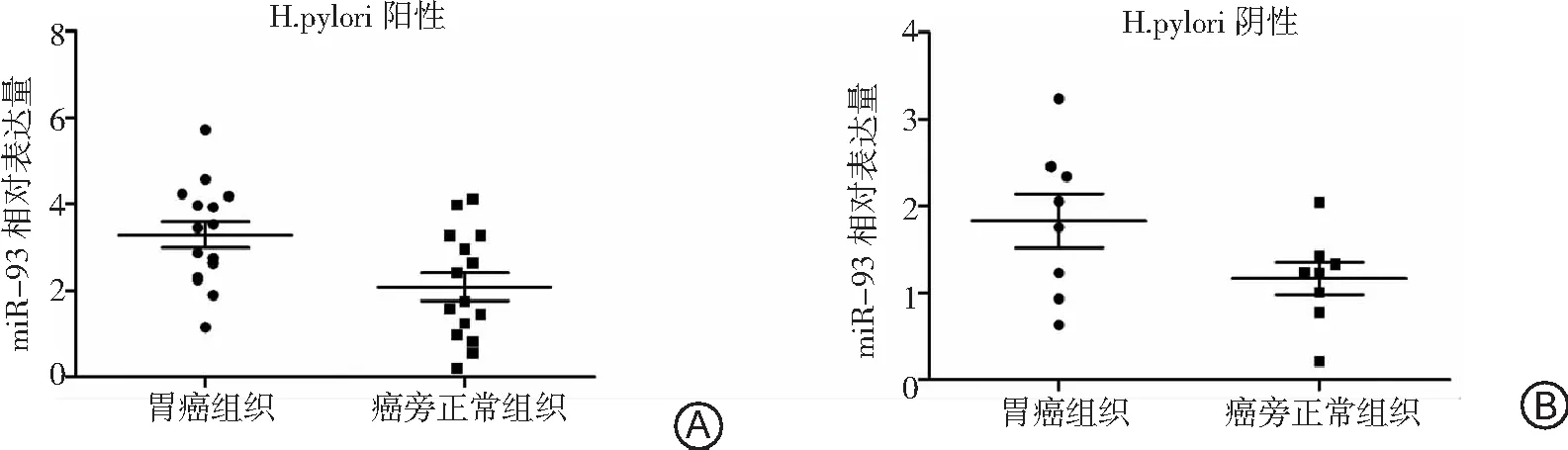
圖3 H.pylori不同狀態下胃癌組織與癌旁正常組織中miR-93的表達情況H.pylori為幽門螺桿菌
2.4H.pylori不同狀態下GC組織miR-93表達與臨床病理參數的相關性 TNM分期Ⅲ+Ⅳ期、淋巴結轉移陽性、浸潤深度T3+T4、低+未分化的H.pylori陽性GC組織中miR-93表達要高于TNM分期Ⅰ+Ⅱ期、淋巴結轉移陰性、浸潤深度T1+T2、高+中分化的H.pylori陽性GC組織(P<0.01)。見表1。

表1 H.pylori不同狀態下胃癌組織miR-93表達與臨床病理參數相關性
2.5H.pylori對GC細胞miR-93表達的影響 為探討miR-93與H.pylori陽性GC的關系,我們觀察了H.pylori干預下低分化GC細胞HGC-27及胃正常黏膜上皮細胞GES-1中miR-93表達水平,結果顯示,H.pylori干預下HGC-27細胞及GES-1細胞中miR-93表達均上調(P<0.01),見圖4。
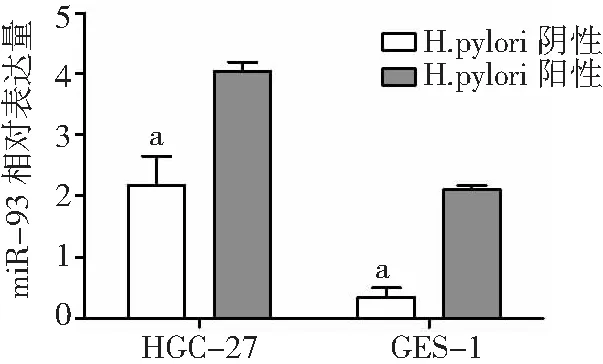
圖4 H.pylori干預下胃癌細胞HGC-27及正常胃黏膜細胞GES-1中miR-93表達變化H.pylori為幽門螺桿菌;與H.pylori陽性比較,aP<0.01
3 討論
GC在消化系統腫瘤中較常見,發病率及病死率均呈上升趨勢,H.pylori為GC重要的致病因素,其誘發機制是目前研究的熱點[5]。CAG患者癌變率較高,H.pylori攜帶率也高[6]。IM是癌前病變,有研究顯示該類患者H.pylori陽性率極高[7]。慢性胃炎、CAG及IM可能是胃黏膜病變到GC的演化過程,而H.pylori在這個過程中的作用及機制目前并不明確[8]。miR-93在多種惡性腫瘤組織及細胞中表達高于癌旁正常組織[9],GC組織中miR-93的表達與其他實體瘤相似,調控癌細胞增殖、侵襲及凋亡等惡性行為[10]。但目前H.pylori不同狀態下GC組織中miR-93表達的相關研究較少。
本研究首先通過TCGA生物信息學分析了miR-93在GC組織中的表達高于癌旁正常組織,提示miR-93為GC的促癌基因。為進一步分析miR-93與胃黏膜病變及癌性病變的關系,本研究觀察H.pylori不同狀態下miR-93在胃黏膜病變(CSG、CAG及IM)組織中的表達情況,結果顯示在H.pylori陽性以上病變組織中miR-93表達均上調,隨著黏膜病變的加重miR-93表達呈上升趨勢,而在H.pylori陰性狀態下這種趨勢不明顯。LIU等[11]研究顯示,miR-30a可促進H.pylori相關GC的進展。miR-122在H.pylori陽性或陰性GC組織中表達均上調[12]。另有研究認為,miR-155能抑制H.pylori陽性胃炎向GC的發展過程[13]。這些研究均表明,H.pylori感染能影響胃黏膜miRNA表達水平,進而促進或抑制胃黏膜病變的進展。本研究進一步顯示,在H.pylori陽性GC組織中miR-93表達顯著高于癌旁正常組織,而在H.pylori陰性的GC組織中這種差異并不明顯。而且在H.pylori陽性與陰性GC組織中,miR-93表達在TNM分期、淋巴結轉移、浸潤深度及分化程度方面具有明顯差異。QU等[14]研究顯示,miR-490-3p在H.pylori陽性GC組織中表達下調,與不良臨床病理特征具有相關性。這也說明,是否存在H.pylori感染對miRNA在GC組織中的表達及功能具有調控作用。為進一步驗證miR-93與H.pylori感染有關,本研究通過細胞實驗觀察在H.pylori干預下,GC HGC-27細胞及正常胃上皮GES-1細胞miR-93表達的差異,結果顯示H.pylori干預下細胞miR-93表達上調,表明H.pylori可能影響GC細胞或胃上皮細胞中miR-93的表達。SHAO等[15]研究認為,H.pylori通過誘導miR-135b-5p表達抑制GC細胞凋亡及誘導順鉑耐藥。XIE等[16]研究顯示,H.pylori通過抑制GC細胞miR-152及miR-200b表達促進GC細胞免疫逃逸。以上研究均支持H.pylori相關GC與H.pylori誘導的miRNA表達具有調控關系。
總之,miR-93在H.pylori陽性胃黏膜病變、GC組織及細胞中表達上調,與GC不良臨床病理特征具有一定相關性。

