動態增強磁共振成像聯合擴散峰度成像對前列腺癌的評估價值
吳迪,吳西豪,李依明
(商丘市第一人民醫院 放射科,河南 商丘 476000)
核磁共振成像(magnetic resonance imaging,MRI)是多種腫瘤的術前診斷手段。但前列腺炎癥、鈣化、出血也可表現為外周帶內低信號,增加了前列腺病變的診斷難度,僅行常規MRI檢查有一定誤診率或漏診率[1]。動態增強磁共振成像(dynamic contrast enhanced MRI,DCE-MRI)可反映血管通透性及灌注情況,進而評估腫瘤血管生理特征,對鑒別前列腺病變良惡性有一定價值[2]。此外,擴散峰度成像(diffusion kurtosis imaging,DKI)可分析水分子,進而反映組織微觀結構改變,利于為病灶性質鑒別提供可參考的意見[3]。基于此,本研究旨在進一步分析DCE-MRI聯合DKI對前列腺癌的診斷價值。
1 資料與方法
1.1 一般資料回顧性分析商丘市第一人民醫院2019年1月至2021年1月收治的115例前列腺病變患者的臨床資料,年齡52~68歲,平均(59.14±5.72)歲;前列腺增生93例,前列腺癌22例;入院時國際前列腺癥狀評分(international prostate symptom score,IPSS)[4]12~24分,平均(18.59±4.12)分;血清前列腺特異性抗原(prostate specific antigen,PSA)5.7~68.6 μg·L-1,平均(29.85±6.71)μg·L-1。
1.2 入選標準(1)納入標準:①符合前列腺病變的診斷標準[5],經手術標本病理學檢查確診;②為初次發病;③MRI影像學資料完整。(2)排除標準:①檢查前接受過放射治療或內分泌治療;②檢查前已行前列腺穿刺活檢;③獲取圖像偽影較重或質量較差;④有多發病變,影響圖像觀察。
1.3 檢查方法
1.3.1儀器 儀器選用美國GE公司Discovery MR 750 3.0 T超導全身磁共振掃描儀,射頻發射線圈為體線圈,接收線圈為8通道相控陣線圈,掃描中心為恥骨聯合處,掃描前患者需飲水充盈膀胱,取仰臥位,調整呼吸,于雙外耳道置入耳塞,以減輕不適。
1.3.2常規MRI掃描 軸位T1加權成像(T1weighted image,T1WI),掃描參數:重復時間(time of repetition,TR)726 ms,回波時間(time of echo,TE)7 ms,層厚4 mm,層距0.4 mm,視野(field of view,FOV)為46 cm×46 cm,矩陣320×224,翻轉角(flip angle,FA)為90°,掃描時長為130 s。三方位T2加權成像(T2weighted image,T2WI),掃描參數:層厚4 mm,層距0.4 mm,TR為5 338 ms,TE為99 ms,FOV為22 cm×22 cm,矩陣288×224,FA為90°,掃描時長為163 s。軸位脂肪抑制T2WI,掃描參數:層厚為4 mm,層距為0.4 mm,TR為6 058 ms,TE為102 ms,FOV為22 cm×22 cm,矩陣288×192,FA為90°,掃描時長為154 s。
1.3.3DCE-MRI掃描 注射對比劑前,先進行1個周期掃描,所得圖像視為蒙片,經肘靜脈高壓注射軋噴替酸葡甲胺對比劑0.2 mmol·kg-1、生理鹽水20 mL,注射速率為3 mL·s-1,注射同時行第2周期掃描,每周期收集30幅圖像,進行75個周期掃描,掃描時長為313 s。掃描參數:層厚3 mm,層距0 mm,TE為104 ms,TR為4 000 ms,FOV為180 cm×180 cm,矩陣384×384,FA為90°,層數為21,回波鏈長度18。采集時間178 s。
1.3.4DKI掃描 行擴散加權成像和DKI檢查,擴散加權成像參數:FOV為30 cm×30 cm,TR為3 600 ms,TE為54 ms,層間距1 mm,層厚3 mm,矩陣160×160,激勵次數為4,b=0、1 000 s·mm-2。DKI參數:FOV為30 cm×30 cm,TR為4 500 ms,TE為103 ms,層間距0,層厚3 mm,矩陣128×128,激勵次數2,b=0、1 000、2 000 s·mm-2。對非0b值施加15個互相垂直方向的擴散敏感梯度場。
1.3.5圖像處理 將數據上傳至GE AW4.5工作站,采用Functool處理,由2名影像科副主任醫生進行診斷,測量DCE-MRI參數,包括血管外細胞外間隙容積比(extracellular volume fraction,Ve)、速率常數(rate constant,Kep)、容量轉移常數(volumetransfer constant,Ktrans)。生成DKI參數,包括軸向峰度(axial kurtosis,AK)值、平均峰度(mean kurtosis,MK)值、徑向峰度(radial kurtosis,RK)值、平均擴散(mean diffusion,MD)值、各向異性分數(fractional anisotropy,FA)值。勾選感興趣區,避開尿道、血管、鈣化區域。測得感興趣區面積大小,計算表觀彌散系數(apparent diffusion coefficient,ADC)值。
1.4 評價指標以手術標本病理學檢查結果為“金標準”,將患者分為前列腺增生組與前列腺癌組,比較兩組DCE-MRI及DKI各參數,分析DCE-MRI聯合DKI對前列腺病變的診斷效能。
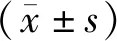
2 結果
2.1 手術標本病理學檢查結果經手術標本病理學檢查結果顯示,115例前列腺病變患者中,有45例(39.13%)前列腺癌,有70例(60.87%)前列腺增生。
2.2 DCE-MRI各參數前列腺癌組Kep、Ktrans高于前列腺增生組(P<0.05);兩組Ve比較,差異無統計學意義(P>0.05)。見表1。
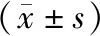
表1 兩組DCE-MRI各參數比較
2.3 DKI各參數前列腺癌組AK、MK、RK高于前列腺增生組(P<0.05);兩組MD、FA、ADC比較,差異無統計學意義(P>0.05)。見表2。
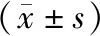
表2 兩組DKI各參數比較
2.4 DCE-MRI聯合DKI對前列腺病變的診斷效能將DCE-MRI參數Kep、Ktrans及DKI參數AK、MK、RK作為檢驗變量,將前列腺病變情況作為狀態變量(前列腺癌=“1”,前列腺增生=“0”),采用SPSS 24.0繪制ROC,檢驗單項參數對前列腺病變的診斷效能,并采用SPSS 24.0的轉換功能,將5個單項參數轉化為聯合參數,分析DCE-MRI聯合DKI對前列腺病變的診斷效能,結果顯示,Kep、Ktrans、AK、MK、RK單項參數診斷前列腺病變的AUC均>0.80,有中等診斷效能,DCE-MRI聯合DKI診斷前列腺病變的AUC為0.974,有高診斷效能。見表3。
3 討論
因前列腺癌發病早期無明顯癥狀,僅有輕微會陰部不適、墜脹及疼痛等癥狀,臨床診斷難度較大。既往臨床將病理學檢查作為診斷前列腺病變的金標準,但穿刺可造成創傷,術前不主張實施穿刺活檢[6]。而術后檢查具有滯后性,術前若能明確患者病灶性質,則能優化手術方案,降低患者預后不良風險。
對前列腺病變患者行影像學檢查有一定優勢,可采用手段包括CT、彩超、MRI等,MRI檢查速率快,分辨率高,無電離輻射,在臨床中應用廣泛。本研究結果顯示,前列腺癌組Kep、Ktrans高于前列腺增生組,說明DCE-MRI在前列腺病變診斷中有一定價值。分析原因在于,前列腺癌組織微血管密度高,在MRI檢查中表現為血流灌注增強、血管密度增加,但單獨憑借血流特征尚無法有效鑒別前列腺病變性質。DCE-MRI定量分析可通過Tofts-Kermode模型擴展的雙室模型進行計算,得出參數,各參數可評價腫瘤血管的生理學特征[7]。Kep水平高低與微血管密度或滲漏有關,主要反饋對比劑從組織間隙進入血管的量;Ktrans水平高低與毛細血管滲透性、表面積、血流量有關,主要反映對比劑從血液進入組織間隙的轉運容積[8]。兩者水平升高可說明患者血管生成速率快,內皮細胞間隙加大,微血管、毛細血管滲漏較高,血流灌注升高。而上述特征是惡性腫瘤的主要特征,因此Kep、Ktrans高多見于前列腺癌,可為鑒別前列腺病變性質,及早診斷患者病情提供可借鑒的意見。
前列腺癌組AK、MK、RK高于前列腺增生組,說明DKI在前列腺病變診斷中有一定價值。分析原因在于,擴散加權成像是傳統擴散技術,原理為高斯擴散模型,通過分析水分子擴散情況,評估病灶特征,可在一定程度上鑒別病灶與正常組織,但良性及惡性病變組織水分子擴散與較多因素有關,造成常規的擴散加權成像診斷尚有局限[9]。DKI在傳統擴散加權技術上進行改進,將水分子呈非高斯分布擴散,可更為準確地分析組織水分子擴散受限程度,并反映不均質性,進而更為科學地反映組織微觀結構改變[10]。各參數中,AK、MK、RK水平高低均與感興趣區組織的結構復雜程度有關。AK值低,組織越趨向于各向同性擴散,而AK值越高,可反饋為組織結構越緊密;MK值高,非正態分布水分子擴散受限,反饋為組織結構復雜;RK主要反饋擴散正交方向上峰度的平均值,擴散受限主要在徑向,RK值高,徑向非正態分布水分子擴散受限[11]。因此AK、MK、RK水平高可反饋為水分子擴散受限顯著,病灶惡性程度高。
繪制ROC曲線發現,DCE-MRI聯合DKI診斷前列腺病變的AUC>0.90,有高診斷效能,臨床可將DCE-MRI聯合DKI在前列腺病變患者中推廣應用。因本研究未觀察CT、彩超等檢查手段對前列腺病變患者的診斷效能,結論尚有局限,未來還可結合多項診斷方法,進一步提高前列腺病變的診斷準確度。
綜上所述,前列腺良性病變患者與惡性病變患者MRI多項參數有明顯差異,DCE-MRI聯合DKI對前列腺癌有高診斷效能,值得臨床推廣應用。

