NOXO1 通過調節免疫細胞浸潤影響胃癌患者預后
段安樂,趙劍芳,郭艷,周歡,王云霞,李汭璇,段磊
1.甘肅省第三人民醫院消化科,甘肅蘭州 730000;2.蘭州大學第二附屬醫院神經外科,甘肅蘭州 730000
胃癌大多起源于胃黏膜細胞,是第四大最常見的癌癥[1]。 約70%~85%的胃癌患者在確診后5年內死亡,與多數癌癥類似,胃癌的高病死率主要是由于確診時間過晚和治療方法有限所致[2]。盡管近幾十年來,包括免疫療法,放射療法和手術切除在內的多模式治療策略已經取得了很大進展,然而胃癌依然是難以解決的公共衛生問題[3]。自 “精準醫學” 概念提出以來,分子病理學檢測方法和靶向療法的改進顯著提高了胃癌患者的生存率[4]。 然而由于胃癌分子機制目前尚不明確, 使得胃癌分子病理學和靶向治療面臨諸多困難。 因此,探究更有效的關鍵分子對于胃癌的治療至關重要。
煙酰胺腺嘌呤二核苷酸磷酸氧化酶形成體1(NADPH Oxidase Organizer 1, NOXO1) 是NADPH 氧化酶家族的成員之一,該家族是體內氧化還原信號的關鍵酶[5]。NADPH 氧化酶催化生成的活性氧可促進腫瘤的生成,而腫瘤細胞產生的活性氧促進了腫瘤的發生發展[6]。NADPH 氧化酶家族成員在肺癌、肝癌、黑色素瘤、前列腺癌和食管癌等腫瘤中發揮著重要的作用[7]。關于NOXO1 在胃癌中的作用尚未報道。 因此該研究是應用生物信息學分析,從而探究了NOXO1 在胃癌中的關鍵作用。 該研究填補了NOXO1 在胃癌中研究的空白,為胃癌分子病理學和靶向治療的研究提供指導,現報道如下。
1 資料與方法
1.1 一般資料
該研究用于分析NOXO1 的數據來源于TCGA數據庫(https://portal.gdc.cancer.gov/),從TCGA 數據庫獲得胃癌患者的年齡、性別、種族、分析、腫瘤純度、基因測序數據和臨床預后資料。 探究NOXO1 在胃癌中作用的分析均基于TCGA 數據庫中所有的胃癌患者數據。 探究NOXO1 在正常人體中表達情況的數據來源于人類蛋白質表達圖譜。
1.2 方法
應用GEPIA2 和TIMER 在線工具基于胃癌基因測序數據和臨床預后資料探究了NOXO1 在胃癌中的表達情況和預后價值。 為了確定NOXO1 是否為胃癌患者的獨立預后因素,在該研究中我們對胃癌常見的臨床特征(年齡、性別、種族、分期和腫瘤純度)進行了單因素Cox 回歸和多因素Cox 回歸。應用人類蛋白質表達圖譜繪制了NOXO1 在人體各個器官中的表達圖譜,主要分析了mRNA 和蛋白水平的表達情況。為了確定NOXO1 與胃癌治療靶點的相關性,該研究不僅探究了NOXO1 與VEGFA 在胃癌中的相關性,而且探究了其在所有腫瘤中是否存在相關性。 在TIMER 數據庫對NOXO1 與免疫細胞的相關性進行了探究。 為了更深入探究NOXO1 與免疫細胞的相關性,該研究探究了其與免疫細胞亞型的相關性。
1.3 統計方法
采用Limma 分析用于分析NOXO1 在胃癌與正常組織的表達差異; 應用Kaplan-Meier 生存分析探究NOXO1 在胃癌中的預后價值;單因素Cox 回歸和多因素Cox 回歸探究包括NOXO1 在內的多種因素對于胃癌預后的影響。 所有相關性分析方法采用Pearson 相關性分析,基于R 語言實現(版本:4.1.0)實現,P<0.05 為差異有統計學意義。
2 結果
2.1 NOXO1 的表達驗證
在TIMER 中,NOXO1 與在各種癌腫中的表達結果顯示(見圖1A),相比于癌旁組織,NOXO1 在BLCA,BRCA,COAD,ESCA,HNSC,KIHC,KIRC,LUAD,LUSC和STAD 等諸多癌癥中表達增高。 在GEPIA2 中,NOXO1 在COAD,PAAD 和STAD 中表達增高, 而其在GBM 和TGCT 中的表達降低(見圖1B)。 兩分析平臺結果均顯示NOXO1 在胃癌中表達增高,差異有統計學意義(P<0.05)。
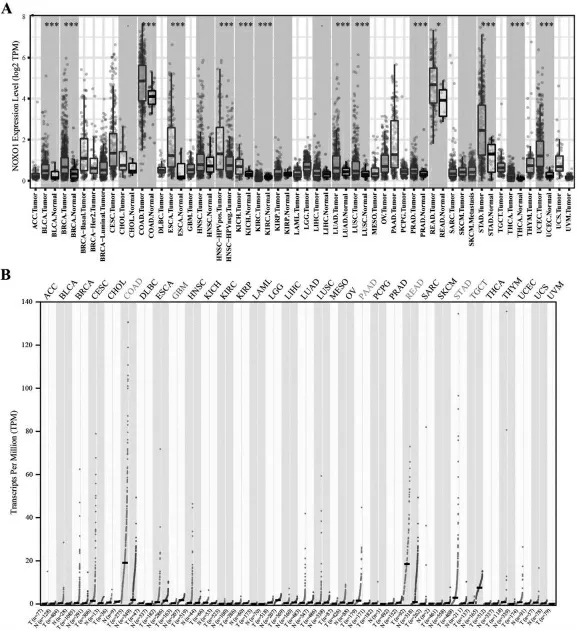
圖1 NOXO1 在各種癌癥中的差異表達
2.2 NOXO1 與胃癌和其他腫瘤預后的相關性
NOXO1 在不同數據庫中與胃癌預后的相關性分析結果顯示,NOXO1 的高表達均與胃癌患者預后較好呈正相關(見圖2 A, B)。 NOXO1 與所有腫瘤患者預后的熱圖顯示(見圖2C),NOXO1 與ACC,CHOL,HNSC 和STAD 等患者的預后密切相關, 差異有統計學意義(P<0.05)。
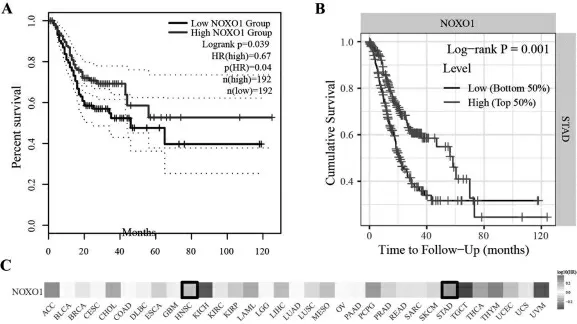
圖2 NOXO1 與在不同數據庫與胃癌和其他腫瘤預后的關系
2.3 NOXO1 與臨床特征單多變量Cox 回歸分析的結果
單變量Cox 回歸分析結果顯示,年齡(HR=1.020,P=0.009),3 期(HR=2.526, P=0.003),4 期(HR=4.088,P<0.001)和NOXO1(HR=0.834, P=0.001)與胃癌患者的預后關系密切,差異有統計學意義(P<0.05)。 多變量Cox 回歸分析的結果也表明,年齡(HR=1.032, P=0.001),3 期(HR=2.753, P=0.005),4 期(HR=3.921, P=0.007)和NOXO1(HR=0.801, P=0.001)與胃癌患者的預后關系密切,差異有統計學意義(P<0.05)。 見表1、表2。
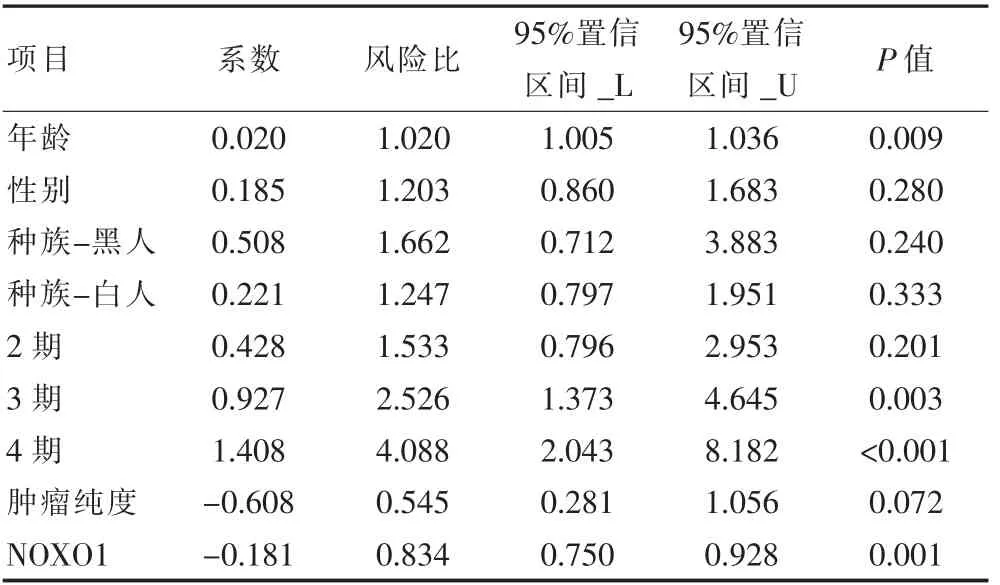
表1 單因素Cox 回歸分析結果
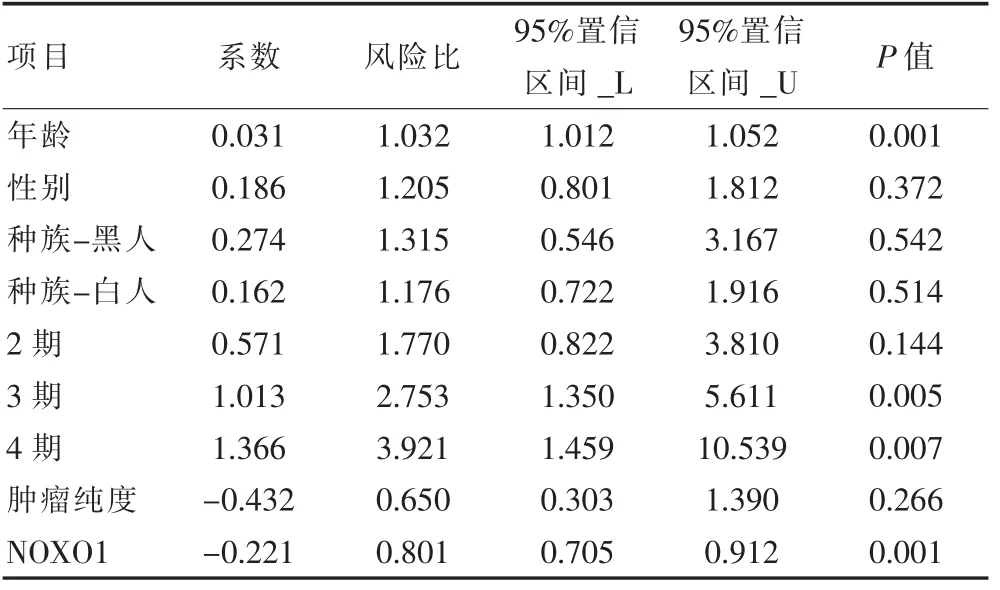
表2 多因素Cox 回歸分析結果
2.4 NOXO1 在人體正常器官中的表達情況
NOXO1 在人體組織中表達驗證結果顯示(見圖3), 在人體正常組織中mRNA 層面的表達結果顯示,NOXO1 在腦、消化道、男性生殖系統和骨髓淋巴系統等多種器官中表達較高,人體正常組織中蛋白層面的表達結果表明,NOXO1 在消化道和男性生殖系統表達較高,差異有統計學意義(P<0.05)。
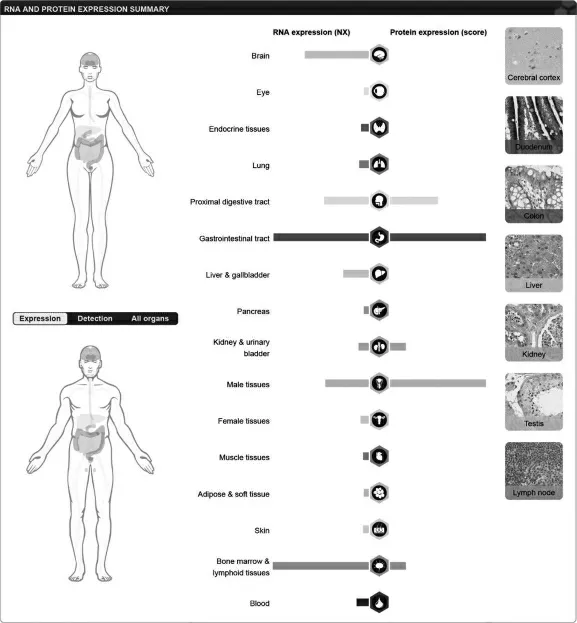
圖3 NOXO1 在人體組織中的表達驗證
2.5 NOXO1 與VEGFA 的關系
NOXO1 與VEGFA 的相關性分析結果顯示:在所有腫瘤中NOXO1 與VEGFA 沒有明確的相關性,差異無統計學意義(P>0.05),見圖4A。 而在胃癌組織當中,NOXO1 與VEGFA 呈正相關 (r=0.13, P=0.01),見圖4B。 NOXO1 在胃癌和其他腫瘤中相關性分布情況見圖4C。

圖4 NOXO1 與VEGFA 的相關性
2.6 NOXO1 與免疫的相關性
NOXO1 在胃癌中與腫瘤純度及免疫細胞的相關性分析結果顯示,其與B 細胞(P=0.009),巨噬細胞(P=0.001)關系密切,其中與巨噬細胞最為相關,差異有統計學意義(P<0.05),見圖5。 同NOXO1 與巨噬細胞亞型的相關性的結果表明,NOXO1 的表達與巨噬細胞亞型在多數腫瘤中存在相關性,其中在胃癌中,NOXO1 的表達與M0 巨噬細胞和M1 巨噬細胞的浸潤呈正相關,而與M2 巨噬細胞的浸潤呈負相關,差異有統計學意義(P<0.05),見圖6。

圖5 NOXO1 與腫瘤純度及免疫細胞浸潤的相關性

圖6 NOXO1 與巨噬細胞亞型的相關性及在各大腫瘤中其與VEGFA 的相關性
3 討論
在正常組織中,NOXO1 可通過促進NOX1 和NOX3 催化氧化還原反應[8]。 NOXO1 可通過促進NOX1的活性和活性氧的生成,從而促進結腸癌的發生[9]。除此之外,NOXO1 可通過促進結腸癌上皮細胞的增殖和抑制凋亡促進結腸癌的增殖和侵襲[10]。 有學者通過動物實驗表明,NF-κB 在TNF-α 可直接調控NOXO1促進胃癌細胞的增殖[11]。 NOXO1 也與食管癌的耐藥相關[12]。 NOXO1 在多種腫瘤的分子機制中發揮著重要的作用,而關于NOXO1 在胃癌中的具體功能目前尚不清楚。
在該研究中, 我們發現NOXO1 在胃癌中高表達,且為胃癌的獨立預后因素,其高表達提示患者預后較好。 NOXO1 在結腸癌中高表達[10],而在胃癌中的表達情況尚不清楚。 NOXO1 與預后的關系是否受表觀遺傳學的影響,以至NOXO1 的高表達與患者預后較好呈正相關,該研究不能提供可靠的證據。 該研究未涉及蛋白層面的驗證,關于具體調控機制,仍需進一步生物實驗驗證。
VEGFA 的主要功能是促血管擴張和通透性,是多種腫瘤的治療靶點[13]針對VEGFA 的靶向藥物主要有貝伐珠單抗。 VEGFA 主要與胃癌的增殖、侵襲轉移和腫瘤血管生成相關, 在實驗動物動物體內抑制VEGFA 可以明顯抑制腫瘤移植物的生長[14]。 在該研究中,我們發現NOXO1 與VEGFA 的表達呈正相關,其可能與VEGFA 共同作用而在胃癌中發揮作用。 因此對于NOXO1 和VEGFA 具體關系的探究將會為VEGFA 靶向治療提供指導。
腫瘤微環境因其在腫瘤發生、發展和轉移過程中的重要作用而備受關注。 該研究中, 我們通過分析NOXO1 與免疫細胞的關系, 發現NOXO1 與B 細胞和巨噬細胞關系密切。 NOXO1 與巨噬細胞亞型相關性分析結果表明,NOXO1 的表達與M0 巨噬細胞和M1 巨噬細胞的浸潤呈正相關, 而與M2 巨噬細胞的浸潤呈負相關。相關學者通過免疫組織化和生存分析表明,胃癌中主要浸潤的B 細胞是記憶B 細胞和漿細胞,而且CD20+B 細胞與胃癌的生存密切相關[15]。 M2巨噬細胞的高浸潤在胃癌中被認為是免疫抑制的特征,可能導致不良的預后[16],趨化因子受體CXCR3 可通過降低M2 巨噬細胞的浸潤而與患者預后較好相關[17]。 Wang 等的一項meta 分析表明,M1 巨噬細胞和M0 巨噬細胞的高浸潤提示患者預后較差, 而M2 巨噬細胞的浸潤提示胃癌患者預后較好[18]。 基于以上研究, 我們大膽推測,NOXO1 雖然在胃癌中高表達,但是與預后較好呈正相關的原因可能與其對M0 巨噬細胞、M1 巨噬細胞和M2 巨噬細胞的調節有關,至于是直接調控還是間接調控,仍需我們進一步證明。 然而目前關于M0 巨噬細胞和M1 巨噬細胞在胃癌中的具體作用目前尚不清楚,對于這方面的進一步研究可深入的了解NOXO1 的免疫調控機制。
綜上所述,在該研究中,基于基因測序數據發現NOXO1 可作為胃癌新的治療靶點。 并發現NOXO1與胃癌治療靶點VEGFA 呈正相關。 有趣的是,該研究發現NOXO1 可調節B 細胞、M0 巨噬細胞、M1 巨噬細胞和M2 巨噬細胞的浸潤,這可能影響胃癌患者惡的預后。這項研究不僅填補了胃癌分子機制研究的空白,而且為胃癌靶向治療的探究提供新的思路。

