雙酶水解魚鱗蛋白制備ACE抑制肽的工藝優化研究
苑園園 劉 暢 王燚欣 宋曉鑫
(衡水學院生命科學學院 河北 衡水 053000)
現代醫學研究表明,血管緊張素轉化酶(An-giotensin I-converting enzyme,ACE)是導致高血壓的主要因素之一[1]。ACE是人體組織和體液中發現的一種含鋅的二肽羧基肽酶,能夠對血壓起到一定的調控作用,血管緊張素Ⅰ可以在人體內經過ACE的催化作用轉化為可以使血管收縮并使血壓升高的血管緊張素Ⅱ[2]。
我國水資源豐富,在魚類產品生產加工過程中產生了很多下腳料,其中15%左右都是魚鱗[3],據不完全統計,我國每年廢棄的魚鱗達30萬t,魚鱗中蛋白質的含量高達50%~70%[4,5],是非常好的生物資源。
目前制備ACE抑制肽多為單一蛋白酶水解,很少模擬胃腸道系統的酶解過程,而經其他酶水解得到的ACE抑制肽在人體消化吸收過程中,由于胃蛋白酶和胰蛋白酶的作用,其氨基酸序列有可能會發生變化,進而導致ACE抑制能力的變化[6]。因此本試驗選取的雙酶模擬胃腸道消化系統對魚鱗的酶解作用,可能將制備出更高活性的ACE抑制肽[7]。
1 材料與方法
1.1 材料與試劑
1.1.1 材料。新鮮豬肺:衡水市萬德福超市;新鮮鯉魚魚鱗:衡水市桃城區人民橋水產開發市場。
1.1.2 主要試劑。鹽酸(36.0%~38.0%):煙臺遠東精細化工有限公司;四硼酸鈉:天津市河東區紅巖試劑廠;乙酸乙酯(AR):天津市大茂化學試劑廠;硼酸(AR):天津市紅巖化學試劑廠;胰蛋白酶:河南萬邦實業有限公司;胃蛋白酶:河南萬邦實業有限公司;馬尿酰組氨酰亮氨酸:上海麥克林生化科技有限公司;甘氨酸:天津市大茂化學試劑廠。
1.2 儀器與設備。ST3100型pH計:奧豪斯儀器(常州)有限公司;BGZ-30型電熱鼓風干燥箱:上海博訊實業有限公司醫療設備廠;DS-1型高速組織搗碎機:上海標本模型廠;Alpha 1-4/2-4 LD Plus德國Christ真空冷凍干燥機:北京五洲東方科技發展有限公司廣州分公司;A11型研磨機:艾卡(廣州)儀器設備有限公司;UV-5500型紫外可見分光光度計:上海元析儀器有限公司;TGL-16M型離心機:湖南湘儀實驗室儀器開發有限公司。
1.3 方法
1.3.1 ACE粗酶的制備。新鮮的豬肺冷藏10 h左右,將黏膜、脂肪和氣管切除,將切好的豬肺放入高速組織搗碎機中,之后間歇性勻漿5min,保證比例,每5g的豬肺加入6 ml的硼酸緩沖溶液(pH值8.3,0.1 mol/L),4℃,8 000 r/min離心15 min,收集上清液冷凍干燥備用[8]。
1.3.2 脫鈣魚鱗粉的制備。收集新鮮的鯉魚魚鱗,用清水洗凈,去除非魚鱗物質,洗凈后50℃烘干2 h;將烘干后的魚鱗用10%(w/v)NaCl溶液5℃浸泡24 h,換液1次[9],50℃烘干2 h;干燥后的魚鱗用0.4 mol/L的HCl溶液以料液比為1∶15(w/v)浸泡90 min進行脫鈣[10],用清水洗凈后再次放入烘箱50℃烘干2 h,放入研磨機打碎得到魚鱗粉冷藏備用。
1.3.3 魚鱗酶解物的制備。取適量脫鈣魚鱗粉溶于酶的緩沖液中,調節整體的pH值在酶的最適范圍內,加酶進行酶解,當酶解反應完成后應立即沸水浴15 min,保證酶徹底失活,待整個反應體系冷卻后離心15 min(10℃,4 000 r/min),取上清液[11]。
1.3.4 ACE抑制率測定。本次試驗采用紫外分光光度法[12]測定ACE抑制率,取酶解物上清液作為ACE抑制肽,將馬尿酰組氨酰亮氨酸(hippuryl-histidyl-leucine,HHL)溶于0.1 mol/L(pH值8.3,含Na-Cl)的硼酸鹽緩沖液配成濃度為12.5 mmol/L的底物,先取50μL底物于1.5 ml離心管中,再加入20μLACE抑制肽,兩者混勻后放入水浴鍋37℃保持5 min,接著再取40μLACE溶液于離心管中,放入水浴鍋37℃保持30 min,最后加入200μLHCl(1 mol/L)終止整個反應,離心管中加入1 ml預冷過的乙酸乙酯,混合后放入離心機4 000 r/min離心15 min,吸取上層澄清液體750νL到試管中,烘箱內120℃烘干15 min,使溶劑全部揮發,冷卻后向試管中加入3 ml的蒸餾水以溶解試管中的馬尿酸,混勻1 min后用紫外可見分光光度計在波長為228 nm下測定溶液的吸光值,計算公式:ACE抑制率(%)=×100%;式中:A為加入ACE抑制劑的吸光度;B為ACE與HHL反應的吸光度;C為空白反應的吸光度。
1.4 胃蛋白酶提取條件的單因素試驗及正交試驗優化1.4.1單因素試驗。稱取5份脫鈣后的魚鱗粉,料液比分別為1∶10(g/ml)、1∶15(g/ml)、1∶20(g/ml)、1∶25(g/ml)、1∶30(g/ml),利用胃蛋白酶緩沖液調節pH值為2.0,溫度控制在37℃,分別調節胃蛋白酶的添加量在2%、4%、6%、8%、10%的條件下,酶解1 h、2 h、3 h、4 h、5 h,以ACE抑制率為評價指標,考察酶解時料液比、胃蛋白酶的添加量、酶解時間對魚鱗ACE抑制率的影響。
1.4.2 正交試驗優化。根據單因素試驗結果,設計L9(34)的正交試驗,見表1。

表1 胃蛋白酶酶解脫鈣魚鱗粉正交試驗因素水平表
1.4.3 胰蛋白酶提取條件的單因素試驗優化。利用胰蛋白酶緩沖液將胃蛋白酶酶解液pH值調節為8.0,溫度控制在40℃,分別調節胰蛋白酶的添加量在2%、4%、6%、8%、10%的條件下,酶解1 h、2 h、3 h、4 h、5 h,以ACE抑制率為評價指標,考察酶解時料液比、胰蛋白酶的添加量、酶解時間對魚鱗ACE抑制率的影響。
2 結果與分析
2.1 胃蛋白酶酶解的單因素試驗結果分析
2.1.1 酶的添加量對酶解產物ACE抑制率的影響。如圖1,當胃蛋白酶添加量增高,ACE抑制率升高,酶的添加量達到6%時,ACE抑制率最高,酶的添加量繼續增加,抑制率反而降低。當酶過少時,酶與底物結合的幾率很小,抑制率較低,加酶量到達一定程度時,酶與反應體系中的底物全部結合,抑制率達到最大值,但加酶量過多時就會影響底物與之結合,從而導致抑制率降低。因此,酶的添加量為6%時,魚鱗蛋白的酶解產物ACE抑制率最高,為57.6%。
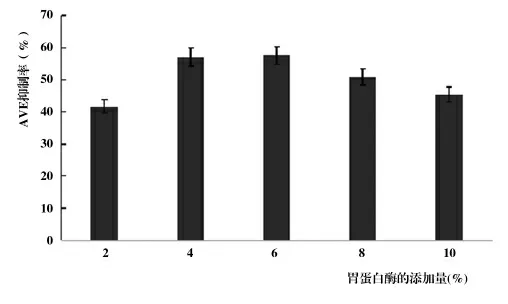
圖1 不同胃蛋白酶的添加量下酶解產物的抑制率
2.1.2 料液比對酶解產物ACE抑制率的影響。如圖2,料液比增大的同時ACE抑制率也增大,當增加到1∶40時達到最大,隨后抑制率降低。當料液比高時,酶解體系比較濃稠,ACE抑制率降低[13]。因此,當料液比為1∶40時,魚鱗蛋白的酶解產物ACE抑制率最高,為67.18%。
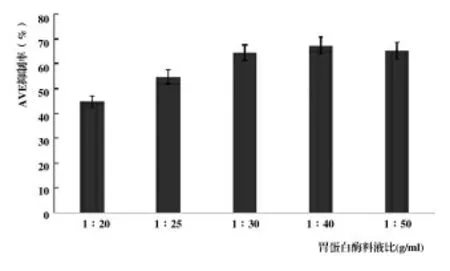
圖2 不同料液比下酶解產物的抑制率
2.1.3 酶解時間對酶解產物ACE抑制率的影響。如圖3,酶解開始時,ACE抑制肽逐漸釋放其活性,ACE抑制率隨酶解時間的增加而升高,酶解時間為2 h時ACE抑制率最高,時間持續過長則會適得其反,ACE抑制肽會被酶解喪失活性,ACE抑制率降低[14,15]。因此,當水解時間為2 h時,魚鱗蛋白的酶解產物ACE抑制率最高,為79.7%。
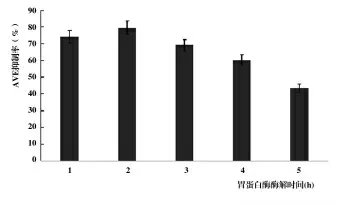
圖3 不同酶解時間下酶解產物的抑制率
2.2 胃蛋白酶酶解魚鱗蛋白正交實驗優化。由表2可知,料液比、酶的添加量、酶解時間這3個因素對ACE抑制率都會產生影響,在9個試驗結果中,以試驗2、試驗8、試驗9的結果最好,ACE抑制率基本達到70%以上,最佳方案為A1B3C2,即料液比1∶50,酶的添加量4%,酶解時間2 h,該組合并未出現在正交表中,所以進行驗證試驗,在此條件下,經3次平行試驗后測得ACE抑制率為84.89%。通過比較R值可以看出,酶解時間對ACE抑制率的影響最顯著。由表3的F值大小可看出,這3個因素的影響主次順序為:C>B>A。
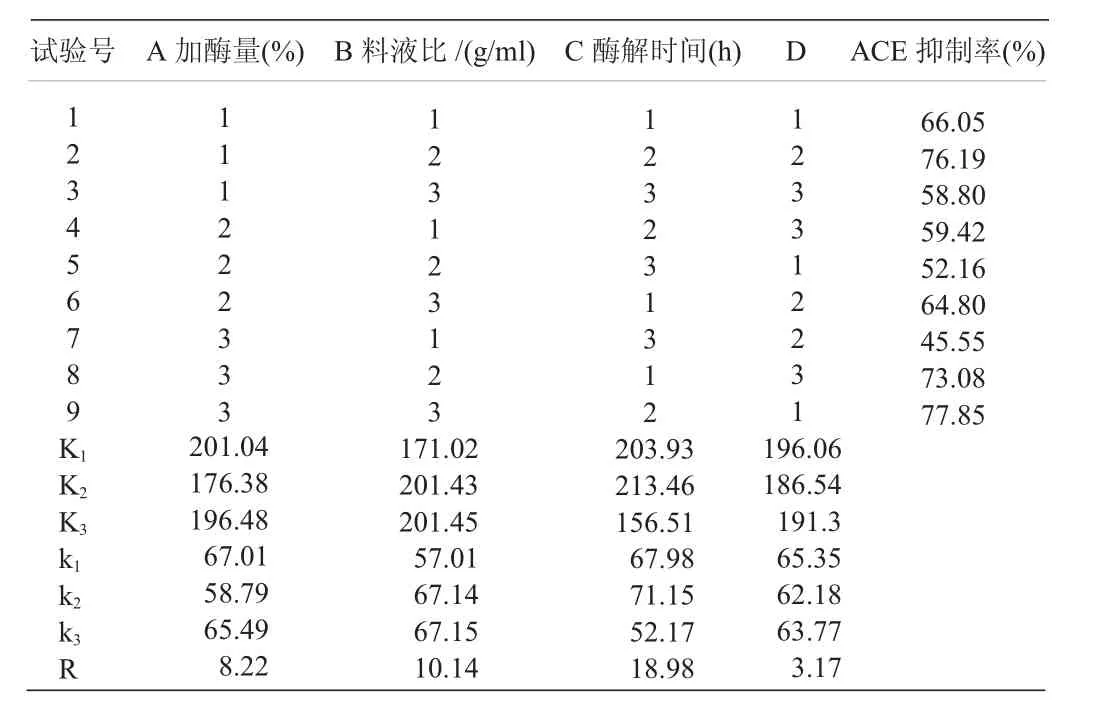
表2 胃蛋白酶酶解脫鈣魚鱗粉正交試驗結果數據

表3 胃蛋白酶酶解脫鈣魚鱗粉正交試驗結果方差分析
2.3 胰蛋白酶酶解的單因素試驗結果分析
2.3.1 酶的添加量對酶解產物ACE抑制率的影響。如圖4,酶的添加量較少時,酶與底物結合機會較少,形成的產物較少;ACE抑制率隨著加酶量的增加而升高,酶的添加量增加到一定程度而底物不變時,酶可以與底物完全結合,酶的添加量達到6%時,ACE抑制率最大;再增加胰蛋白酶的添加量時,可能會因為反應體系已飽和而降低酶與底物的結合率導致ACE抑制率逐漸降低。因此,當酶的添加量為6%時,魚鱗蛋白的酶解產物ACE抑制率最高,為92.13%。

圖4 不同酶的添加量下酶解產物的抑制率
2.3.2 酶解時間對酶解產物ACE抑制率的影響。如圖5,當酶解時間過長時,產生的活性產物可能會被酶解,導致抑制率下降。當酶解時間為2 h時魚鱗蛋白的酶解產物ACE抑制率最高,為93.37%。
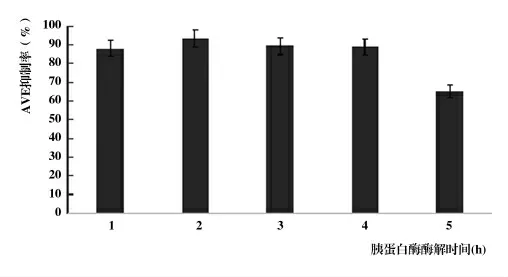
圖5 不同酶解時間下酶解產物的抑制率
3 結論與討論
以脫鈣后的鯉魚魚鱗蛋白為原料,通過單因素試驗及正交試驗證明,以胃蛋白酶酶解脫鈣魚鱗粉制備ACE抑制肽,當酶的添加量8%、料液比1∶50(g/ml)、酶解時間2 h時,ACE抑制率為84.89%。以胰蛋白酶酶解脫鈣魚鱗粉制備ACE抑制肽,當酶的添加量為6%、酶解時間為2 h時,ACE的抑制率為93.37%。結果表明先用胃蛋白酶酶解,再用胰蛋白酶進行酶解,最終得到的ACE抑制肽不會受人體胃腸道的影響。

