微創不同深度分次大劑量肺表面活性物質治療早產兒呼吸窘迫綜合征的價值研究
畢雷 黃培祿 閉雪蘭
【摘要】 目的:探究微創不同深度分次大劑量肺表面活性物質治療早產兒呼吸窘迫綜合征的價值。方法:選取欽州市婦幼保健院2020年3月-2021年4月60例早產兒呼吸窘迫綜合征患兒為研究對象,以隨機數字表法分為對照組、觀察組,各30例。對照組應用肺表面活性物質常規方式給藥治療,觀察組應用持續呼吸道正壓通氣下微創微管不同深度分次大劑量肺表面活性物質治療。比較兩組患兒給藥前及給藥后1、12 h呼吸功能[吸入氧氣濃度分數(FiO2)、呼氣末正壓(PEEP)]、并發癥(血氧飽和度下降、藥物反流、心動過緩、顱內出血、氣胸、支氣管發育不良)發生率、死亡率、預后情況(用藥后12 h胸片Ⅱ級以上、二次使用肺表面活性物質、72 h內有創機械通氣占比)、康復指標(用氧時間、住院時間、住院費用)。結果:給藥前,兩組PEEP、FiO2水平比較,差異均無統計學意義(P>0.05);給藥后1、12 h,觀察組PEEP、FiO2水平均較對照組更低(P<0.05);觀察組并發癥發生率為13.33%,較對照組40.00%更低(P<0.05);觀察組死亡率為0,與對照組3.33%比較,差異無統計學意義(P>0.05);觀察組用藥后12 h胸片Ⅱ級以上、二次使用肺表面活性物質、72 h內有創機械通氣占比分別為13.33%、3.33%、3.33%,均較對照組的36.67%、26.67%、20.00%更低(P<0.05);觀察組用氧時間、住院時間均較對照組更短,住院費用較對照組更低(P<0.05)。結論:對于早產兒呼吸窘迫綜合征患兒,應用微創不同深度分次大劑量肺表面活性物質治療,可改善其呼吸功能、改善肺功能狀態、降低二次肺表面活性物質使用頻率、縮短康復用時,降低并發癥發生率。
【關鍵詞】 早產兒呼吸窘迫綜合征 肺表面活性物質 給藥方式
Study on the Value of Minimally Invasive Treatment of Respiratory Distress Syndrome in Preterm Infants with High-dose Pulmonary Surfactant in Different Depths/BI Lei, HUANG Peilu, BI Xuelan. //Medical Innovation of China, 2022, 19(07): 00-005
[Abstract] Objective: To explore the value of minimally invasive treatment of respiratory distress syndrome (RDS) in premature infants with high-dose pulmonary surfactant in different depths. Method: From March 2020 to April 2021, 60 cases of premature infants with respiratory distress syndrome in Qinzhou Maternal and Child Health Hospital were selected as the research objects. They were randomly divided into control group and observation group, with 30 cases in each group. The control group was treated with conventional administration of pulmonary surfactant, and the observation group was treated with high-dose pulmonary surfactant at different depths with minimally invasive microtubules under continuous positive airway pressure ventilation. The respiratory function [fractional inspired oxygen concentration (FiO2), positive end expiratory pressure (PEEP)] before and 1 h and 12 h after administration, the incidence of complications (decrease of blood oxygen saturation, drug reflux, bradycardia, intracranial hemorrhage, pneumothorax and bronchial dysplasia), mortality, prognosis (proportion of chest radiograph above grade Ⅱ 12 h after administration, proportion of secondary use of pulmonary surfactant, proportion of invasive mechanical ventilation within 72 h), rehabilitation indicators (oxygen consumption time, hospitalization time and hospitalization expenses) were compared between the two groups. Result: Before administration, there were no significant differences in the levels of PEEP and FiO2between the two groups (P>0.05); 1 and 12 h after administration, the levels of PEEP and FiO2in the observation group were lower than those in the control group (P<0.05); the incidence of complications in the observation group was 13.33%, which was lower than 40.00% in the control group (P<0.05); the mortality of the observation group was 0, there was no significant difference compared with 3.33% of the control group (P>0.05); the proportion of chest radiograph above grade Ⅱ 12 h after administration, secondary use of pulmonary surfactant and invasive mechanical ventilation within 72 h in the observation group were 13.33%, 3.33% and 3.33% respectively, which were lower than 36.67%, 26.67% and 20.00% in the control group (P<0.05); compared with the control group, the oxygen consumption time and hospitalization time of the observation group were shorter, and the hospitalization expenses of the observation group were lower (P<0.05). Conclusion: For premature infants with respiratory distress syndrome, the application of minimally invasive treatment with high-dose of pulmonary surfactant in different depths can improve its respiratory function, improve the state of pulmonary function, reduce the frequency of secondary use of pulmonary surfactant, shorten the rehabilitation time, and reduce the incidence of complications.gzslib202204021530[Key words] Respiratory distress syndrome of premature infants Pulmonary surfactant Mode of administration
First-authors address: Qinzhou Maternal and Child Health Hospital, Guangxi, Qinzhou 535099, China
doi:10.3969/j.issn.1674-4985.2022.07.001
隨著近年來二胎政策開放,二胎高齡自然孕產婦、試管嬰兒輔助懷孕高齡產婦逐漸增多,早產兒出生率逐漸上升。受早產兒肺部功能發育狀態影響,早產兒呼吸窘迫綜合征發病率逐漸提升,死亡率較高[1]。肺表面活性物質(PS)不足為該病主要發病原因,需在輔助通氣治療基礎上聯合PS治療,以促進患兒肺功能發育,改善其肺功能狀態[2]。常規PS給藥方法為氣管插管-使用肺表面活性物質-拔管使用持續呼吸道正壓通氣(INSURE),但在給藥期間患兒自主呼吸暫停,可能會增加其肺功能損傷及有創呼吸機使用頻率。微創PS給藥可保證患兒治療期間呼吸功能穩定,但在PS大劑量給藥期間可能會發生藥物反流、氣道堵塞等情況,因此目前在微創PS給藥中多為小劑量給藥,但難以滿足臨床治療需求[3]。為保證給藥效果、避免藥物不良反應,考慮使用大劑量分次給藥以滿足治療效果,但目前關于微創不同深度分次PS給藥研究較少。為此,本次研究選取欽州市婦幼保健院2020年
3月-2021年4月60例早產兒呼吸窘迫綜合征患兒為研究對象,探究微創不同深度分次PS給藥臨床價值。
1 資料與方法
1.1 一般資料 選取本院2020年3月-2021年4月60例早產兒呼吸窘迫綜合征患兒為研究對象,以隨機數字表法分為對照組、觀察組,各30例。納入標準:(1)均符合早產兒呼吸窘迫綜合征診斷標準[4];(2)無嚴重先天性疾病;(3)孕婦未使用過糖皮質激素治療;(4)患兒血流動力學穩定。排除標準:(1)合并嚴重呼吸、循環等系統障礙,需接受持續性機械通氣治療;(2)出生后即實施氣管內插管;(3)使用PS后仍需氣管內插管輔助通氣時間≥6 h;(4)研究期間退出。該研究經醫院倫理委員會批準。患兒家長對研究知情同意。
1.2 方法 PS(商品名:固爾蘇,生產廠家:意大利凱西制藥公司,批準文號:注冊證號H20080429,規格:1.5 mL︰120 mg)用藥劑量標準為200 mg/kg;給藥前藥品預熱,以5 mL無菌注射器抽取全部藥物后備用;給藥前清理呼吸道,保持呼吸道通暢。對照組(肺表面活性物質常規方式給藥治療):仰臥位,直接喉鏡暴露聲門,插入氣管導管,確定導管位置(插入深度為剛到氣管插管下口)后,使用膠布將導管與患兒上唇固定,接復蘇囊正壓通氣,將已抽取好藥物的注射器連接5.5號頭皮針,以30°~40°刺入氣管插管內,沿氣管插管下行繼續進針至針頭2/3或完全進入,緩慢推注PS,同時予復蘇囊正壓通氣。給藥完畢后再予復蘇囊正壓通氣5 min,拔除氣管導管,重新予經鼻持續氣道正壓通氣(nCPAP)輔助通氣。觀察組采用微創不同深度分次PS給藥:使用6FG胃管給藥,患兒始終保持在nCPAP無創輔助通氣下,取仰臥位,用無菌剪剪掉有側孔的胃管前端4 cm,將胃管與吸取豬肺表面活性物質的注射器連接;直接喉鏡暴露聲門,使用Magill鉗將胃管插入聲門,確認插管深度(插入深度為剛到氣管插管下口+1.5 cm),并在上唇固定,移除喉鏡,保持患兒口閉合以保證nCPAP的呼氣末正壓維持在6 cmH2O及以上;將已抽取好藥物的注射器連接在胃管末端,1 min內緩慢推注一半劑量的PS(100 mg/kg),向外退出一部分胃管,使其深度為氣管插管下口時,以45°左側臥位1 min內緩慢推注剩余一半劑量的PS,用注射器推1 mL空氣到胃管以確保藥物完全注入氣管內。藥物注射完后,拔除胃管,繼續nCPAP無創輔助通氣。兩組患兒給藥后,若吸入氧氣濃度分數(FiO2)>0.5時癥狀無明顯緩解或持續加重,或頻繁呼吸暫停,或血氧飽和度不能維持88%以上,則間隔6~12 h二次給藥,用藥劑量不變。
1.3 觀察指標及評價標準 (1)比較兩組給藥前、給藥后1、12 h呼吸功能,包括FiO2、呼氣末正壓(PEEP);(2)比較兩組出生后28 d期間并發癥發生率,包括血氧飽和度下降、藥物反流、心動過緩、顱內出血、氣胸、支氣管發育不良發生率;(3)比較兩組出生后28 d期間死亡率;(4)比較兩組預后情況,包括用藥后12 h胸片Ⅱ級(支氣管充氣征,背景為彌漫性不張肺泡,可見清晰充氣樹枝狀支氣管影)以上、二次使用肺表面活性物質、72 h內有創機械通氣占比;(5)比較兩組康復指標,包括用氧時間、住院時間、住院費用。
1.4 統計學處理 研究數據以SPSS 24.0統計分析,以(x±s)、率(%)表示計量、計數資料,采用t、χ2檢驗;當P<0.05時,則組間比較差異有統計學意義。
2 結果
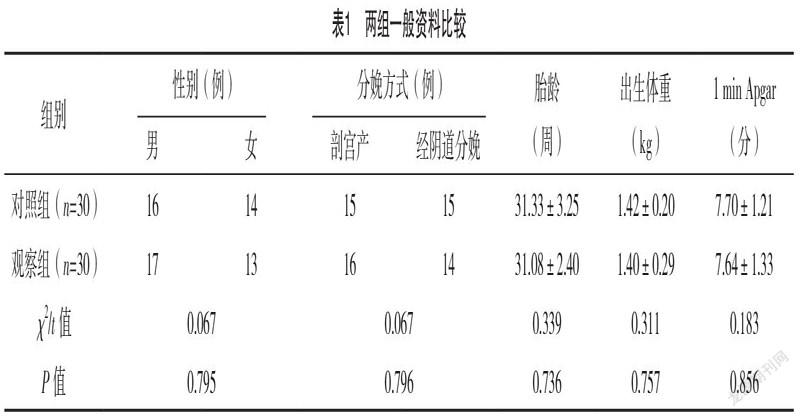
2.1 兩組一般資料比較 兩組間一般資料相近,差異均無統計學意義(P>0.05),具有可比性,見表1。
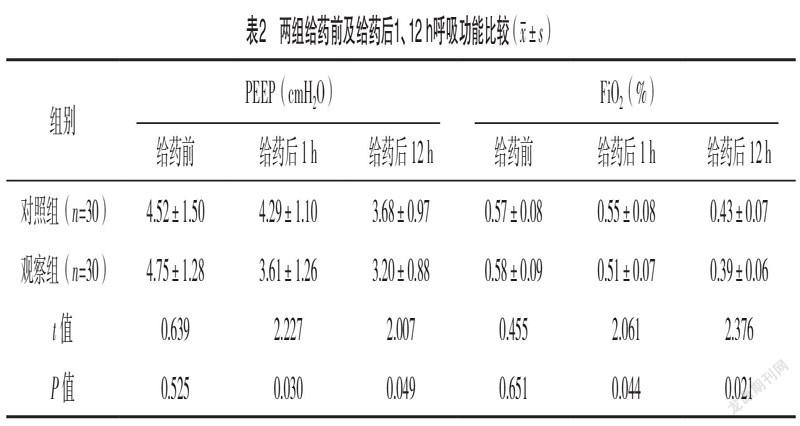
2.2 兩組給藥前及給藥后1、12 h呼吸功能比較 給
藥前,兩組PEEP、FiO2水平比較,差異均無統計學意義(P>0.05);給藥后1、12 h,觀察組PEEP、FiO2水平均較對照組更低(P<0.05)。見表2。
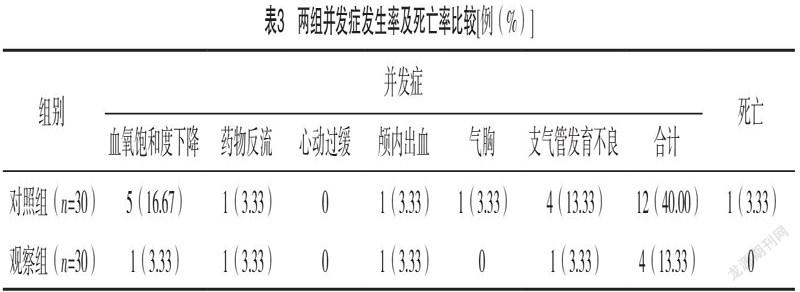
2.3 兩組并發癥發生率及死亡率比較 觀察組并發癥發生率為13.33%,較對照組40.00%低(χ2=5.455,P=0.020);觀察組死亡率為0,與對照組3.33%比較,差異無統計學意義(χ2=1.017,P=0.313)。見表3。gzslib2022040215302.4 兩組預后情況比較 觀察組用藥后12 h胸片Ⅱ級以上、二次使用肺表面活性物質、72 h內有創機械通氣占比分別為13.33%、3.33%、3.33%,均較對照組的36.67%、26.67%、20.00%更低(P<0.05),見表4。
2.5 兩組康復指標比較 觀察組用氧時間、住院時間均較對照組更短,住院費用較對照組更低(P<0.05),見表5。
3 討論
PS為肺泡Ⅱ型上皮細胞分泌的脂蛋白,分布于肺泡液體分子層表面,具降低肺泡表面張力、減少吸氣阻力,防止肺萎縮及肺不張[5-6]。在對早產兒呼吸窘迫綜合征患兒治療中,應用機械通氣治療輔助呼吸同時應用PS,可改善患兒自主通氣能力,促進其肺功能恢復,縮短其康復時間,改善預后[7-8]。
INSURE為早產兒呼吸窘迫綜合征主要治療方法,但在治療期間由于需要氣管插管、正壓通氣,影響患兒穩定呼吸功能狀態,影響患兒自主呼吸與呼吸機運動同步性,增加患兒未成熟肺組織及呼吸道黏膜損傷,增加后期支氣管肺發育不良發生風險[9]。微創PS給藥可在患兒持續性通氣狀態下完成給藥,與INSURE相比,可避免影響患兒呼吸節律性,保持其呼吸頻率穩定,降低其肺功能損傷[10-11];但在微創PS給藥期間,小劑量PS可靠無創呼吸機壓力及自主呼吸將藥物送入氣道,但大劑量給藥時,受無創呼吸機壓力微弱,藥物送入氣道難度較大,且易誘發氣道堵塞、藥物反流,引發呼吸暫停,影響給藥質量,影響患兒自主通氣恢復能力[12];同時相同深度微管一次注入大劑量PS時可能會誘發血氧飽和度下降、顱內出血、腦室周圍白質軟化等并發癥[13]。小劑量給藥可降低藥物反流、氣道堵塞風險,但PS小劑量用藥難以滿足臨床治療需求[14]。
微創不同深度分次PS給藥,主要目的為,在第一次深度時在右支氣管內使用半量藥物,可保證給藥時左側支氣管通暢性,避免發生完全氣道堵塞;第二次給藥時,采用正常氣管插管深度,此時PS給藥劑量為一般用藥劑量,屬小劑量用藥,可提升給藥安全性,保證患兒在用藥治療期間處于氣道通暢狀態,避免因氣道堵塞發生心動過緩、血氧飽和度下降等情況,同時可保證PS給藥總劑量,滿足藥物劑量需求,促進患兒肺功能恢復[15-16]。
本次研究中,對觀察組患兒實施微創不同深度分次PS給藥治療,與常規給藥方式相比,給藥后1、12 h PEEP、FiO2水平顯著低于對照組,考慮原因為,患兒呼吸功能紊亂狀態下,會出現呼吸淺快、肺部通氣能力下降、血氧飽和度下降情況;應用微創不同深度分次PS給藥治療,可幫助患兒在穩定呼吸運動狀態下接受PS治療,并通過不同深度分次給藥,可在滿足PS給藥劑量同時,不影響患兒肺部通氣能力,可幫助患兒穩定恢復其肺功能,達到降低PEEP、FiO2之效[17]。研究結果發現,觀察組并發癥發生率較對照組低,死亡率均與對照組相近,考慮原因為,在應用微創不同深度分次PS給藥治療,可避免單次大劑量給藥時對患兒通氣能力影響,減少因氣道堵塞引發的并發癥發生率,并隨患兒通氣質量改善,可進一步減少顱內出血、腦室周圍白質軟化發生率,降低并發癥發生率;但本次研究結果未見兩組患兒死亡率之間差異性,考慮原因可能與病例數量較少有關[14,18]。研究結果發現觀察組用藥后12 h胸片Ⅱ級以上、二次使用肺表面活性物質、72 h內有創機械通氣占比均較對照組低,且康復指標均優于對照組,考慮原因為,在觀察組患兒治療期間,可維持其肺功能穩定,促進患兒肺部功能發育,改善患兒肺功能,減少PS治療次數,縮短機械通氣時間及住院治療時間,達到改善預后之效[19]。
綜上,在早產兒呼吸窘迫綜合征治療中,應用微創不同深度分次PS給藥治療,與應用INSURE治療相比,可改善患兒呼吸功能、降低并發癥發生率、縮短康復用時、降低二次肺表面活性物質使用頻率,效果顯著。
參考文獻
[1]閆俊梅,黃輝,李倩倩,等.2007-2016年極低和超低出生體質量兒921例臨床回顧性分析[J].兒科藥學雜志,2019,25(2):17-21.
[2]劉慧強,劉芳,暴麗莎,等.微創應用肺表面活性物質治療早產兒呼吸窘迫綜合征的多中心臨床研究[J].中華兒科雜志,2020,58(5):374-380.
[3]田靜,張煥新,田金徽,等.不同劑量牛肺表面活性劑治療新生兒呼吸窘迫綜合征療效的薈萃分析[J].藥學服務與研究,2019,19(4):275-279.
[4]曹芳.歐洲早產兒呼吸窘迫綜合征治療共識指南——2010年更新版[J].安徽醫藥,2010,14(12):1525-1530.
[5]楊楠,崔紅,徐俊梅.呼吸窘迫綜合征早產兒發生支氣管肺發育不良的危險因素及呼吸道疾病隨訪分析[J].中國兒童保健雜志,2019,27(10):60-63.
[6]田夏,朱賀,韓晟.動物源性肺表面活性劑治療新生兒呼吸窘迫綜合征的Meta分析[J].臨床藥物治療雜志,2020,18(11):27-31.
[7]曹文才.牛肺泡表面活性劑聯合大劑量氨溴索治療新生兒呼吸衰竭的療效研究[J].藥物評價研究,2019,42(3):537-540.
[8]林玲,彭好.肺泡表面活性物質在新生兒呼吸窘迫綜合征中的微創應用[J].中華實用兒科臨床雜志,2019,34(23):1834-1837.
[9]張馨月.早期或延遲使用持續氣道正壓通氣對早產兒呼吸窘迫的影響:Cochrane系統綜述[J].中華圍產醫學雜志,2021,24(2):146.
[10]余鵬程,黃曉群.HFOV聯合牛肺表面活性劑對新生兒胎糞吸入綜合征血氣指標的影響[J].中國實用醫藥,2019,14(36):15-18.
[11]邱靜,尹彬,劉漢玲,等.大劑量注射用牛肺表面活性劑聯合BiPAP通氣對新生兒呼吸窘迫綜合征氧合指數及機械通氣的影響[J].海南醫學,2019,30(3):345-349.
[12]周陳榮,徐巧嵐,劉立銘,等.經細導管注入固爾蘇聯合氣道正壓通氣治療早產兒呼吸窘迫綜合征的療效研究[J].中國醫學裝備,2019,16(1):83-87.
[13]郭明,尚志忠,孫娟,等.微創肺表面活性物質治療早產兒呼吸窘迫綜合征的隨機對照研究[J].中國小兒急救醫學,2021,28(4):316-320.
[14]林薔,黎巧茹,陳簡.不同劑量肺表面活性物質對晚期早產/足月新生兒呼吸窘迫綜合征患兒的臨床研究[J].中國臨床藥理學雜志,2020,36(6):20-22.
[15]高繼生,李軍,王偉,等.肺表面活性物質聯合BiPAP對早產兒呼吸窘迫綜合征患兒血清HMGB-1、MIF-1及BMP-7的影響[J].現代生物醫學進展,2019,19(23):106-109,133.
[16]馬俊苓,寧超,田秀英,等.侵入性較小的肺表面活性物質使用技術治療早產兒呼吸窘迫綜合征研究進展[J].中華實用兒科臨床雜志,2019,34(16):1273-1276.
[17]周鎮光,張勇明,汪桂美.珂立蘇聯合鼻塞持續氣道正壓通氣治療新生兒呼吸衰竭的臨床分析[J].中國現代藥物應用,2019,13(17):1-3.
[18]張佩,夏世文,祝華平,等.經胃管微創注入肺表面活性物質技術治療新生兒呼吸窘迫綜合征的效果[J].中國醫藥導報,2020,17(6):101-104,120.
[19]陳云,陳信.微創肺表面活性物質運用技術治療早產兒呼吸窘迫綜合征療效觀察[J].中華全科醫學,2020,18(3):22-24,58.

