尼莫地平對顱腦損傷模型大鼠早期血管生成的影響及其機制研究*
高繼英,石代樂,王鵬飛,李永,張玉,喬建新,張秀峰,劉春江,劉熙鵬
(河北北方學院附屬第一醫院1.神經外科高壓氧艙室,2.神經外科,3.醫學影像中心,河北張家口075000)
顱腦損傷是一種常見創傷,其神經功能恢復關系到患者預后及生活質量[1]。血管新生是顱腦損傷后神經功能修復的重要部分,早期血管生成能改善局部供應血液,為腦組織提供營養物質,修復神經功能[2-3]。尼莫地平是一種二氫吡啶鈣通道拮抗劑,能有效透過血腦屏障。有研究顯示,尼莫地平能夠改善患者認知功能,推測其對腦部神經功能恢復具有一定作用[4-6]。目前,臨床上關于尼莫地平對顱腦損傷模型大鼠早期血管生成的研究較少,因此本研究通過復制顱腦損傷大鼠模型,探究尼莫地平對顱腦損傷模型大鼠早期血管生成的影響及其作用機制。
1 材料與方法
1.1 實驗動物
SPF 級、8 周齡、SD 雄性大鼠25 只,體重185~215 g,平均(200±15)g,購自北京斯貝福生物技術有限公司,實驗動物生產許可證號:SCXK(京)2019-0010,實驗動物使用許證號:SYXK(冀)2019-0040。
1.2 主要試劑與儀器
1.2.1 主要試劑尼莫地平(亞寶藥業集團股份有限公司,國藥準字H14022821,規格:20 mg),戊巴比妥鈉(上海橋星貿易有限公司,CAS 號:57-33-0),中性多聚甲醛(常州貝源鑫生物科技有限),大鼠CD34 免疫組織化學試劑盒(上海雅吉生物科技有限公司),大鼠低氧誘導因子lα(hypoxia inducible factor-lα, HIF-lα)、促血管生成素2(Angiopoietin-2,Ang-2)酶聯免疫試劑盒(上海一基實業有限公司),兔抗大鼠Akt、PI3K 及ERK1/2 單克隆抗體、山羊抗兔Akt、PI3K 及ERK1/2 二抗(上海酶研生物科技有限公司)。
1.2.2 主要儀器-80℃低溫冷藏箱(南京貝登醫療股份有限公司,型號:HD-86L830),離心機(深圳市瑞沃德生命科技有限公司,型號:M1324R),石蠟切片機(北京佳源興業科技有限公司,型號:HS-3315),電泳儀(上海土森視覺科技有限公司,型號:164-5056)。
1.3 方法
1.3.1 顱腦損傷模型大鼠的復制及分組隨機選取8 只大鼠作為對照組,其余大鼠復制顱腦損傷模型[7]。大鼠稱重后,均腹腔注射2% 戊巴比妥鈉(30 mg/kg)麻醉。根據自由落體打擊損傷法:剔除大鼠頂枕部毛,常規消毒后沿中線切開頭皮,分離軟組織,將顱骨暴露于視野中,在保證硬腦膜完整的前提下,于人字縫前約2 mm,中線旁約2 mm 處,做一直徑為4 mm 的圓形骨窗,采用小錘(致傷力度為25 g)于25 cm 高度下落,落于右側硬腦膜,造成顱骨損傷,用骨蠟封閉顱骨損傷區域,并縫合頭皮,觀察大鼠生命體征、角膜反射、肢回縮、后肢屈曲反射,以翻正反應出現、自行爬動作為模型復制成功。
模型復制過程中1 只大鼠死亡,其余大鼠隨機分為模型組和尼莫地平組,每組8 只。術后所有大鼠正常飼養,尼莫地平組給予1 mg/(kg·d)尼莫地平,連續灌胃7 d;對照組和觀察組給予等量生理鹽水。
1.3.2 標本采集及處理治療結束后,采集大鼠股動脈血5 ml,室溫下放置1 h,2 000 r/min 離心10 min,離心半徑10 cm,提取上清液,置入-80℃冰箱冷凍保存。所有大鼠用10%水合氯醛溶液進行麻醉,迅速斷頭處死,打開顱腔取腦,避免損傷腦組織與硬腦膜,將各組4 只大鼠右側腦組織置于4%中性多聚甲醛固定,用于CD34 免疫組織化學和蘇木精-伊紅(hematoxylin-eosin, HE)染色。取出另外4 只大鼠右側腦組織后,迅速置于液氮中10 min,然后于-80℃冷藏箱中保存,用于檢測蛋白相對表達量。
1.3.3 大鼠神經功能評分根據Zea-longa 評分[8],將大鼠行為分為8 個等級,評分為0~7 分,大鼠無不對稱活動為0 分;提尾后,大鼠右側前肢不能伸展完全為1 分;提尾后,前側右肢不能伸展完全同時活動障礙為2 分;大鼠右側前肢貼胸為3 分;大鼠活動時明顯向右轉彎為4 分;向右轉彎同時右側前爪向后拖地為5 分;原地右轉圈為6 分;無法站立,只能右側躺為7 分。
1.3.4 大鼠血管內皮細胞數及微血管密度(microvessel density, MVD)檢測取固定后的腦組織,脫水后石蠟包埋,將損傷部位及其周圍組織切片(厚4 μm),按照CD34 免疫組織化學試劑盒說明書進行染色,血管內皮細胞為淺棕或棕黃色的顆粒為CD34 陽性,單個內皮細胞為1 個血管單位,隨機選取5 個高倍視野,觀察并計算每個視野內皮細胞數和MVD[9]。
1.3.5 大鼠血清HIF-lα、Ang-2 水平檢測取上層血清,采用酶聯免疫吸附試驗(enzyme linked immunosorbent assay,ELISA)檢測血清HIF-lα、Ang-2水平,并嚴格按照HIF-lα、Ang-2 ELISA 試劑盒說明書進行操作[10]。
1.3.6 大鼠腦組織病理檢查取固定后的腦組織,脫水后石蠟包埋,切片約4 μm 厚,HE 染色后置于光鏡下,觀察大鼠腦組織病理學變化[11]。
1.3.7 Western blotting 檢測Akt/ERK 通路蛋白的表達取液氮保存的腦組織,研磨成勻漿后,加入裂解液,離心后取上清液進行蛋白濃度測定。加入上樣緩沖液后進行電泳,分離蛋白質,轉膜后采用脫脂奶粉室溫封閉1 h,分別加入兔抗鼠一抗,4℃孵育過夜,沖洗后,再加入羊抗兔二抗,室溫孵育1h,經ECL 顯影得到結果[12]。目的蛋白與β-actin 蛋白灰度值的比值為蛋白相對表達量。
1.4 統計學方法
數據分析采用SPSS 22.0 統計軟件。計量資料以均數±標準差(±s)表示,比較用方差分析,進一步兩兩比較用LSD-t檢驗。P<0.05 為差異有統計學意義。
2 結果
2.2 大鼠神經功能評分比較
對照組、模型組、尼莫地平組大鼠神經功能評分分別為(0.00±0.00)分、(4.42±0.61)分和(2.57±0.78)分,經方差分析,差異有統計學意義(F=120.607,P=0.000)。進一步兩兩比較結果:模型組、尼莫地平組高于對照組(P<0.05);且模型組高于尼莫地平組(P<0.05)。
2.2 大鼠血管內皮細胞數和MVD比較
對照組、模型組、尼莫地平組大鼠血管內皮細胞數和MVD 比較,經方差分析,差異有統計學意義(P<0.05)。進一步兩兩比較結果:模型組、尼莫地平組均多于對照組(P<0.05);且模型組均少于尼莫地平組(P<0.05)。見表1。
表1 3組大鼠血管內皮細胞數及MVD比較 (n=8,±s)
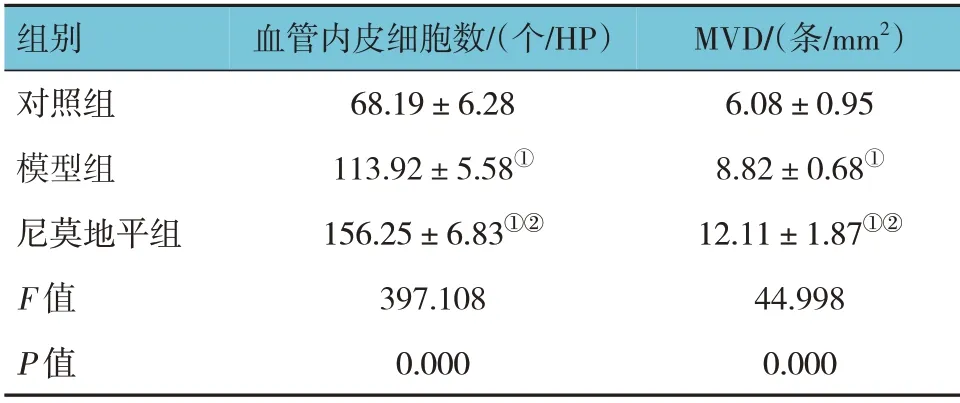
表1 3組大鼠血管內皮細胞數及MVD比較 (n=8,±s)
注:①與對照組比較,P <0.05;②與模型組比較,P <0.05。
組別對照組模型組尼莫地平組F 值P 值MVD/(條/mm2)6.08±0.95 8.82±0.68①12.11±1.87①②44.998 0.000血管內皮細胞數/(個/HP)68.19±6.28 113.92±5.58①156.25±6.83①②397.108 0.000
2.3 大鼠血清HIF-lα、Ang-2水平比較
對照組、模型組、尼莫地平組大鼠HIF-lα、Ang-2水平比較,經方差分析,差異有統計學意義(P<0.05)。進一步兩兩比較結果:模型組、尼莫地平組均高于對照組(P<0.05);且模型組均低于尼莫地平組(P<0.05)。見表2。
表2 3組大鼠血清HIF-lα、Ang-2水平比較(n=8,ng/mL,±s)
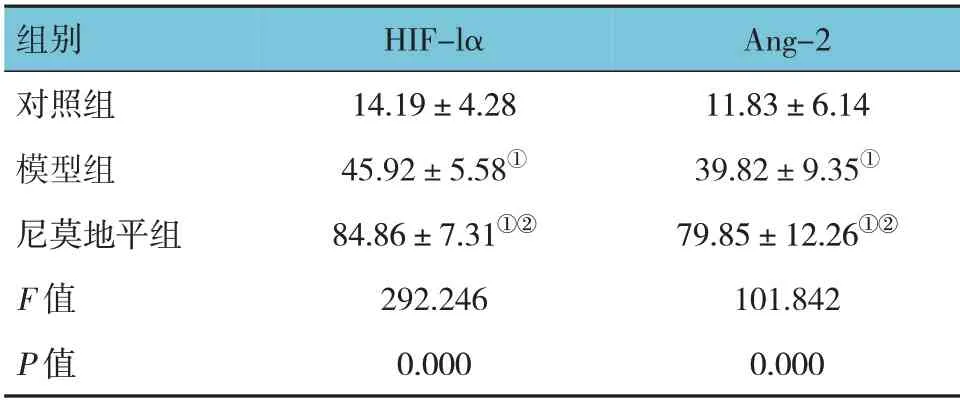
表2 3組大鼠血清HIF-lα、Ang-2水平比較(n=8,ng/mL,±s)
注:①與對照組比較,P <0.05;②與模型組比較,P <0.05。
組別對照組模型組尼莫地平組F 值P 值Ang-2 11.83±6.14 39.82±9.35①79.85±12.26①②101.842 0.000 HIF-lα 14.19±4.28 45.92±5.58①84.86±7.31①②292.246 0.000
2.4 大鼠腦組織的病理檢查結果
對照組腦組織結構完整,神經元細胞及神經纖維整齊排列。模型組損傷部位出現細胞和血管壞死,神經元細胞周圍腫脹,細胞間隙增大,部分神經元細胞凋亡,毛細血管腫脹,管壁結構部分破損。尼莫地平組腦組織部分神經細胞死亡,水腫減輕,神經細胞排列略微紊亂,部分細胞仍見細胞質凝集,局部可見血管著色密集。見圖1。
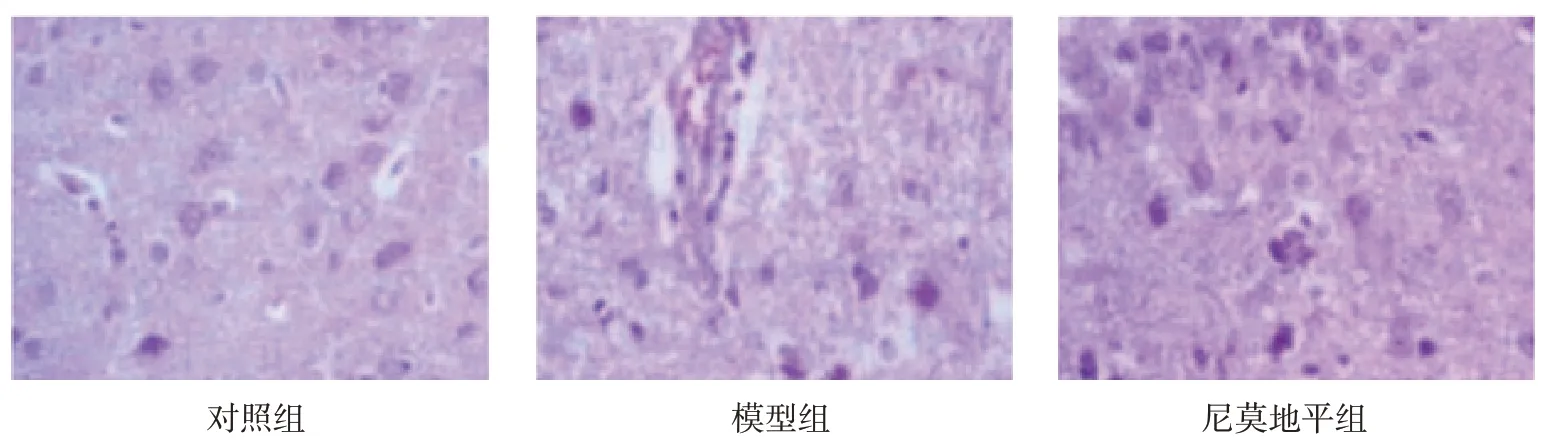
圖1 3組大鼠腦組織病理切片 (HE×400)
2.5 大鼠Akt/ERK通路蛋白相對表達量比較
對照組、模型組、尼莫地平組大鼠PI3K、pAkt/Akt、(pERK1/2)/(ERK1/2)蛋白相對表達量比較,經方差分析,差異有統計學意義(P<0.05)。進一步兩兩比較結果:模型組、尼莫地平組均高于對照組(P<0.05);且模型組均低于尼莫地平組(P<0.05)。見表3和圖2。
表3 3組大鼠Akt/ERK通路蛋白相對表達情況比較(n=8,±s)
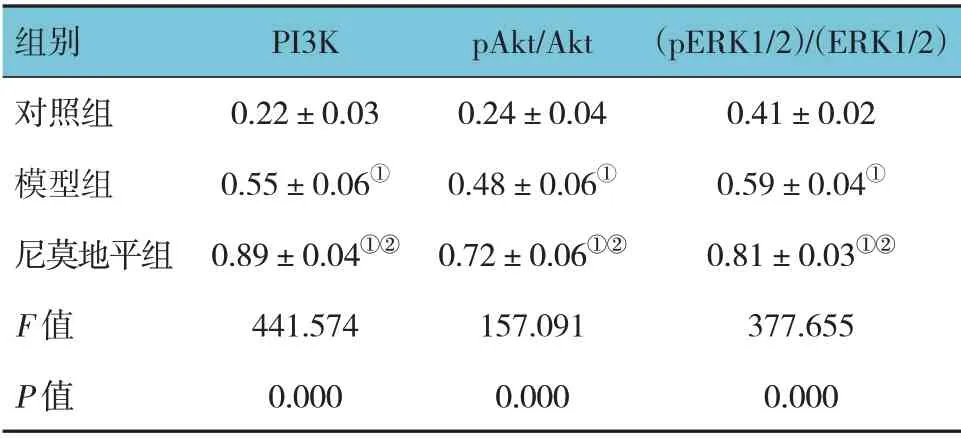
表3 3組大鼠Akt/ERK通路蛋白相對表達情況比較(n=8,±s)
注:①與對照組比較,P <0.05;②與模型組比較,P <0.05。
組別對照組模型組尼莫地平組F 值P 值(pERK1/2)/(ERK1/2)0.41±0.02 0.59±0.04①0.81±0.03①②377.655 0.000 PI3K 0.22±0.03 0.55±0.06①0.89±0.04①②441.574 0.000 pAkt/Akt 0.24±0.04 0.48±0.06①0.72±0.06①②157.091 0.000
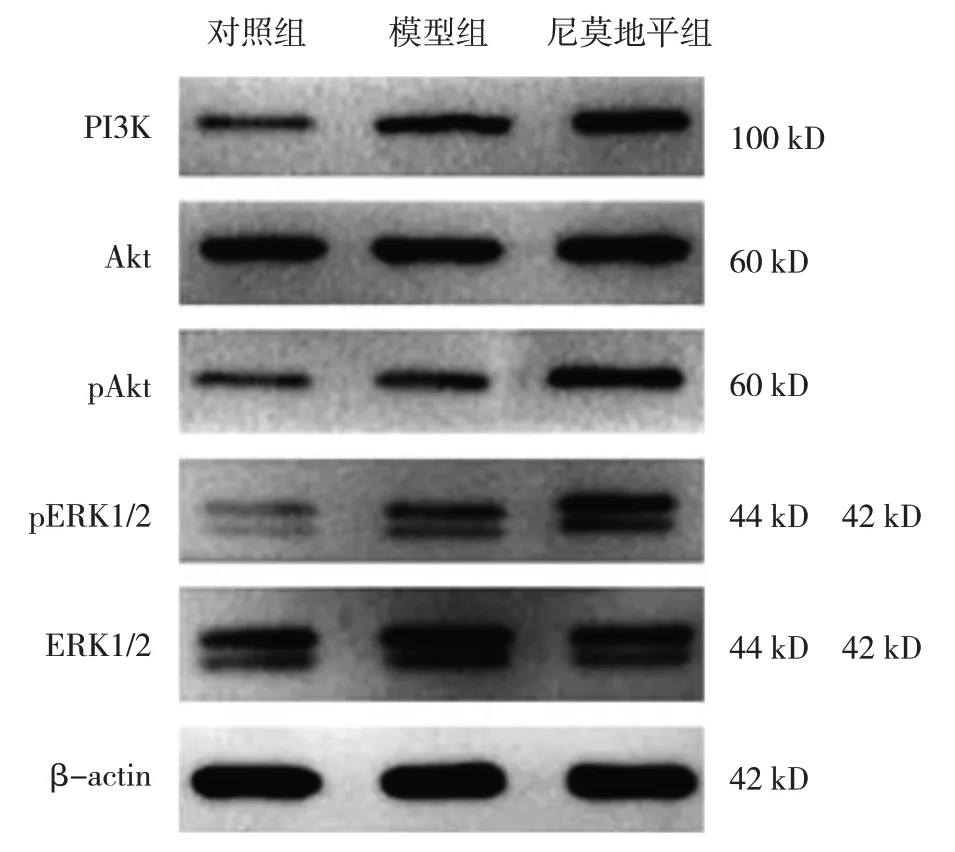
圖2 大鼠腦組織Akt/ERK通路蛋白的表達
3 討論
血管新生是顱腦損傷后神經功能修復的重要機制,能夠為受損區域的組織及細胞提供營養物質,改善血液循環,加速腦組織及神經功能的修復[13-14]。有研究顯示,血管生成與腦部損傷的預后有關,因此血管生成成為腦部疾病研究的新熱點[15]。治療性血管生成是指通過藥物促進血管生成[16]。尼莫地平一般用于改善急性腦血管病的血液循環,在早期血管生成方面研究較少,本研究通過復制顱腦損傷模型大鼠,探究尼莫地平通過Akt/ERK 通路對早期血管生成的影響,為顱腦損傷后的疾病恢復提供證據支持。
本研究對各組大鼠神經功能進行評估,通過神經修復體現血管新生情況,結果顯示模型組大鼠神經功能損傷,而尼莫地平對神經損傷具有一定的修復作用。內皮細胞數和MVD 能夠反映血管新生的強度,本研究中,模型組內皮細胞數和MVD 多于對照組,表明在顱腦損傷后,機體會形成部分新生血管,而尼莫地平組內皮細胞數和MVD 均多于對照組和模型組,提示在尼莫地平的作用下,血管的新生作用更強。
HIF-lα 為低氧誘導因子,在缺氧條件下能夠調節多種基因,具有改善能量代謝、減少腦組織及神經細胞受損的作用,同時HIF-lα 能促進血管生成。有研究證實,HIF-lα 對改善腦缺血再灌注的嚴重程度和預后有重要意義[17]。Ang 家族因子促進血管新生的作用更強,Ang-2 是Ang 家族因子中的一種分泌型因子[18]。相關研究表明,正常情況下Ang-2 僅表達于血管重建部位,其在組織損傷修復過程中具有重要意義,Ang-2 在VEGF 的作用下能夠誘導內皮細胞增殖、轉移,促進新生血管的形成[19]。本研究中尼莫地平組Ang-2 明顯高于對照組和模型組,提示尼莫地平對顱腦損傷模型大鼠早期血管生成有促進作用。
本研究對大鼠腦組織進行病理檢查,結果顯示對照組腦組織結構完整,神經元細胞及神經纖維整齊排列;模型組損傷部位出現細胞和血管壞死,神經元細胞周圍腫脹,細胞間隙增大,部分神經元細胞凋亡,毛細血管腫脹,管壁結構部分破損。經尼莫地平給藥后,腦組織部分神經細胞死亡,水腫減輕,神經細胞排列略微紊亂,部分細胞仍見細胞質凝集,局部可見血管著色密集,表明在尼莫地平的作用下,腦組織神經受損情況明顯改善,并有新生血管形成。
Akt/ERK 通路包括PI3K/Akt 信號通路和ERK1/2信號通路。PI3K/Akt 通路中,Akt 通常為失活狀態,磷酸化后活化,形成pAkt,能夠激活PI3K/Akt 通路,其中Akt 參與細胞增殖、凋亡,而PI3K 是細胞中重要的信號蛋白,能夠調控Akt 的活化[20]。ERK1/2 能夠傳導絲裂酶原信號,激活后形成pERK1/2,能調控細胞核內的轉錄因子,刺激多種轉錄因子磷酸化,增強轉錄活性,加速細胞的增殖、轉移,有利于血管的新生[21]。本研究中,模型組pAkt/Akt、PI3K及(pERK1/2)/(ERK1/2)蛋白表達上調,表明大鼠顱腦損傷后,部分通路被激活,而尼莫地平組Akt/ERK 相關蛋白表達均上調,提示Akt/ERK 通路在莫地平的作用下被激活。
綜上所述,尼莫地平能夠促進顱腦損傷模型大鼠早期血管生成,其作用機制可能與Akt/ERK 通路有關。本研究僅表明Akt/ERK 通路可能與顱腦損傷模型大鼠早期血管生成有關,為進一步驗證Akt/ERK 通路在顱腦損傷模型大鼠早期血管形成中的作用,后續可將該通路上下游蛋白敲除,進行深入研究,為顱腦損傷的治療提供更充分的證據支持。

