ALDH1A1調(diào)控Notch1信號(hào)通路在MMSCs“干性”維持中的作用和機(jī)制研究
王曉麗 江妤 曾玉曉 劉永華 章俏雷


[摘要] 目的 研究乙酰脫氫酶家族成員A1(ALDH1A1)調(diào)控Notch1信號(hào)通路在多發(fā)性骨髓瘤干細(xì)胞(MMSCs)“干性”維持中的作用和機(jī)制。 方法 選用人MMSCs CD138-B細(xì)胞和人正常干細(xì)胞QSG-7701,用Western blot法檢測ALDH1A1在CD138-B細(xì)胞和QSG-7701細(xì)胞中的表達(dá)情況。將CD138-B細(xì)胞分為control組、ALDH1A1敲減組、Notch1通路抑制劑組,control組不作任何處理,ALDH1A1敲減組轉(zhuǎn)染10 μg ALDH1A1-shRNA重組慢病毒質(zhì)粒,Notch1通路抑制劑組加入20 μmol/L Notch1通路抑制劑GSI,培養(yǎng)48 h,檢測并比較三組ALDH1A1表達(dá)量、Notch1通路相關(guān)蛋白[Notch1、發(fā)狀分裂相關(guān)增強(qiáng)子1(Hes1)]表達(dá)量、增殖率、凋亡率及“干性”相關(guān)基因[胚胎干細(xì)胞關(guān)鍵蛋白(NANOG)、八聚體結(jié)合轉(zhuǎn)錄因子4(OCT4)]表達(dá)量。結(jié)果 CD138-B細(xì)胞中ALDH1A1蛋白表達(dá)量較QSG-7701細(xì)胞明顯增加(P<0.05);ALDH1A1敲減組ALDH1A1蛋白表達(dá)量較control組明顯減少(P<0.05);Notch1通路抑制劑組ALDH1A1蛋白表達(dá)量與control組比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。ALDH1A1敲減組和Notch1通路抑制劑組增殖率及Notch1、Hes1蛋白和NANOG、OCT4基因表達(dá)量較control組明顯減少(P<0.05),凋亡率較control組明顯增多(P<0.05);Notch1通路抑制劑組增殖率、凋亡率及Notch1、Hes1蛋白和NANOG、OCT4基因表達(dá)量與ALDH1A1敲減組比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。結(jié)論 ALDH1A1在MMSCs中呈高表達(dá),ALDH1A1敲減后可通過阻抑Notch1信號(hào)通路下調(diào)MMSCs“干性”維持,抑制MMSCs增殖并誘導(dǎo)其凋亡。
[關(guān)鍵詞] 乙酰脫氫酶家族成員A1;Notch1信號(hào)通路;多發(fā)性骨髓瘤干細(xì)胞;表達(dá)水平;干性維持;細(xì)胞增殖;細(xì)胞凋亡
[中圖分類號(hào)] R733.3? ? ? ? ? [文獻(xiàn)標(biāo)識(shí)碼] A? ? ? ? ? [文章編號(hào)] 1673-9701(2022)07-0021-04
Study on the role and mechanism of ALDH1A1 regulating Notch1 signaling pathway in stemness maintenance of MMSCs
WANG Xiaoli JIANG Yu ZENG Yuxiao LIU Yonghua ZHANG Qiaolei
Department of Hematology, Lishui People′s Hospital in Zhejiang Province, Lishui? ?323000, China
[Abstract] Objective To investigate the role and mechanism of aldehyde dehydrogenase family 1 member A1 (ALDH1A1) in regulating the Notch1 signaling pathway in the stemness maintenance of multiple myeloma stem cells (MMSCs). Methods Human MMSCs CD138-B cells and human normal stem cells QSG-7701 were selected to detect the expression of ALDH1A1 in CD138-B cells and QSG-7701 cells by Western blot. CD138-B cells were divided into the control group, the ALDH1A1 knockdown group and the Notch1 pathway inhibitor group. The control group was not treated with any treatment. The ALDH1A1 knockdown group was transfected with 10 μg ALDH1A1-shRNA recombinant lentiviral plasmid. The Notch1 pathway inhibitor group was added with 20 μmol/L Notch1 pathway inhibitor GSI and cultured for 48 h. The expression levels of ALDH1A1, Notch1 pathway related proteins (Notch1, hair division associated enhancer 1 [Hes1]), proliferation rate, apoptosis rate and stemness related genes (embryonic stem cell key protein [NANOG], octamer binding transcription factor 4 [OCT4]) were detected and compared among the three groups. Results The expression of ALDH1A1 protein in CD138-B cells was significantly higher than that in QSG-7701 cells (P<0.05). The protein expression of ALDH1A1 in the ALDH1A1 knockdown group was significantly lower than that in the control group (P<0.05). No significant difference was observed in the ALDH1A1 protein expression in the Notch1 pathway inhibitor group compared with the control group (P>0.05). The proliferation rates and the expression levels of Notch1 and Hes1 proteins and NANOG and OCT4 genes in the ALDH1A1 knockdown group and the Notch1 pathway inhibitor group were significantly decreased compared with the control group (P<0.05), and the apoptosis rates were significantly increased compared with the control group (P<0.05). No significant differences were observed in the proliferation rate, apoptosis rate, and the expressions of Notch1, Hes1, NANOG and OCT4 gene in the Notch1 pathway inhibitor group compared with the ALDH1A1 knockdown group(P>0.05). Conclusion ALDH1A1 is highly expressed in MMSCs. Knockdown of ALDH1A1 can inhibit the stemness maintenance of MMSCs by inhibiting the Notch1 signaling pathway, inhibit the proliferation of MMSCs and induce their apoptosis.
[Key words] ALDH1A1; Notch1 signaling pathway; Multiple myeloma stem cells; Expression level; Stemness maintenance; Cell proliferation; Apoptosis
多發(fā)性骨髓瘤為血液系統(tǒng)惡性腫瘤,發(fā)病率約為1/10萬,好發(fā)于老年人群,特征是克隆性漿細(xì)胞在骨髓中惡性增生,造成相關(guān)組織或器官損傷[1]。其臨床表現(xiàn)是貧血、骨骼損害、高鈣血癥、腎功能損害等[2]。目前沙利度胺、硼替佐米等新藥以及造血干細(xì)胞移植在多發(fā)性骨髓瘤治療中的應(yīng)用使患者生存期有所延長,但該病伴有高風(fēng)險(xiǎn)的復(fù)發(fā),完全治愈十分困難[3]。治療后復(fù)發(fā)被認(rèn)為與多發(fā)性骨髓瘤干細(xì)胞(multiple myeloma stem cells,MMSCs)有關(guān),這些干細(xì)胞有腫瘤起始、自我更新及化療藥物耐藥的潛能,現(xiàn)有干預(yù)方案可能只清除多發(fā)性骨髓瘤細(xì)胞,而對(duì)其干細(xì)胞的干預(yù)作用不明顯[4]。乙酰脫氫酶家族成員A1(aldehyde dehydrogenase family 1 member A1,ALDH1A1)是干細(xì)胞標(biāo)志物之一,能夠促進(jìn)腫瘤的發(fā)生和進(jìn)展,如乳腺癌、肺癌等[5]。Notch1信號(hào)通路是一條進(jìn)化上十分保守的信號(hào)通路,涉及細(xì)胞增殖、凋亡、分化、上皮-間質(zhì)轉(zhuǎn)化(epithelial mesenchymal transition,EMT)及干細(xì)胞自我更新等過程,該通路異常可能導(dǎo)致腫瘤的形成[6]。以往研究顯示[7],ALDH1A1與腫瘤干細(xì)胞干性關(guān)系密切,但其與MMSCs干性和生物學(xué)行為的關(guān)系及機(jī)制尚不清楚。因此,本研究分析ALDH1A1調(diào)控Notch1信號(hào)通路在MMSCs干性維持及增殖、凋亡中的作用和機(jī)制,希望為臨床治療多發(fā)性骨髓瘤提供新的干預(yù)靶點(diǎn),現(xiàn)報(bào)道如下。
1 材料與方法
1.1 實(shí)驗(yàn)材料與試劑
人MMSCs CD138-B細(xì)胞(北京埃克森科技有限公司);人正常干細(xì)胞QSG-7701(上海雅吉生物科技有限公司);ALDH1A1-shRNA重組慢病毒質(zhì)粒(武漢維克賽思科技有限公司);Notch1通路抑制劑GSI(上海翊圣生物科技有限公司);CCK-8溶液(上海富衡生物科技有限公司);PI染液、Annexin V-FITC(北京拜爾迪生物技術(shù)有限公司);BCA蛋白定量試劑盒(上海梵態(tài)生物科技有限公司);兔抗ALDH1A1單克隆抗體(上海群己生物科技有限公司)、兔抗β-actin單克隆抗體(武漢亞科因生物技術(shù)有限公司);山羊抗兔IgG二抗(上海研卉生物科技有限公司);ECL發(fā)光試劑盒(廣州市智取生物科技有限公司);兔抗Notch1單克隆抗體、兔抗Hes1單克隆抗體(上海嶸崴達(dá)實(shí)業(yè)有限公司);總RNA提取試劑盒(北京伊塔生物科技有限公司);反轉(zhuǎn)錄試劑盒(上海百賽生物技術(shù)有限公司)。
1.2 實(shí)驗(yàn)分組
將CD138-B細(xì)胞和QSG-7701細(xì)胞進(jìn)行原代培養(yǎng),收集其對(duì)數(shù)生長期的相應(yīng)細(xì)胞,接種于6孔細(xì)胞培養(yǎng)板中,每孔4×105個(gè)為細(xì)胞接種密度,用DMEM培養(yǎng)基(含有10%胎牛血清),在37℃(5%、CO2)條件下培養(yǎng),待細(xì)胞在培養(yǎng)基中的生長密度達(dá)80%~90%時(shí)用于以下實(shí)驗(yàn)。
將CD138-B細(xì)胞分為control組、ALDH1A1敲減組、Notch1通路抑制劑組,control組不作任何處理,ALDH1A1敲減組轉(zhuǎn)染10 μg ALDH1A1-shRNA重組慢病毒質(zhì)粒,Notch1通路抑制劑組加入20 μmol/L Notch1通路抑制劑GSI,繼續(xù)培養(yǎng)48 h,48 h后在熒光顯微鏡下觀察綠色熒光蛋白(GFP)表達(dá)情況,傳代后,換用L15培養(yǎng)液[含有嘌呤霉素(2 μg/ml)]進(jìn)行篩選,得到穩(wěn)定傳代的細(xì)胞克隆。上述過程中的轉(zhuǎn)染操作按照LipofectamineTM2000轉(zhuǎn)染說明書進(jìn)行。
1.3 采用CCK8法檢測三組CD138-B細(xì)胞增殖率
取1.2項(xiàng)下的三組細(xì)胞,制成單細(xì)胞懸液,以5×105/ml接種于96孔板(每孔100 μl),待細(xì)胞貼壁后加入CCK-8溶液(每孔10 μl),37℃培養(yǎng)120 min,用酶標(biāo)儀測定570 nm波長處各孔吸光度(A)值,增殖率計(jì)算公式為[1-(處理組A/對(duì)照組A)×100%]。
1.4采用流式細(xì)胞術(shù)檢測三組CD138-B細(xì)胞凋亡率
取1.2項(xiàng)下的三組細(xì)胞,制成單細(xì)胞懸液,加入250 μl EMSA/Gel-Shift結(jié)合緩沖液(5X)將細(xì)胞重懸,再加入5 μl Annexin V-FITC、5 μl PI染液,避光條件下反應(yīng)15 min,然后用流式細(xì)胞儀檢測細(xì)胞凋亡。
1.5采用Western blot法檢測ALDH1A1在CD138-B細(xì)胞和QSG-7701細(xì)胞中的表達(dá)情況
取1.2項(xiàng)下的CD138-B細(xì)胞和QSG-7701細(xì)胞,勻漿,裂解,離心,收集上清,用BCA蛋白定量試劑盒測定蛋白濃度并定量,取總蛋白上樣,電泳,切膠,轉(zhuǎn)膜,封閉,加入兔抗ALDH1A1單克隆抗體(1∶300稀釋)、兔抗β-actin單克隆抗體(1∶200稀釋),4℃孵育過夜,洗膜,加入山羊抗兔IgG二抗(堿性磷酸酶標(biāo)記,1∶3000稀釋),37℃孵育1 h,洗膜,用ECL發(fā)光試劑盒曝光顯影,用Image Lab軟件對(duì)目的蛋白(ALDH1A1)和內(nèi)參蛋白(β-actin)的灰度值進(jìn)行分析,目的蛋白灰度值/內(nèi)參蛋白灰度值為最終結(jié)果。
1.6采用Western blot法檢測ALDH1A1及Notch1通路相關(guān)蛋白[Notch1、發(fā)狀分裂相關(guān)增強(qiáng)子1(hairy and enhancer of split 1,Hes1)]在三組中的表達(dá)情況
取1.2項(xiàng)下的三組CD138-B細(xì)胞,勻漿,裂解,離心,收集上清,測定蛋白濃度并定量,取總蛋白上樣,電泳,切膠,轉(zhuǎn)膜,封閉,加入Notch1、Hes1一抗(1∶500稀釋)及ALDH1A1一抗和β-actin一抗,4℃孵育過夜,洗膜,加入山羊抗兔IgG二抗,37℃孵育1 h,洗膜,曝光顯影,用Image Quant TL軟件分析各條條帶的灰度值。
1.7采用實(shí)時(shí)熒光定量逆轉(zhuǎn)錄聚合酶鏈反應(yīng)(real time fluorescence quantitative-polymerase chain reaction,RT-PCR)檢測“干性”相關(guān)基因在三組CD138-B細(xì)胞中的表達(dá)量
取1.2項(xiàng)下的三組細(xì)胞,用細(xì)胞總RNA提取試劑盒提取總RNA,用反轉(zhuǎn)錄試劑盒將其反轉(zhuǎn)錄成cDNA,然后在T100 PCR儀上進(jìn)行PCR擴(kuò)增。擴(kuò)增體系為:1 μl cDNA模板,10 μl SYBR Premix Ex Taq,上下游引物各0.5 μl,加無核酶水將體系補(bǔ)充至20 μl;反應(yīng)條件為:95℃條件下預(yù)變性15 s,95℃條件下變性5 s,57℃條件下復(fù)性30 s,72℃條件下延伸30 s,循環(huán)共42個(gè);引物序列見表1。根據(jù)擴(kuò)增曲線準(zhǔn)確讀取循環(huán)閾值(cycle threshold,Ct),內(nèi)參照為GAPDH基因,用相對(duì)定量法以2 -△△Ct表示NANOG、八聚體結(jié)合轉(zhuǎn)錄因子4(octamer-binding transcription factor-4,OCT4)基因表達(dá)量。
1.8統(tǒng)計(jì)學(xué)方法
所有實(shí)驗(yàn)重復(fù)3次。采用SPSS 22.0統(tǒng)計(jì)學(xué)軟件進(jìn)行數(shù)據(jù)分析,計(jì)量資料以均數(shù)±標(biāo)準(zhǔn)差(x±s)表示,兩組之間的計(jì)量資料比較用t檢驗(yàn),三組之間的計(jì)量資料比較用單因素方差分析(其中兩兩計(jì)量資料比較采用SNK-Q檢驗(yàn))。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 ALDH1A1在CD138-B細(xì)胞和QSG-7701細(xì)胞中的表達(dá)情況
與QSG-7701細(xì)胞(0.74±0.16)比較,CD138-B細(xì)胞中ALDH1A1蛋白表達(dá)量(2.92±0.97)明顯增加(t=3.841,P=0.018)。
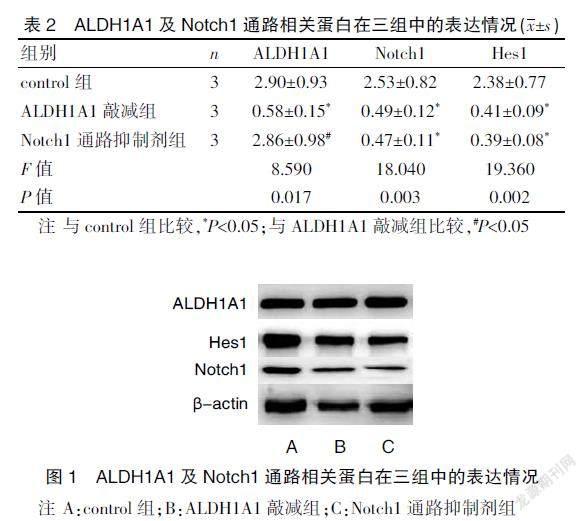
2.2 ALDH1A1及Notch1通路相關(guān)蛋白在三組中的表達(dá)情況
ALDH1A1敲減組ALDH1A1蛋白表達(dá)量較control組明顯減少,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);Notch1通路抑制劑組ALDH1A1蛋白表達(dá)量與control組比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。ALDH1A1敲減組和Notch1通路抑制劑組Notch1、Hes1蛋白表達(dá)量較control組明顯減少,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);Notch1通路抑制劑組Notch1、Hes1蛋白表達(dá)量與ALDH1A1敲減組比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。見表2、圖1。
2.3 “干性”相關(guān)基因在三組中的表達(dá)情況
ALDH1A1敲減組和Notch1通路抑制劑組NANOG、OCT4基因表達(dá)量較control組明顯減少,差異有統(tǒng)計(jì)學(xué)意義(P<0.05);Notch1通路抑制劑組NANOG、OCT4基因表達(dá)量與control組比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。見表3。
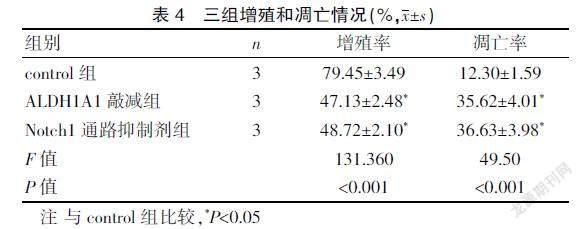
2.4 三組增殖和凋亡情況
ALDH1A1敲減組和Notch1通路抑制劑組增殖率較control組明顯減少(P<0.05),凋亡率較control組明顯增多(P<0.05);Notch1通路抑制劑組增殖率和凋亡率與ALDH1A1敲減組比較,差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。見表4、封三圖1。
3 討論
腫瘤干細(xì)胞是腫瘤形成的根源,也是腫瘤細(xì)胞對(duì)放化療抵抗的根本[8]。降低MMSCs的“干性”對(duì)于提高多發(fā)性骨髓瘤療效有重要意義。ALDH是一種胞質(zhì)酶,能夠催化乙醛氧化為乙酸,在機(jī)體代謝中具有重要作用,與腫瘤的形成存在一定關(guān)系[9]。ALDH1為ALDH家族中的重要成員,可將視黃醇氧化為視黃酸,然后與視黃酸受體-α(retinoic acid receptor-α,RAR-α)結(jié)合而參與多種組織分化和基因調(diào)控[10]。ALDH1在多種腫瘤干細(xì)胞中處于高表達(dá)狀態(tài)。ALDH1A1是ALDH1的亞型之一,在結(jié)腸癌、肝癌、乳腺癌、肺癌等腫瘤細(xì)胞中表達(dá)異常,并與這些腫瘤細(xì)胞的侵襲和轉(zhuǎn)移有關(guān)[11]。相關(guān)文獻(xiàn)報(bào)道,ALDH1A1過表達(dá)后小鼠的成瘤能力更強(qiáng),且“干性”增強(qiáng)[12]。研究顯示ALDH1A1表達(dá)水平與乳腺癌組織學(xué)分級(jí)、淋巴結(jié)轉(zhuǎn)移、TNM分期關(guān)系密切,而與腫瘤大小、年齡無關(guān),ALDH1A1高表達(dá)患者的生存期縮短明顯,提示ALDH1A1在乳腺癌惡性轉(zhuǎn)化過程中有著促進(jìn)作用,其水平檢測有助于判斷乳腺癌惡性程度和預(yù)后情況[13]。學(xué)者發(fā)現(xiàn),ALDH1A1在喉鱗癌Hep2腫瘤細(xì)胞中呈高表達(dá),且其高表達(dá)能夠促進(jìn)Hep2細(xì)胞增殖并誘導(dǎo)其凋亡[14]。相關(guān)報(bào)告指出,ALDH1A1表達(dá)水平升高是肺癌預(yù)后的危險(xiǎn)因素,ALDH1A1可作為肺癌腫瘤干細(xì)胞(lung cancer stem cells,LCSCs)表面標(biāo)志物[15]。本研究中,CD138-B細(xì)胞中ALDH1A1蛋白表達(dá)量較QSG-7701細(xì)胞明顯增加,提示ALDH1A1在MMSCs中呈高表達(dá),ALDH1A1可能與多發(fā)性骨髓瘤發(fā)生有關(guān);ALDH1A1敲減組ALDH1A1蛋白表達(dá)量較control組明顯減少,提示ALDH1A1-shRNA重組慢病毒質(zhì)粒轉(zhuǎn)染成功;ALDH1A1敲減組增殖率及NANOG、OCT4基因表達(dá)量較control組明顯減少,凋亡率較control組明顯增多,提示敲減ALDHlAl后可下調(diào)MMSCs“干性”維持,抑制MMSCs增殖并誘導(dǎo)其凋亡。
Notch1通路是存在于大部分細(xì)胞生物體中的配體-受體信號(hào)通路,在細(xì)胞生物學(xué)行為如生長、分化、代謝、增殖等中起重要作用,其在惡性腫瘤中的作用也備受關(guān)注[16]。Hes1是調(diào)控Notch1通路的關(guān)鍵靶基因之一,檢查Hes1表達(dá)情況可判斷該通路的活化程度[17]。研究顯示,Notch1通路在前列腺癌中呈現(xiàn)高度激活狀態(tài),該通路受到抑制后可減弱腫瘤細(xì)胞的增殖能力,Notch1及下游的靶基因Hes1在卵巢癌中有異常高表達(dá),抑制其表達(dá)后能夠促進(jìn)卵巢癌細(xì)胞凋亡[18]。GSI為Notch1信號(hào)第3步酶切反應(yīng),能夠阻礙Notch1胞內(nèi)段Nicd釋放,使細(xì)胞增殖及分化受到影響[19]。文獻(xiàn)顯示,GSI能夠阻斷Notch1通路在前列腺癌和乳腺癌等腫瘤細(xì)胞中的表達(dá)[20]。本研究用GSI抑制MMSCs中的Notch1通路,分析ALDH1A1是否通過調(diào)控Notch1通路對(duì)MMSCs干性維持及增殖、凋亡發(fā)揮作用,結(jié)果顯示ALDH1A1敲減組Notch1、Hes1蛋白表達(dá)量較control組明顯減少,提示ALDH1A1敲減后Notch1通路處于抑制狀態(tài);Notch1通路抑制劑組增殖率及Notch1、Hes1蛋白和NANOG、OCT4基因表達(dá)量較control組明顯減少,凋亡率較control組明顯增多,且上述指標(biāo)在ALDH1A1敲減組和Notchl通路抑制劑組中無明顯差異,提示ALDH1A1對(duì)MMSCs“干性”、增殖、凋亡的作用機(jī)制與Notchl信號(hào)通路有關(guān)。
綜上所述,ALDH1A1敲減后可通過阻抑Notch1信號(hào)通路下調(diào)MMSCs“干性”維持,抑制MMSCs增殖并誘導(dǎo)其凋亡。但ALDH1A1對(duì)MMSCs“干性”及生物學(xué)行為是否還有其他調(diào)控機(jī)制,有待進(jìn)一步研究。
[參考文獻(xiàn)]
[1]? ?許曉東,曹俊杰,裴仁治,等.硼替佐米聯(lián)合自體造血干細(xì)胞移植治療多發(fā)性骨髓瘤臨床療效及預(yù)后因素分析[J].中國現(xiàn)代醫(yī)生,2019,57(30):14-18.
[2]? ?譚鑫.多發(fā)性骨髓瘤患者血清β2-微球蛋白,TNF-α,CRP及IL-6水平檢測[J].中國現(xiàn)代醫(yī)生,2019,57(26):13-16.
[3]? ?劉妮,袁瑞麗,楊金宇,等.多發(fā)性骨髓瘤與HBV及HCV感染相關(guān)性的系統(tǒng)評(píng)價(jià)[J].中國醫(yī)師雜志,2018, 20(8):1146-1147.
[4]? ?Jin N,Zhu X,Cheng F,et al. Disulfiram/copper targets stem cell-like ALDH+ population of multiple myeloma by inhibition of ALDH1A1 and Hedgehog pathway[J].Journal of Cellular Biochemistry,2018,12(8):880-881.
[5]? ?Abdul Amin S,Adhikari N,Gayen S,et al. Insight into the structural requirements of theophylline-based aldehyde dehydrogenase 1 A1(ALDH1A1)inhibitors through multi-QSAR modeling and molecular docking approaches[J].Curr Drug Discov Technol,2016,13(2):101-103.
[6]? ?Lee J,Hong SA,Hwang HW,et al. 1743PLow expression of Notch1 and combined Notch1/HES1 are associated with adverse survival factor for limited stage small cell lung cancer[J].Annals of Oncology,2019,30(5):1256-1257.
[7]? ?劉艷麗,劉良發(fā),郭維維.RhoC表達(dá)對(duì)喉鱗癌Hep2腫瘤細(xì)胞凋亡、腫瘤干細(xì)胞標(biāo)志物-ALDH1A1及細(xì)胞形態(tài)的影響[J].醫(yī)學(xué)研究雜志,2017,46(10):158-161.
[8]? ?李洵,艾文兵.SOX2與膠質(zhì)瘤相關(guān)研究[J].中國醫(yī)師雜志,2018,20(8):1266-1270.
[9]? ?Perez-Alea M,Colle J,Yazir M,et al. Dual targeting of ALDH1 and ALDH3:A promising therapeutic approach in acute myeloid leukemia[J].Blood,2019,134(1):3364.
[10]? Jakob M,Sharaf K,Schirmer M,et al. Role of cancer stem cell markers ALDH1,BCL11B,BMI-1,and CD44 in the prognosis of advanced HNSCC[J].Strahlentherapie und Onkologie,2020,3(1):147-150.
[11]? Wang Q,Jiang J,Ying G,et al. Tamoxifen enhances stemness and promotes metastasis of ERα36+ breast cancer by upregulating ALDH1A1 in cancer cells[J].Cell Research,2018,5(8):56-60.
[12]? Nagare RP,Sneha S,Krishnapriya S,et al. ALDH1A1+ ovarian cancer stem cells co-expressing surface markers CD24,EPHA1 and CD9 form tumours in vivo[J].Experim-ental Cell Research,2020,5(8):112 009-112 010.
[13]? 崔毅.CyclinD1,P27,CK19,ALDH1A1在乳腺病變中表達(dá)及意義[J].臨床軍醫(yī)雜志,2017,3(9):41-43.
[14]? Charkoftaki G,Thompson DC,Golla JP,et al. Integrated multi-omics approach reveals a role of ALDH1A1 in lipid metabolism in human colon cancer cells[J].Chemico Biological Interactions,2019,12(8):56-60.
[15]? 楊婷婷,古晶晶,劉婷,等.吉非替尼耐藥的人肺腺癌HCC-827/GR細(xì)胞乙醛脫氫酶亞型表達(dá)分析[J].中國肺癌雜志,2018,21(6):7-12.
[16]? Decker MD,Lavaert M,Roels J,et al. HES1 and HES4 have non-redundant roles downstream of Notch during early human T cell development[J].Haematologica,2019, 2(7):226 126-226 130.
[17]? Xu Y,Li Y,Liu X,et al. SPIONs enhances IL-10-producing macrophages to relieve sepsis via Cav1-Notch1/HES1-mediated autophagy[J].International Journal of Nanomed-icine,2019,14(8):6779-6797.
[18]? Xiang Z,Zhang YH,He XL,et al. N-acetylcysteine ame-liorates learning and memory abilities via the Notch1/hes1 signaling pathway of the hippocampus in a valproic acid-induced rat model of autism[J].Chinese Journal of Clinical Anatomy,2019,6(12):417-420.
[19]? 林爭,王繹,明華. Notch1信號(hào)通路調(diào)控乳腺癌腫瘤細(xì)胞放療敏感性的機(jī)制研究[J].腫瘤學(xué)雜志,2018,24(7):687-691.
[20]? 田登梅,梁英民,張永清.內(nèi)皮細(xì)胞靶向的可溶性Notch配體hD1R蛋白對(duì)急性髓系白血病細(xì)胞增殖的影響[J].中華血液學(xué)雜志,2018,39(10):845-850.
(收稿日期:2021-03-11)

