敲低lncRNA SNHG7通過抑制ROCK1降低前列腺癌細胞增殖和遷移能力
佟麗斐,張霞,楊玉蝶,李起征,劉鵬
(大連醫科大學 1.附屬大連市第五人民醫院放療科,遼寧 大連 116021;2.附屬大連市第五人民醫院腫瘤內科,遼寧 大連 116021;3.附屬第一醫院腫瘤科,遼寧 大連 116011;4.附屬大連市中心醫院腫瘤內科,遼寧 大連 116033)
前列腺癌是一種危及生命的男性惡性腫瘤,2018年約新增130萬例,死亡35.9萬人[1]。盡管隨著診斷和治療的不斷進展,患者的生存時間極大延長,但部分高度惡性患者的5年總生存率仍很低[2]。因此,研究前列腺癌惡性發生、發展的分子機制,有助于臨床減緩甚至抑制前列腺癌的惡性進展。近年來,大量證據證實長鏈非編碼RNA(long noncoding RNA,lncRNA)在前列腺癌中發揮關鍵作用[3-4]。lncRNA可以競爭性結合微RNA,或作為橋接分子與其他功能蛋白形成功能復合體,從而調控腫瘤生長、轉移過程關鍵基因的表達[3]。最近研究[5-7]發現,lncRNA小核仁RNA宿主基因7(small nucleolar RNA host gene 7,SNHG7)在多種腫瘤中呈異常高表達,而SNHG7異常高表達與乳腺癌、肺腺癌、膠質瘤的不良預后相關。盡管近期有研究[8]發現SNHG7在前列腺癌中高表達,但SNHG7在前列腺癌惡性進展中的功能仍有待進一步探索。
Rho關聯含卷曲螺旋蛋白激酶1(Rho-associated coiled-coil domain containing protein kinase 1,ROCK1)是轉化生長因子β/Smads信號通路調控因子,編碼一種蛋白絲氨酸/蘇氨酸激酶,當與Rho的鳥苷三磷酸結合時將被激活[9]。前期研究[10]表明,ROCK1參與多種疾病的發病過程。此外,ROCK1在多種腫瘤的發病機制中發揮重要作用,激活ROCK1信號通路已被證實可促進胰腺癌細胞的侵襲和轉移[10],ROCK1還可通過抑制PTEN/FAK通路促進非小細胞肺癌的發生、發展[11]。盡管已經在多種腫瘤中明確其作用,但ROCK1在前列腺癌中的具體調控機制尚不清楚。本研究通過Western blotting、Transwell實驗、熒光原位雜交實驗等深入探討SNHG7對前列腺癌細胞的惡性調節能力及可能機制,從而為前列腺癌的治療提供有效策略。
1 材料與方法
1.1 細胞培養
人正常前列腺上皮細胞系RWPE、前列腺癌細胞系PC-3購自中國科學院上海分院,細胞培養于RPMI 1640培養基(北京賽默飛),并添加10%胎牛血清(美國Gemini Bio-Products)和100 U青霉素和鏈霉素雙抗(北京索萊寶)。VCaP和DU145細胞培養于DMEM培養基,并添加10%胎牛血清和100 U青霉素和鏈霉素雙抗。細胞于37 ℃、5% CO2培養箱中培養。
1.2 轉染
使用Lipofectamine 3000試劑盒(美國Invitrogen)轉染SNHG7,根據說明書進行操作。SNHG7敲低質粒和ROCK1過表達質粒由上海吉瑪公司合成(si-NC和pcDNA3.1分別為敲低和過表達空白載體,即陰性對照組)。細胞生長融合度達到90%時進行傳代,傳代按照1 ∶3比例進行。待細胞生長鋪滿皿底50%左右進行轉染,轉染過程根據說明書添加Lipofectamine 3000和P3000,轉染后6 h換液,換液后24~48 h進行PCR檢測,48~72 h進行Western blotting。SNHG7敲低序列(si-SNHG7):5’-GCUGGAAUAAA GAGUAACAUU-3’;陰性對照(si-NC)序列:5’-UU CUCCGAACGUGUCACGUTT-3’。
1.3 MTT實驗
將5×103個細胞置于96孔板中,37 ℃培養。待細胞進行SNHG7轉染后,每孔加入10 μL MTT溶液,于37 ℃孵育4 h。在490 nm處測定各樣品的分光光度。所有實驗重復3次,計算平均值。
1.4 Transwell實驗
通過Transwell實驗(美國Costar)體外評估前列腺癌細胞的侵襲和遷移能力。細胞轉染后,將1×105個細胞接種于上室,并加入300 μL 培養基,下室加入等量培養基。48 h后擦除膜表面的細胞,使用甲醛固定20 min,隨后PBS清洗3遍,最后用0.5%結晶紫染色。在顯微鏡下隨機分為5個區,計數浸潤和遷移細胞數目。
1.5 總RNA提取和PCR
按照說明書使用TRIzol試劑分離總RNA。使用PrimeScript試劑盒(日本TaKaRa),根據說明書進行逆轉錄和實時PCR。使用SYBR? Premix Ex TaqTMⅡ在Bio-Rad CFX 96實時PCR系統上進行實時PCR。GAPDH為內參,采用2-ΔΔCt法測定基因相對表達量。引物序列:SNHG7,正義5’-GTTGGGGTGTTGGCAT TCTTGTT-3’,反 義5’-GCGCCCAATACGACCAAAT C-3’;ROCK1,正 義5’-CTGCAACTGGAACTCAACC AAGAA-3’,反 義5’-TTAGCACGCAATTGCTCAATA TCAC-3’;GAPDH,正義5’-CGTCGCTAGCGATCGT TACA-3’,反義5’-CTAAATGCTAGTCTTTACGA-3’。
1.6 Western blotting
將SNHG7轉染后的前列腺癌細胞溶解于含有蛋白酶抑制劑的RIPA緩沖液。蛋白(20 μg)經過10%SDS-聚丙烯酰胺凝膠電泳,轉移到聚偏二乙烯膜上。使用針對ROCK1(中國CST公司)和GAPDH(中國CST公司)的一抗進行孵育,4 ℃過夜,翌日TBST清洗,每次5 min;隨后熒光二抗室溫孵育2 h(中國CST公司)。使用增強化學發光試劑進行發光成像(型號:FD8020,杭州富德生物科技有限公司)。
1.7 熒光原位雜交實驗
將細胞均勻鋪在6孔板中,使用4%多聚甲醛固定20 min,PBS清洗3次,每次5 min;隨后使用甘氨酸處理5 min,PBS再次沖洗5 min;使用0.5% Triton-100對細胞進行透膜10 min;PBS清洗3次,每次3 min;滴加雜交液預處理1 h,然后使用生物素標記的SNHG7探針(武漢塞維爾)進行細胞孵育,4 ℃過夜;抗生物素抗體(北京賽默飛)進行雜交過夜,最后滴加熒光二抗(北京CST),進行DAPI(北京碧云天)顯色。
1.8 統計學分析
采用GraphPad Prism 5軟件進行統計學分析。每個實驗重復3次,結果以表示。采用t檢驗進行2組間比較。P< 0.05為差異有統計學意義。
2 結果
2.1 SNHG7在前列腺癌中高表達并提示預后不良
為了分析SNHG7在前列腺癌中的表達,首先通過癌癥基因組圖譜數據庫(http://gepia.cancer-pku.cn)對其進行癌和癌旁組織表達差異分析。結果顯示,SNHG7在前列腺癌組織中高表達(圖1A)。此外,生存分析提示,高表達SNHG7與患者生存時間較短明顯相關(圖1B)。細胞學實驗發現,與人正常前列腺上皮細胞(RWPE)相比,前列腺癌細胞(PC-3、VCaP和DU145)中SNHG7明顯高表達(圖1C)。這些結果提示,SNHG7在前列腺癌的發生、發展中發揮重要的作用。
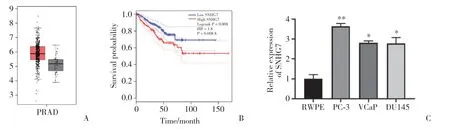
圖1 SNHG7在前列腺癌中高表達并提示預后不良Fig.1 SNHG7 is highly expressed in prostate cancer and indicates a poor prognosis
2.2 SNHG7主要位于細胞質
鑒于SNHG7在腫瘤組織和細胞中高表達,為進一步了解其功能和機制,通過熒光原位雜交實驗檢測SNHG7的亞細胞分布情況。結果提示,SNHG7主要位于細胞質。見圖2。
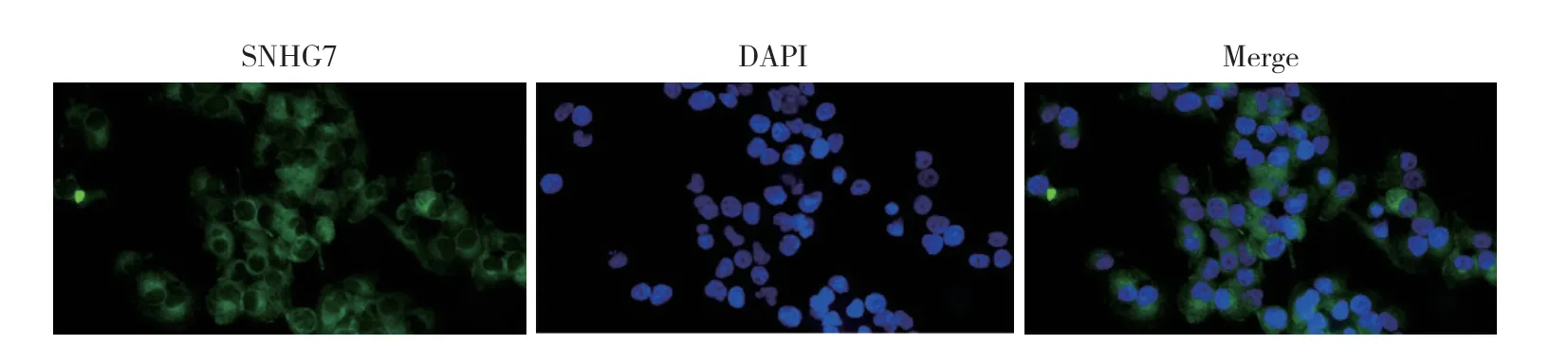
圖2 SNHG7主要位于細胞質中 ×400Fig.2 SNHG7 is mainly located in the cytoplasm ×400
2.3 敲低SNHG7抑制了前列腺癌細胞的增殖和遷移能力
為了進一步分析SNHG7的功能,構建SNHG7敲低細胞系。通過PCR對敲低細胞系進行SNHG7檢測(圖3A),結果顯示,成功構建了敲低細胞系。隨后使用SNHG7敲低細胞系進行MTT檢測,評估SNHG7對PC-3細胞增殖的影響,結果發現,其抑制了細胞增殖(圖3B)。Transwell遷移實驗也發現,其抑制了前列腺癌細胞遷移(圖3C)。這些結果提示,SNHG7在前列腺癌細胞的增殖和遷移中發揮重要作用。
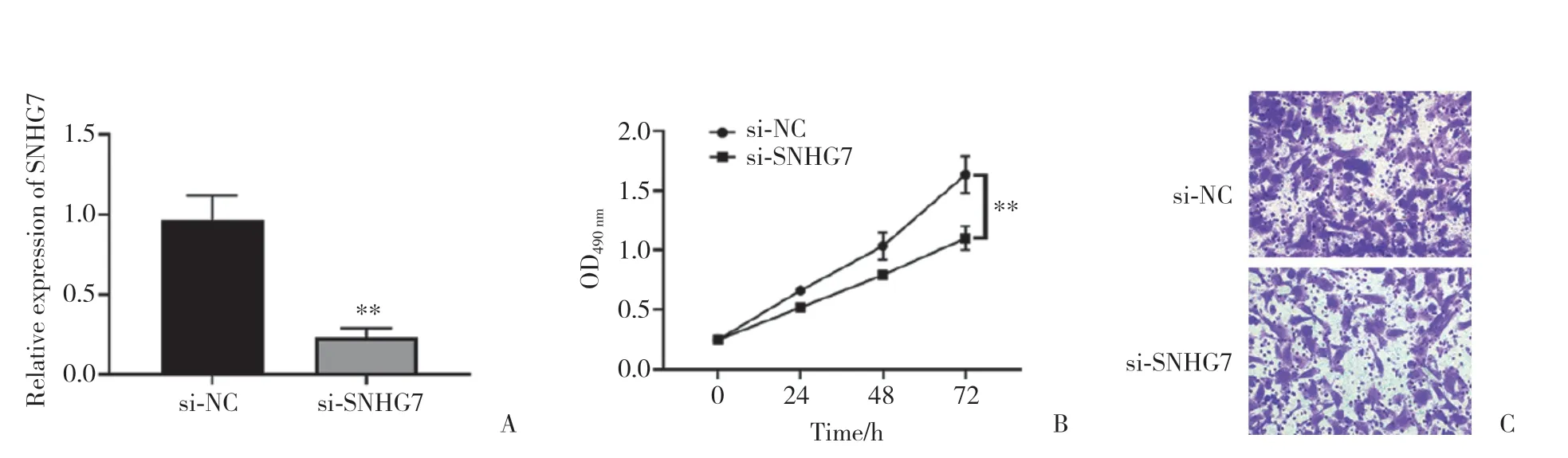
圖3 敲低SNHG7可抑制前列腺癌細胞的增殖和遷移Fig.3 SNHG7 knockdown inhibits prostate cancer cell proliferation and migration
2.4 SNHG7調控ROCK1的表達
為了分析SNHG7能否通過ROCK1調節前列腺癌細胞的惡性進展,采用PCR檢測ROCK1的表達,結果發現,ROCK1在多種前列腺癌細胞中高表達(圖4A)。而當敲低SNHG7后,ROCK1mRNA表達減少(圖4B),蛋白表達減少(圖4C)。這說明SNHG7的對前列腺癌細胞惡性能力的調控可能是ROCK1介導的。
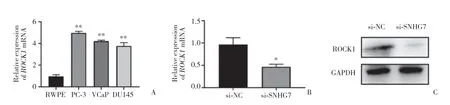
圖4 敲低SNHG7可抑制ROCK1的表達Fig.4 SNHG7 knockdown inhibited ROCK1 expression
2.5 SNHG7通過ROCK1調控前列腺癌細胞的增殖和遷移
進一步分析SNHG7與ROCK1及前列腺癌細胞增殖和遷移能力的關系,進行挽救實驗。首先構建ROCK1過表達細胞系,通過PCR(圖5A)和Western blotting(圖5B)檢測轉染后ROCK1的表達,結果證實,ROCK1過表達細胞系成功構建。隨后使用SNHG7敲低細胞系同時進行ROCK1敲低,結果發現,前列腺癌PC-3細胞的增殖(圖5C)和遷移能力(圖5D)恢復。以上結果表明,SNHG7通過ROCK1調控前列腺癌細胞的增殖和遷移。
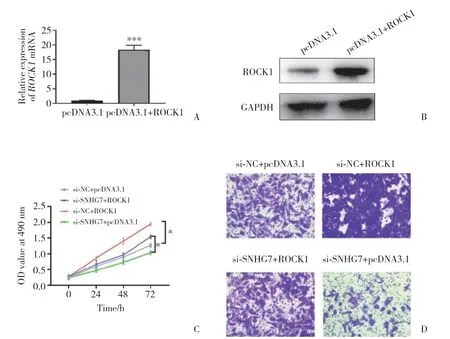
圖5 SNHG7通過ROCK1調控前列腺癌細胞的增殖和遷移Fig.5 SNHG7 regulates prostate cancer cell proliferation and migration through ROCK1
3 討論
近幾十年來,lncRNA在疾病特別是癌癥中的重要作用越來越受到人們的關注。研究[12]已經發現,許多lncRNA作為癌基因或腫瘤抑制因子,可以調控前列腺癌的發生和轉移,但不同lncRNA在不同腫瘤中的作用尚不明確。lncRNA SNHG7是近年發現的新型非編碼RNA,多項研究[13]表明,lncRNA SNHG7在多種癌癥中過表達,包括肺癌、乳腺癌、結直腸癌和膀胱癌,通過多種途徑促進腫瘤的發生。最近有研究[14]報道了SNHG7加速前列腺癌的惡性進展,但SNHG7在其中的調節機制需要進一步探索。
本研究發現,與癌旁組織相比,lncRNA SNHG7在癌組織中明顯上調,并且SNHG7高表達提示患者生存時間縮短,體外細胞實驗同樣證明其在多種腫瘤細胞系中高表達。這些結果提示,SNHG7在前列腺癌的發生、發展中可能起到重要作用。為了闡明SNHG7異常高表達的意義,本研究通過細胞增殖實驗和Transwell實驗檢測細胞增殖和遷移能力,結果發現,SNHG7敲低后前列腺癌PC-3細胞的增殖和遷移能力都被抑制。近年發現ROCK1與多種腫瘤的生長和轉移密切相關,包括骨肉瘤、胰腺癌甚至血液系統腫瘤。ROCK1功能多樣化,廣泛參與多種細胞過程,包括凋亡、侵襲、纖維化等[15]。然而,SNHG7與ROCK1之間的調控關系尚不清楚。為此,本研究構建了SNHG7敲低前列腺癌細胞系,通過共轉染實驗發現,敲低SNHG7后ROCK1的表達明顯減少;并且通過MTT實驗和Transwell實驗發現,SNHG7敲低后細胞的增殖和遷移能力可被過表達ROCK1恢復。
綜上所述,SNHG7對于前列腺癌生長、轉移的調控是通過ROCK1介導的,以SNHG7或ROCK1為靶點的腫瘤治療方式可能成為治療前列腺癌的一種有效策略。

