高中化學(xué)中“鐵及其化合物”的項(xiàng)目式教學(xué)研究
鄧梅 高恒飛 李一梅

摘要:以“為缺鐵性貧血人群制定補(bǔ)鐵策略”為項(xiàng)目任務(wù),開展鐵及其化合物的教學(xué)。教師將總項(xiàng)目拆解為“探明人體中的鐵”“探究人體鐵吸收和轉(zhuǎn)運(yùn)的機(jī)理”“探究補(bǔ)鐵劑中的鐵”“探究補(bǔ)鐵劑服用注意事項(xiàng)”四個(gè)項(xiàng)目任務(wù),以真實(shí)問題驅(qū)動(dòng)項(xiàng)目,培養(yǎng)了學(xué)生的問題意識(shí),引導(dǎo)學(xué)生從元素價(jià)態(tài)和物質(zhì)類別的角度學(xué)習(xí)亞鐵鹽、鐵鹽以及鐵的氫氧化物的形成和轉(zhuǎn)化,在實(shí)驗(yàn)探究的過程中形成證據(jù)意識(shí),培養(yǎng)科學(xué)探究能力。
關(guān)鍵詞:項(xiàng)目式教學(xué);教學(xué)設(shè)計(jì);高中化學(xué)
文章編號(hào):1008-0546( 2022)11-0029-06
中圖分類號(hào):G632.41
文獻(xiàn)標(biāo)識(shí)碼:Bdoi:10.3969/i.issn.1008-0546.2022.11.007
一、項(xiàng)目教學(xué)主題內(nèi)容及教學(xué)現(xiàn)狀分析
項(xiàng)目式教學(xué)法以項(xiàng)目驅(qū)動(dòng)問題為出發(fā)點(diǎn),以學(xué)生為項(xiàng)目學(xué)習(xí)和執(zhí)行的主體,以工程實(shí)際構(gòu)建真實(shí)有意義的“問題”情境,在其中嵌入學(xué)科知識(shí)內(nèi)容,將項(xiàng)目任務(wù)劃分為若干個(gè)獨(dú)立的子項(xiàng)目,學(xué)生在完成項(xiàng)目任務(wù)的過程中自主建構(gòu)科學(xué)知識(shí)、掌握科學(xué)方法、提高解決問題的綜合能力。[1]在2017版高中化學(xué)課程標(biāo)準(zhǔn)“金屬及其化合物”的學(xué)習(xí)要求中明確提到了“結(jié)合真實(shí)情境中的應(yīng)用實(shí)例或通過實(shí)驗(yàn)探究,了解鈉、鐵及其重要化合物的主要性質(zhì),了解這些物質(zhì)在生產(chǎn)、生活中的應(yīng)用”。[2]因此,項(xiàng)目教學(xué)法十分契合高中化學(xué)課程中金屬及其化合物的教學(xué),應(yīng)用真實(shí)情境發(fā)展學(xué)生化學(xué)核心素養(yǎng)。
本文選取高一化學(xué)人教版必修第一冊第三章第一節(jié)鐵及其化合物進(jìn)行項(xiàng)目式教學(xué),以“為缺鐵性貧血人群制定補(bǔ)鐵策略”為項(xiàng)目,重新整合教材內(nèi)容進(jìn)行教學(xué)。學(xué)生在前面已經(jīng)學(xué)習(xí)了物質(zhì)的分類及轉(zhuǎn)化、離子反應(yīng)和氧化還原反應(yīng),已經(jīng)初步掌握了物質(zhì)分類及轉(zhuǎn)化和質(zhì)量守恒的知識(shí),為本節(jié)課學(xué)習(xí)鐵及其化合物鋪墊了基礎(chǔ);在學(xué)習(xí)了鈉、氯兩個(gè)主族元素之后,學(xué)生初步具備了元素觀、結(jié)構(gòu)觀、價(jià)態(tài)觀,基本掌握了學(xué)習(xí)元素及其化合物知識(shí)的思路。鐵作為學(xué)生學(xué)習(xí)的第一個(gè)副族元素和變價(jià)元素,有助于學(xué)生構(gòu)建元素化合物的認(rèn)識(shí)模型,既是再次深度認(rèn)知之前的主族元素鈉和氯,也為之后氮、硫等元素的學(xué)習(xí)打下基礎(chǔ)。本課時(shí)首先通過讓學(xué)生了解全球仍有1/2的人口處于缺乏微量元素的“隱形饑餓”的背景下,了解缺鐵性貧血人群,在完成“為缺鐵性貧血人群制定補(bǔ)鐵策略”項(xiàng)目的過程中,將總項(xiàng)目拆解為各個(gè)子項(xiàng)目,在完成子項(xiàng)目的過程中構(gòu)建起元素及其化合物的知識(shí)網(wǎng)絡(luò),發(fā)展問題意識(shí),培養(yǎng)科學(xué)探究能力,在實(shí)驗(yàn)探究過程中,培養(yǎng)學(xué)生的動(dòng)手能力,發(fā)展學(xué)生的合作能力,實(shí)現(xiàn)知識(shí)功能和素養(yǎng)功能的協(xié)調(diào)發(fā)展。
二、項(xiàng)目教學(xué)目標(biāo)
本文根據(jù)2017版課標(biāo)中對該主題的內(nèi)容要求以及學(xué)業(yè)要求和實(shí)習(xí)學(xué)校的實(shí)際情況,制定了以下項(xiàng)目教學(xué)目標(biāo):
(1)通過實(shí)驗(yàn)探究補(bǔ)鐵劑中的鐵元素存在形式,培養(yǎng)學(xué)生收集證據(jù)、猜想假設(shè)的能力,面對檢驗(yàn)多種離子的復(fù)雜實(shí)際問題時(shí),能夠主動(dòng)分析問題,激活已知,制定改進(jìn)實(shí)驗(yàn)方案,形成證據(jù)意識(shí),發(fā)展學(xué)生問題解決能力,培養(yǎng)學(xué)生科學(xué)探究和合作交流的能力。
(2)通過實(shí)驗(yàn)探究補(bǔ)鐵劑中的鐵元素含量是否合格,促使學(xué)生思維發(fā)散,設(shè)計(jì)實(shí)驗(yàn)方案,培養(yǎng)學(xué)生科學(xué)探究能力;面對氫氧化亞鐵沉淀顏色變化的實(shí)驗(yàn)“意外”時(shí),會(huì)從物質(zhì)類別和元素價(jià)態(tài)的角度分析原因,促進(jìn)科學(xué)探究能力的提升。
(3)根據(jù)資料支持,了解人體吸收鐵的原理,聯(lián)系課堂,觀察、比較、概括出Fe2+與Fe3+的轉(zhuǎn)化模型,學(xué)會(huì)從物質(zhì)類別和元素價(jià)態(tài)的視角認(rèn)識(shí)變價(jià)元素物質(zhì)間
*通信聯(lián)系人,E-mail:yml116@ahnu.edu.cn的轉(zhuǎn)化關(guān)系,并建立認(rèn)知模型。
三、項(xiàng)目教學(xué)流程
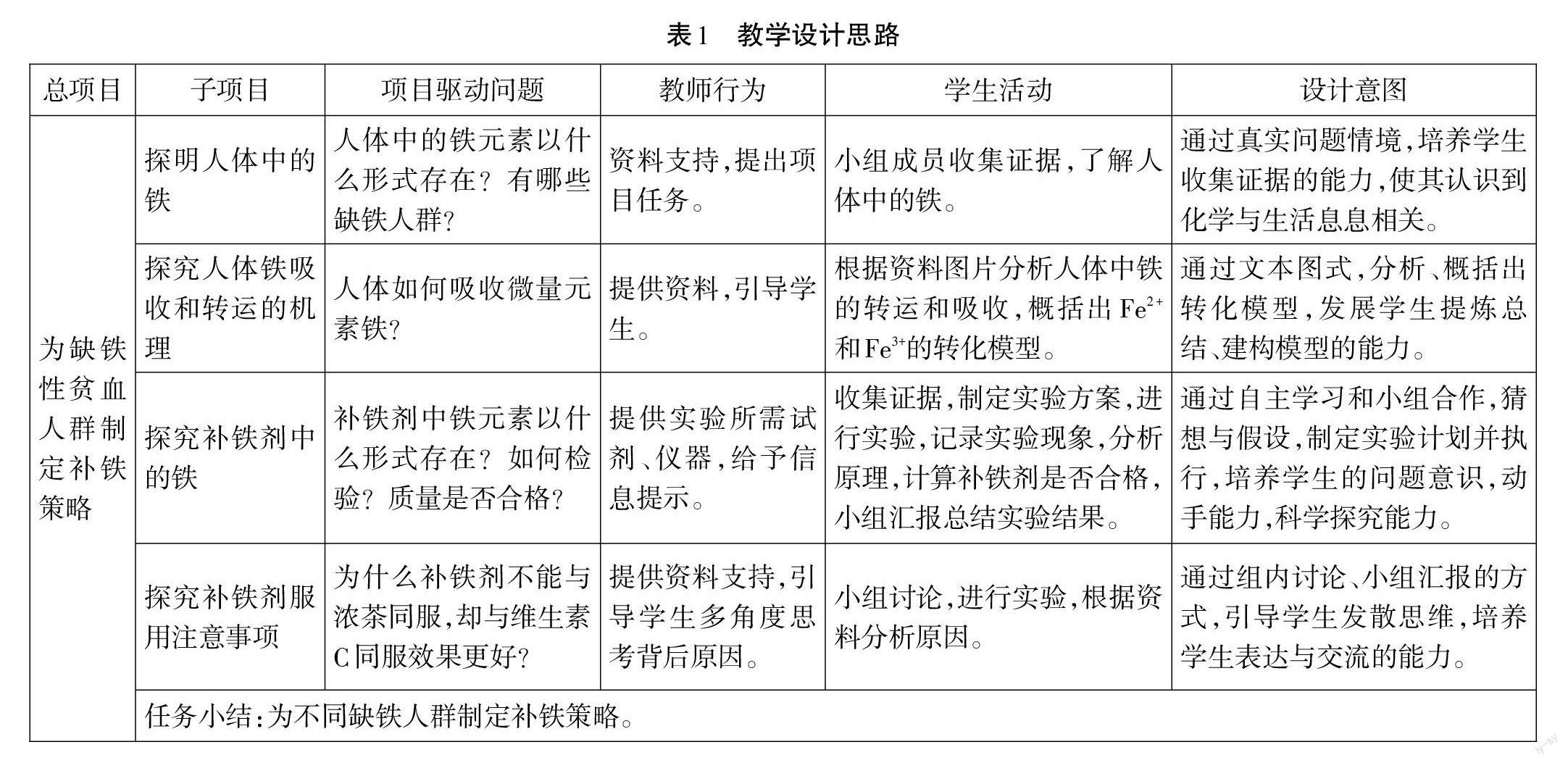
本項(xiàng)目教學(xué)設(shè)計(jì)思路如表1所示。
四、項(xiàng)目教學(xué)過程實(shí)錄
【創(chuàng)設(shè)情境】同學(xué)們對貧血這種疾病有所了解嗎?請閱讀下述材料。
【情境素材1】世界衛(wèi)生組織(WHO)和聯(lián)合國兒童基金會(huì)(UNICEF)等國際組織聯(lián)合發(fā)布的《2018年世界食品安全和營養(yǎng)報(bào)告》和《2019年世界兒童狀況:兒童、食物與營養(yǎng)》指出,全球仍有超過1/2的人口正面臨著微量營養(yǎng)素?cái)z取不足,即“隱性饑餓”。[4]微量營養(yǎng)素?cái)z人不足導(dǎo)致的嬰幼兒發(fā)育障礙和成年人免疫下降、肥胖和貧血等問題日趨嚴(yán)重,在人體所需微量元素中鐵元素含量最多,學(xué)齡前兒童、孕齡女性的貧血比例更是高達(dá)1/3。中國營養(yǎng)學(xué)會(huì)推薦的中國居民鐵的攝人量為15~25 mg/天。
【學(xué)生】根據(jù)情境素材和查閱資料得知,缺鐵人群主要有嬰幼兒、孕婦、青少年三類人群,嬰幼兒因生長發(fā)育需鐵量較大,青少年因偏食易缺鐵,孕婦因妊娠需要易缺鐵。
【項(xiàng)目提出】鐵元素對人體來說十分重要,缺鐵人群也各有不同,那么缺鐵性貧血人群應(yīng)當(dāng)如何補(bǔ)鐵?今天請各位“小醫(yī)生”來為缺鐵性貧血人群開具補(bǔ)鐵處方吧。
1.探明人體中的鐵
【項(xiàng)目驅(qū)動(dòng)性問題】若需要補(bǔ)鐵,需先明確人體中的鐵元素以什么形式存在?
【情境素材2】
(1)細(xì)胞中有兩種形式的鐵:Fe2+和Fe3+。Fe3+性質(zhì)較穩(wěn)定,可以作為鐵的儲(chǔ)存和運(yùn)輸形式;Fe2+可以轉(zhuǎn)移電子,參與人體內(nèi)各種氧化還原反應(yīng)并可充當(dāng)反應(yīng)催化劑。[5]
(2)血紅蛋白(Hb)是血液中運(yùn)輸氧及二氧化碳的蛋白質(zhì),由球蛋白和血紅素結(jié)合而成。血紅素是由中心Fe2+和配體卟啉衍生物結(jié)合成的大環(huán)配位化合物,其結(jié)構(gòu)如圖1所示。[6]
【小組匯報(bào)】人體中的鐵元素主要以Fe2+和Fe3+的形式存在,F(xiàn)e3+作為鐵的儲(chǔ)存形式,F(xiàn)e2+則是人體能夠直接吸收的鐵。
2.探究人體鐵的吸收和轉(zhuǎn)運(yùn)
【項(xiàng)目驅(qū)動(dòng)問題】普通人通過食物獲得鐵,缺鐵病人服用補(bǔ)鐵劑補(bǔ)鐵。食物中的鐵都是Fe2+嗎?人體是如何吸收鐵的呢?
【情境素材3】
飲食中的鐵存在于亞鐵血紅素和非亞鐵血紅素中,前者主要來自肉制品,后者來自肉類和植物。亞鐵血紅素為可溶性二價(jià)鐵,可被腸粘膜細(xì)胞直接吸收。非亞鐵血紅素主要以鐵離子(Fe3+)的形式存在于食物中,這些鐵離子必須被還原成亞鐵離子(Fe2+)才能運(yùn)輸?shù)侥c細(xì)胞中。
當(dāng)食物進(jìn)入人體時(shí),胃酸中的HCl將食物中的鐵轉(zhuǎn)變?yōu)镕e2+和Fe3+,至腸道處,F(xiàn)e3+首先被細(xì)胞膜上的十二指腸細(xì)胞色素B(金屬還原酶)還原為可溶性的Fe2+,然后被細(xì)胞膜上的轉(zhuǎn)運(yùn)蛋白質(zhì)(DMTl)轉(zhuǎn)運(yùn)至腸細(xì)胞內(nèi)。Fe2+進(jìn)入細(xì)胞內(nèi),一部分成為鐵蛋白儲(chǔ)存起來,一部分透過細(xì)胞膜進(jìn)入血液,經(jīng)銅藍(lán)蛋白氧化成Fe3+,與轉(zhuǎn)鐵蛋白結(jié)合后轉(zhuǎn)運(yùn)到組織,再與轉(zhuǎn)鐵蛋白分離并還原成Fe2+,參與形成血紅蛋白。[7-8]腸道鐵吸收和轉(zhuǎn)運(yùn)的機(jī)理圖根據(jù)教學(xué)實(shí)際稍作修改,如圖2所示。[7]
【教師】根據(jù)這段素材,請你從化學(xué)的角度分析腸道中Fe3+與Fe2+的相互轉(zhuǎn)化。
【小組討論】從元素價(jià)態(tài)上看,F(xiàn)e3+處于鐵元素的最高價(jià)態(tài),具有氧化性,可被還原劑還原為Fe2+;Fe2+處于鐵元素的中間價(jià)態(tài),既具有還原性又具有氧化性,可被氧化劑氧化為Fe3+。
【小組匯報(bào)】
氧化劑:KMnO4(H+)、H2O2、新制氯水等
還原劑:Cu、Fe等
【小結(jié)】從元素價(jià)態(tài)一物質(zhì)類別的角度,總結(jié)Fe2+與Fe3+的轉(zhuǎn)化模型。
3.探究補(bǔ)鐵劑中的鐵
【藥品展示】市面常見補(bǔ)鐵劑有乳酸亞鐵、硫酸亞鐵等,以FeSO4為例,見圖3。
【項(xiàng)目驅(qū)動(dòng)問題】該補(bǔ)鐵劑中的鐵元素是以什么形式存在的?是Fe2+還是Fe3+呢?如何檢驗(yàn)?該補(bǔ)鐵劑中鐵的含量是否符合標(biāo)準(zhǔn)呢?
【小組討論】制定檢驗(yàn)補(bǔ)鐵劑是否合格的實(shí)驗(yàn)方案,見圖4。
【小組匯報(bào)】根據(jù)硫酸亞鐵片的說明書,其主要成分為FeSO4,F(xiàn)e2+易被氧化,推測出樣品溶液中存在三種可能性:①溶液中只有Fe2+;②溶液中只有Fe3+;③同時(shí)含有Fe2+和Fe3+。
【小組實(shí)驗(yàn)】將5片硫酸亞鐵片(m=2.6 g)研碎溶于200mL水中,加入約2 mL HCl,制得樣品溶液3份。
【教師】溶液中可能既存在Fe2+,也存在Fe3+。如何檢驗(yàn)這兩種離子呢?
【學(xué)生1】溶液中可能含有Fe2+和Fe3+兩種離子,可先檢驗(yàn)Fe2+,再檢驗(yàn)Fe3+。
【學(xué)生2】Fe2+鹽溶液為淺綠色,F(xiàn)e3+鹽溶液為棕黃色,可以通過觀察樣品溶液的顏色來判斷。
【學(xué)生3】如果溶液中只有少量的Fe2+被氧化為Fe3+,顏色變化不明顯,無法判斷溶液中存在何種離子。
【教師】同學(xué)們說得都有理,通過顏色觀察來判斷樣品溶液中離子的種類暫時(shí)不可行。還有沒有其他的方法可以在溶液中可能存在Fe3+的情況下檢驗(yàn)出Fe2+是否存在呢?
【小組討論】根據(jù)之前學(xué)習(xí)檢驗(yàn)氯氣的方法——淀粉碘化鉀試紙,從氧化還原的角度出發(fā),F(xiàn)e2+處于鐵元素的中間價(jià)態(tài),F(xiàn)e2+具有還原性和氧化性,F(xiàn)e3+處于鐵元素的較高價(jià)態(tài),F(xiàn)e3+主要體現(xiàn)氧化性,因此,選擇紫色的酸性高錳酸鉀溶液來鑒別。實(shí)驗(yàn)步驟及現(xiàn)象:將樣品溶液I加入KMnO4(H+)中,若紫色褪去,則證明含有Fe2+。
【追問】Fe3+又該如何檢驗(yàn)?zāi)兀?/p>
【資料支持】含有Fe3+的鹽溶液遇到KSCN溶液時(shí)變成紅色,可用來檢驗(yàn)Fe3+。[3]
【教師】同學(xué)們,光說不練假把式。請同學(xué)們依據(jù)剛才的猜想完成實(shí)驗(yàn)(見表2)。
【小組實(shí)驗(yàn)】分組實(shí)驗(yàn),完成表2相關(guān)內(nèi)容。
【小結(jié)】應(yīng)用物質(zhì)類別一元素價(jià)態(tài)模型,總結(jié)檢驗(yàn)Fe2+和Fe3+的方法。
【教師】現(xiàn)已驗(yàn)證樣品溶液中同時(shí)存在Fe2+和Fe3+,該如何測量溶液中鐵元素的質(zhì)量呢?
【小組討論】鐵元素在溶液中以離子形式存在,難以測量。可將溶液中的亞鐵離子、鐵離子轉(zhuǎn)化為沉淀,易于稱量。
【教師】耳聽為虛,眼見為實(shí)。請同學(xué)們完成Fe(OH)2和Fe(OH)3的制備實(shí)驗(yàn),并完成表3。
【資料支持】部分酸、堿和鹽的溶解性表:Fe(OH)2白色沉淀,F(xiàn)e(OH)3紅褐色沉淀。[3]
【小組實(shí)驗(yàn)】分組實(shí)驗(yàn),并完成表3。
【學(xué)生】實(shí)驗(yàn)1中觀察到生成了灰綠色沉淀,最終變?yōu)榱思t褐色,未看到白色沉淀。實(shí)驗(yàn)2中觀察到生成了紅褐色沉淀Fe(OH)3,實(shí)驗(yàn)3中生成灰綠色沉淀,最終變?yōu)榧t褐色。Fe(OH)2沉淀難道不是白色嗎?
【演示實(shí)驗(yàn)】在盛有FeSO4溶液的試管中覆蓋一層煤油,加入一小塊鈉。觀察實(shí)驗(yàn)現(xiàn)象,見圖7。
【小組討論】實(shí)驗(yàn)現(xiàn)象:鈉在煤油層和水層中來回跳動(dòng),產(chǎn)生氣泡,生成了白色沉淀。實(shí)驗(yàn)原理:煤油密封試管,隔絕O2。p(H2O)>p(Na)>p(煤油),鈉在油層和水層之間來回跳動(dòng),遇水生成了NaOH,與FeSO4反應(yīng)生成了白色沉淀Fe(OH)2。
【追問】為什么Fe(OH)2的顏色會(huì)發(fā)生變化呢?
【小組討論】Fe2+為+2價(jià),屬于鐵元素的中間價(jià)態(tài),具有還原性,據(jù)此推測,F(xiàn)e(OH)2也具有還原性,易被空氣中的O2氧化成Fe(OH)3。
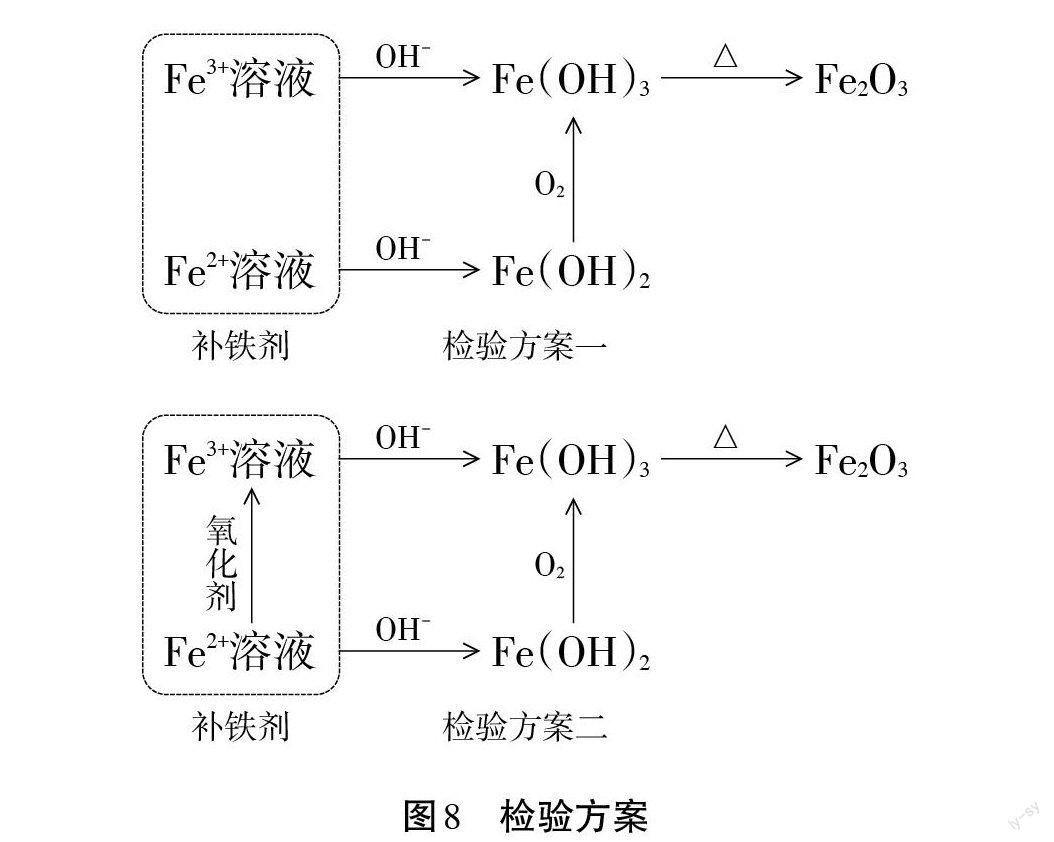
【追問】Fe(OH)2易被氧化成Fe(OH)3,為了計(jì)算方便能否將兩種沉淀轉(zhuǎn)化為一種呢?
【成果展示】見圖8。
【教師】這兩個(gè)實(shí)驗(yàn)方案哪一個(gè)更好?
【小組討論】方案二更好,操作簡便。
【教師】拿出事先干燥稱量好的Fe2O3,m(Fe2O3)=0.3 g,m(樣品)=2.6 g。
【小組討論】補(bǔ)鐵劑中鐵元素質(zhì)量分?jǐn)?shù)計(jì)算公式為:
【小組匯報(bào)】計(jì)算出補(bǔ)鐵劑中w(Fe)=11.54%>11.36%(說明書中的w(Fe)),該補(bǔ)鐵劑質(zhì)量合格。
【教師】除了沉淀法測量補(bǔ)鐵劑中鐵元素的含量之外,還有其他方法可以測量。如:氧化還原滴定法、比色法、原子發(fā)射光譜法……。
4.探究補(bǔ)鐵劑服用的注意事項(xiàng)
【項(xiàng)目驅(qū)動(dòng)問題】補(bǔ)鐵劑為什么不能與濃茶同服,卻與維生素C同服效果更好?
【實(shí)物展示】硫酸亞鐵片說明書,如表4所示。
【教師講解】茶水中含有大量的鞣酸,易與Fe2+反應(yīng)生成鞣酸亞鐵,鞣酸亞鐵化學(xué)性質(zhì)不穩(wěn)定,易被氧化為藍(lán)黑色的鞣酸鐵,人體難以吸收。而維生素C可以將Fe3+重新還原為Fe2+,抑制Fe2+的氧化。
【小組討論】制定茶水與FeSO4片實(shí)驗(yàn)方案:向茶水中加入FeSO4片粉末,觀察實(shí)驗(yàn)現(xiàn)象,再加入維生素C粉末,觀察實(shí)驗(yàn)現(xiàn)象,加入KSCN,觀察實(shí)驗(yàn)現(xiàn)象,再加入H2O2,觀察實(shí)驗(yàn)現(xiàn)象。
【小組實(shí)驗(yàn)】實(shí)驗(yàn)現(xiàn)象如圖9所示。
5.項(xiàng)目任務(wù):為缺鐵性貧血人群制定補(bǔ)鐵策略
經(jīng)過探究人體中的鐵、人體吸收鐵的過程、補(bǔ)鐵劑中的鐵,了解了補(bǔ)鐵劑服用的注意事項(xiàng)和課后查閱資料,部分小組項(xiàng)目成果展示見圖10。
五、項(xiàng)目教學(xué)效果與反思
本項(xiàng)目以“為缺鐵性貧血人群制定補(bǔ)鐵策略”為任務(wù),將總項(xiàng)目拆解為四個(gè)獨(dú)立且相關(guān)的子項(xiàng)目,在查閱文獻(xiàn)和實(shí)驗(yàn)探究相結(jié)合下,發(fā)展學(xué)生猜想與假設(shè)和收集證據(jù)的探究能力,通過抓住實(shí)驗(yàn)過程中的“意外”,培養(yǎng)學(xué)生發(fā)現(xiàn)問題的能力。在拆解總項(xiàng)目、完成各個(gè)子項(xiàng)目的過程中,使同學(xué)們形成宏觀與微觀相結(jié)合來研究物質(zhì)的基本思路,并且學(xué)會(huì)從元素價(jià)態(tài)、物質(zhì)類別兩個(gè)視角來認(rèn)識(shí)變價(jià)元素物質(zhì)間的轉(zhuǎn)化關(guān)系,并建立認(rèn)知模型,從而解決生產(chǎn)生活中簡單的化學(xué)問題。
本項(xiàng)目在取得一些成效的同時(shí),也暴露出了一些學(xué)生在實(shí)驗(yàn)過程中存在的問題和項(xiàng)目本身的不足之處。如面臨檢驗(yàn)樣品溶液中多種離子存在的問題時(shí),部分小組在制定實(shí)驗(yàn)計(jì)劃時(shí),思考不夠全面,變量控制意識(shí)薄弱,需要進(jìn)一步強(qiáng)化科學(xué)探究能力。此外,由于本項(xiàng)目中涉及人體內(nèi)鐵吸收和轉(zhuǎn)運(yùn)的醫(yī)學(xué)知識(shí),較為復(fù)雜,多由教師提供,需要繼續(xù)挖掘科學(xué)技術(shù)真實(shí)與學(xué)科知識(shí)間的聯(lián)系,加深問題解決與學(xué)習(xí)知識(shí)之間的聯(lián)系,在此基礎(chǔ)上進(jìn)一步完善該項(xiàng)目的教學(xué)設(shè)計(jì)。
參考文獻(xiàn)
[1]Joseph S Krajcik, Czerniak M Charlene, Carl F Berger.中小學(xué)科學(xué)教學(xué)——基于項(xiàng)目的方法與策略[M],王磊,等譯.北京:高等教育出版社,2004:9-13.
[2]中華人民共和國教育部,普通高中化學(xué)課程標(biāo)準(zhǔn)(2017年版2020年修訂)[s].北京:人民教育出版社,2020:15.
[3]王晶,鄭長龍.普通高中教科書(化學(xué)必修第一冊)[M].北京:人民教育出版社,2019:120.
[4]Anne-Sylvia Sacri, Alain Bocquet, Mariane D Montalem-bert, et al. Young children formula consumption and Irondeficiency at 24 months in the general population:A nation-al-level study[J].Clinical Nutrition,2021,40(1):166-173.
[5]Sundararaman Swaminathan. Iron homeostasis pathways astherapeutic.targets in acute kidney injury[J].Nephron,2018,40(2):156-159.
[6]宋天佑,徐家寧,程功臻,等,無機(jī)化學(xué):下冊(3版)[M].北京:高等教育出版社,2016:798-799.
[7]Sukru Gulec,James F Collins. Molecular mediators govem-ing Iron-Copper Interactions[J]. Annual Review of Nutri-tion,2014,34:95-116.
[8]袁粒星,高舉,潘玲麗.腸道鐵吸收及轉(zhuǎn)運(yùn)調(diào)節(jié)的研究進(jìn)展[J].現(xiàn)代預(yù)防醫(yī)學(xué),2005,32(12):1652-1654.

