SIRT1/p66Shc介導小檗堿對阿霉素誘導心肌毒性拮抗作用研究
武彥昭, 張蘭, 武子笑, 單菊彤, 時萍, 劉妍, 楊菲, 熊晨
(1.河北醫科大學第四醫院耳鼻咽喉及頭頸外科,河北石家莊 050011;2.承德醫學院基礎醫學院,河北承德 067000;3.河北醫科大學藥理教研室,河北石家莊 050017)
蒽環類藥物阿霉素(doxorubicin,DOX)是臨床常用的抗惡性腫瘤的藥物,具有抗瘤譜廣、抗瘤活性強的特點,常被用來治療急性白血病、淋巴瘤、骨腫瘤、乳腺癌和卵巢癌等多種惡性腫瘤[1]。然而,DOX 在發揮抗腫瘤作用的同時,由于其對心肌組織的親和力明顯高于其他組織,使DOX 容易蓄積于心肌細胞中,對心肌產生毒副作用,最終導致擴張性心肌病和充血性心力衰竭,故限制了其在臨床上的應用[2-4]。因此,迫切需要既預防DOX 誘導的心臟毒性,又不能以降低其抗腫瘤作用為代價的有效藥物。
引起DOX 心臟毒性的病理生理機制是多方面的,其中,越來越多的證據表明,過量產生的活性氧簇(ROS)和氧化劑誘導的線粒體損傷是DOX心臟毒性作用的重要因素[2,5]。因此,使用抗氧化劑是保護心肌細胞免受DOX 誘導氧化損傷和心臟毒性的重要策略。盡管從理論上講,針對氧化應激是合乎邏輯的,但當前大多數策略均無法取得滿意的心肌保護效果[6-7]。這些研究結果提示其他機制可能涉及DOX 引起的心臟毒性。顯然,DOX的心臟毒性并非歸因于單一靶標,而是涉及多條蛋白信號途徑。有研究發現,p66Shc 在DOX 引起的心肌細胞毒性機制中扮演著重要的角色[8],但其基本機制尚未完全闡明。p66Shc 是一種新發現的細胞內關鍵介質,誘導氧化應激生成過量ROS,參與促進線粒體氧化應激信號誘導細胞凋亡[9-10]。有研究發現,p66Shc 基因敲除嚙齒動物的壽命大約延長30%,且對氧化應激和氧化應激依賴性病理有顯著的抵抗力[11-13]。亦有研究表明,在DOX誘導的心臟毒性中,p66Shc 的表達明顯上調[9,14]。故選擇性抑制p66Shc 通路是一種很有前途的對抗DOX 心臟毒性的方法。迄今為止,尚無p66Shc 蛋白的特異性藥物抑制劑。沉默信息調節因子2同源蛋白1(SIRT1)是一種氧化應激負調節因子,其功能與煙酰胺腺嘌呤二核苷酸(NAD+)依賴的Ⅲ類組蛋白脫乙酰化酶(HDAC)相同[15-16]。已有研究表明,p66Shc 確是SIRT1 的靶標,其表達可以通過SIRT1 上調至少部分減少[17-18],而SIRT1 基因的敲除增強了p66Shc的表達[19]。基于此,我們認為SIRT1介導的p66Shc 抑制可能參與了DOX 誘導的心臟毒性,但SIRT1/p66Shc 通路的確切作用仍然存在爭議。
小檗堿(berberine,Ber)是一種異喹啉類生物堿,為中藥黃連的主要成分,現被作為廣譜抗菌素用于胃腸炎、細菌性痢疾等疾病的治療。越來越多的臨床試驗研究表明,Ber對代謝癥候群和心血管疾病具有很好的治療作用[20-22]。研究發現,Ber 還有抗腫瘤和心臟保護的作用[23-24]。DOX 聯合Ber應用不僅可增強DOX抗腫瘤作用[25],還可降低DOX引起的急性心肌損傷[26],但Ber保護心肌的確切機制目前仍不清楚。值得關注的是,研究報道Ber 可能通過激活SIRT1 信號通路在各種病理條件下產生保護作用[27-28]。然而,SIRT1 信號通路是否參與Ber在DOX誘導的心功能障礙中的保護作用及其機制尚不清楚。因此,本研究構建DOX 損傷AC16 心肌細胞模型,重點探討Ber 能否通過抗氧化作用及線粒體保護作用從而保護心肌細胞對抗DOX 心肌毒性,明確SIRT1/p66Shc 通路是否參與DOX誘導的心肌細胞毒性,明確Ber的保護作用是否主要與SITT1/p66Shc 通路的調節有關,以期為深入闡明Ber 的心肌保護作用提供新的實驗依據,現將研究結果報道如下。
1 材料與方法
1.1 藥物、試劑與儀器小檗堿、阿霉素(美國Sigma Aldrich 公司)。p66Shc、β-actin 和SIRT1 等抗體(美國圣克魯斯生物技術公司);錳超氧化物歧化酶(Mn-SOD)及Bax 抗體(美國Abcam 公司);熒光染料Rh123、Rhod 2-AM 和EX527(美國Sigma Aldrich 公司);其他化工產品購自天津北方天醫化學試劑廠。SpectraMax 190 微量滴定讀板器(美國Molecular Device 公司);Lasersharp MRA2 激光共聚焦顯微鏡(美國Bio-Rad公司)。
1.2 細胞來源、培養與處理方法人心肌細胞系AC16來源于中國科學院(上海)。以DMEM 培養基(加入1.5 g/L碳酸氫鈉、10%胎牛血清、100 U/mL青霉素和100 μg/mL鏈霉素),在37 ℃、5%CO2的加濕環境中培養。取80%融合生長、狀態良好的對數生長期AC16 細胞,用胰酶消化制成單細胞懸液,以5 × 104個/mL 細胞密度接種于96 孔板中,每孔接種100 μL。預處理按如下步驟實施:①DOX對AC16 細胞的毒性作用:先用PBS 清洗2 次,換用無胎牛血清培養基,并加入不同濃度的DOX(0.1、0.5、1、5、10 μmol/L)作用24 h。②觀察不同濃度Ber 對DOX 損傷心肌作用的影響:采用0.1、1、10 μmol/L 濃度的Ber處理AC16細胞24 h,再用1 μmol/L 的DOX 處理24 h,建立細胞損傷模型。③觀察應用EX527預處理1 h對DOX損傷心肌作用的影響:在Ber 處理前1 h,用10 μmol/L EX527(SIRT 抑制劑)對細胞進行預處理,接著給予1 μmol/L DOX 作用24 h。對照組加入相同體積的相應溶劑。
1.3 四甲基偶氮唑鹽(MTT)法測定細胞活力將細胞(1×105個/mL)接種于96孔培養板中,待細胞生長至80%融合后,按照上述“1.2”項進行分組處理。處理后,每孔加入10 μL MTT染料(5 mg/mL),繼續培養4 h。然后將培養基丟棄,將150 μL二甲基亞砜(DMSO)加入到各孔中,搖床震蕩15 min。待結晶物充分溶解后,使用微量滴定讀板器于490 nm波長處測量吸光度(OD值)。空白對照組的細胞存活率視作100%,給藥處理組的細胞存活率=給藥處理組OD值/對照組OD值×100%。
1.4 細胞內ROS水平的測定取對數生長期80%~90%融合生成狀態良好的AC16 細胞消化后配制成細胞懸液,點在圓形蓋玻片上,每孔接種100 μL,37 ℃、5%CO2及飽和濕度下孵育4 h 后,每孔加入100 μL培養基,孵育過夜。加入1 μmol/L Ber處理30 min后分別加入1 μmol/L DOX和10 μmol/L EX527進行分組:對照組、DOX 組、Ber+DOX 組、Ber+DOX+EX527 組。置于培養箱中培養24 h。采用PBS 清洗2 次,將ROS 特異性熒光探針二氯熒光黃雙乙酸鹽(DCFH-DA)稀釋成1 μmol/L,染色30 min,激光共聚焦顯微鏡FITC 模式下檢測細胞熒光強度。
1. 5蛋白免疫印跡(Western Blot)法檢測細胞p66Shc、SIRT1、Mn-SOD、Bax的蛋白表達各實驗組AC16細胞給予不同的處理因素后,先用預冷的PBS 洗2 遍,裂解取上清,采用二喹啉甲酸(BCA)法進行蛋白定量。從每個樣品中分離出等量的蛋白質(50 μg),經十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離后,轉移到聚偏氟乙烯(PVDF)膜上。用5%脫脂奶粉(50 mm Tris-HCl,150 mm NaCl,0.1% Tween,pH 7.4)室溫封閉1 h 后,分別加入p66Shc 抗體(1∶200 稀釋)、SIRT1 抗體(1∶200 稀釋),Mn-SOD 抗體(1∶1 000稀釋)及Bax 抗體(1∶1 000 稀釋),4 ℃過夜,采用TBST 洗3 次,10 min/次。然后加入相應二抗(1∶2 000 稀釋),37 ℃孵育1 h,TBST 洗3 次,10 min/次。將PVDF 膜用電化學發光試劑(ECL)顯色,暗室曝光到X 線片上,凝膠成像系統掃描分析結果。
1.6 線粒體膜電位(MMP)及線粒體內鈣([Ca2+]m)的測定當AC16細胞生長到約80%融合時,根據實驗需要給予不同的條件培養基。用DOX和Ber處理結束后,用PBS 洗2 次,在含有100 μg/L Rh123的無血清培養基中37 ℃孵育30 min。Rh123 是一種親脂性陽離子熒光染料,對細胞膜具有通透性,可選擇性地富集在線粒體上。細胞處于存活狀態時,Rh123通過細胞膜,積聚于線粒體發出綠色熒光。在細胞凋亡時,線粒體膜的轉運能力下降,電負性降低,細胞線粒體積聚Rh123 的能力也喪失,熒光強度降低[8]。據此可檢測MMP的變化以反映細胞的凋亡情況。激光共聚焦顯微鏡FITC模式下檢測細胞熒光強度,通過圖像分析系統進行定量分析。
用熒光染料Rhod 2-AM(分子探針)測定線粒體Ca2+濃度([Ca2+]m)。將AC16 培養物轉移至含有10 μmol/L Rhod-2 AM 的1 mL 新鮮DMEM 中,于4 ℃培養120 min,然后于37 ℃培養30 min。然后,將Rhod-2 AM 負載細胞置于共焦顯微鏡臺上,通過510 nm 和570 nm 帶通勢壘濾光片對[Ca2+]m進行熒光分析,最后選擇10 000 個細胞的中位熒光強度計算[Ca2+]m。
1.7 統計方法采用SPSS 13.0統計軟件進行數據分析,所有數值均以均數±標準差(±s)表示,獨立樣本和2 組數據間的比較均采用雙側t檢驗。以P<0.05 為差異有統計學意義。
2 結果
2.1 Ber對DOX降低心肌細胞存活率的影響為了檢測不同濃度DOX和Ber處理后的細胞活性,采用MTT比色法測定細胞存活率。AC16細胞暴露于不同濃度(0.1、0.5、1、5、10 μmol/L)的DOX 12、24、48 h 后,結果顯示,隨著時間及濃度的增加,細胞存活率顯著下降,至24 h 作用更為明顯,一直持續到48 h。具體結果見表1。結果表明,DOX對AC16細胞具有明顯的抑制作用,且呈劑量依賴性。由于在24 h時DOX對AC16細胞已經產生了明顯的抑制作用,考慮細胞生長代謝的影響,本研究將給藥時間確定為24 h。進一步檢測DOX 孵育24 h 使AC16 細胞存活率下降50%的濃度為1.07 μmol/L,故在后續實驗中均用1 μmol/L 建立DOX AC16細胞損傷模型。
表1 阿霉素(DOX)對AC16細胞存活率的影響Table 1 Effect of DOX on the survival rate of AC16 cells (±s,%)

表1 阿霉素(DOX)對AC16細胞存活率的影響Table 1 Effect of DOX on the survival rate of AC16 cells (±s,%)
①P<0.01,與對照組比較
組別對照組0.1 μmol/L DOX 0.5 μmol/LDOX 1 μmol/LDOX 5 μmol/L DOX 10 μmol/L DOX 48 h 0.45±0.09 0.32±0.07①0.30±0.04①0.27±0.05①0.19±0.03①0.12±0.04①12 h 0.51±0.06 0.48±0.05 0.43±0.08 0.40±0.06①0.39±0.03①0.34±0.05①24 h 0.38±0.07 0.41±0.04 0.38±0.01 0.26±0.02①0.23±0.01①0.18±0.05①
本研究利用心肌細胞AC16 作為模式細胞株,在用1 μmol/L DOX處理AC16心肌細胞前,應用不同濃度(0.1、1、10 μmol/L)的Ber 分別預處理24 h,并對細胞活性進行評價。結果顯示:0.1、1、10 μmol/L Ber 對AC16 細胞存活率均無明顯影響(P>0.05),但0.1、1、10 μmol/L Ber 預處理皆能明顯提高DOX 致AC16 細胞存活率的下調(P<0.01),并且呈劑量依賴性。具體結果見表2。表明Ber可減輕DOX對AC16細胞的損傷。0.1、1 μmol/L Ber與DOX處理的細胞比較,細胞存活率分別提高了25%、41%,而高濃度的Ber(10 μmol/L)對細胞活力的提高無明顯優勢。因此,在后續實驗中我們選擇1 μmol/L劑量的Ber對抗DOX產生的毒性進行體外實驗。
表2 小檗堿(Ber)對阿霉素(DOX)降低AC16細胞存活率的影響Table 2 Effect of Ber on the reduction of AC16 cell survival by DOX (±s)

表2 小檗堿(Ber)對阿霉素(DOX)降低AC16細胞存活率的影響Table 2 Effect of Ber on the reduction of AC16 cell survival by DOX (±s)
①P<0.01,與對照組比較;②P<0.05,③P<0.01,與DOX組比較
細胞存活率/%0.41±0.07 0.40±0.09 0.39±0.09 0.42±0.08 0.24±0.05①0.28±0.03②0.36±0.05③0.38±0.06③組別對照組Ber 0.1 μmol/L組Ber 1 μmol/L組Ber 10 μmol/L組DOX 1 μmol/L組Ber 0.1 μmol/L+DOX 1 μmol/L組Ber 1 μmol/L+DOX 1 μmol/L組Ber 10 μmol/L+DOX 1 μmol/L組
2. 2 SIRT1參與Ber對DOX引起的心肌細胞內ROS水平升高的影響采用濃度為1 μmol/L 的Ber預處理AC16細胞24 h、繼用1 μmol/L的DOX進行處理24 h 后,對心肌細胞ROS 水平進行定量評價。激光共聚焦結果顯示,將對照組的ROS 水平設為100%,用1 μmol/L DOX處理24 h后,熒光比值為(218.7 ± 16.9)%,相比于對照組ROS 的水平出現顯著性的升高(P<0.01),提示DOX致心肌細胞氧自由基增多。而用1 μmol/L Ber 預處理24 h、繼用1 μmol/L DOX 處理24 h 后,心肌細胞ROS 的水平降至(168.25 ± 11.44)%,相比于DOX 處理組出現顯著性的降低(P<0.01),提示Ber 預處理能夠降低由DOX 引起的心肌細胞氧自由基增加的現象。然而,在細胞暴露于Ber+DOX 之前1 h 加入SIRT1 抑制劑EX527 可逆轉Ber 降低ROS 的作用(P<0.01)。具體結果見圖1。
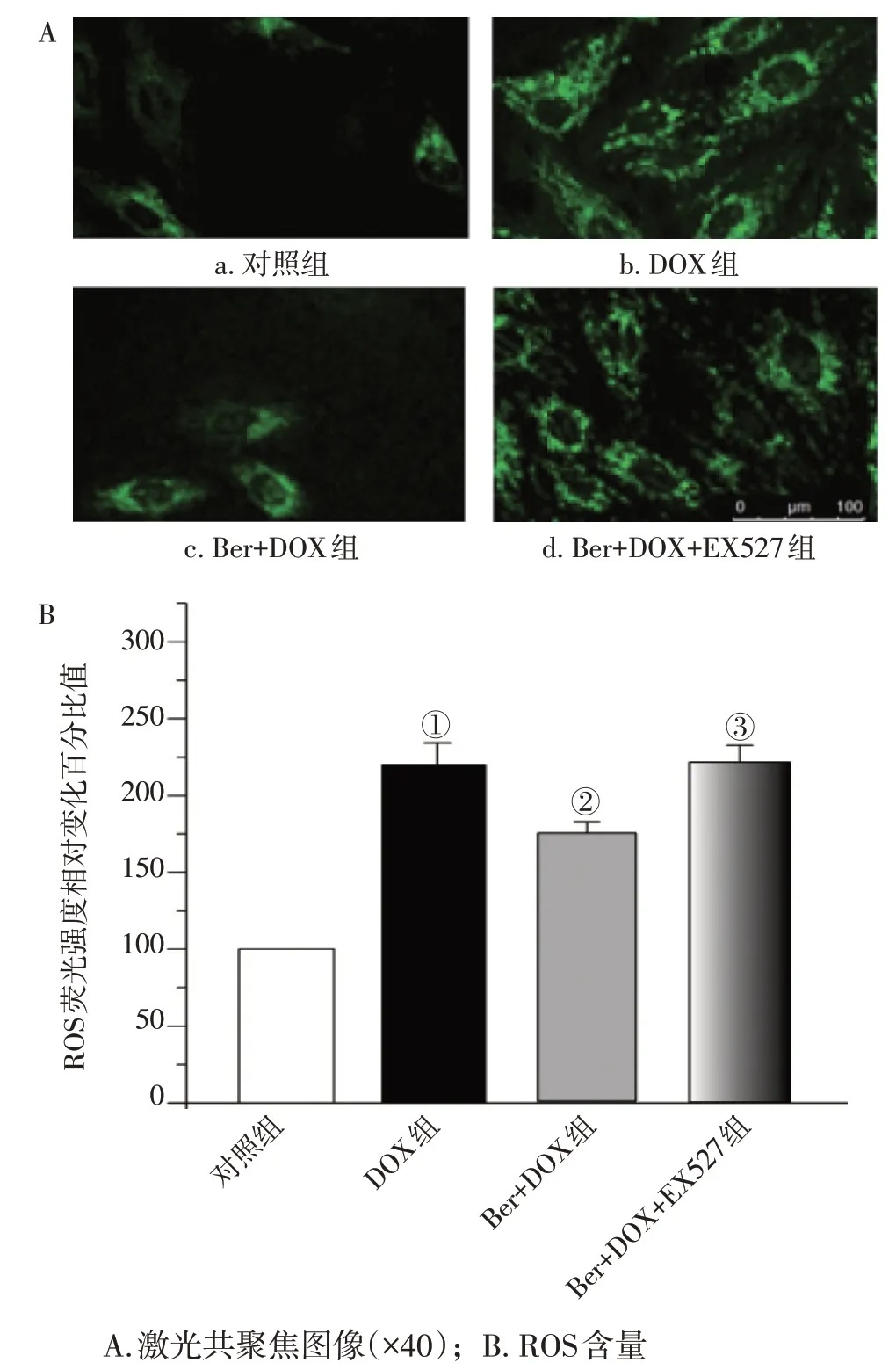
圖1 小檗堿(Ber)對阿霉素(DOX)誘導后的AC16細胞內活性氧簇(ROS)含量升高的影響Figure 1 Effect of Ber on elevated ROS content in AC16 cells after DOX induction
2. 3 Ber干 預 對DOX致AC16心 肌 細胞SIRT1和p66Shc蛋白表達的影響為了驗證p66Shc 下調和SIRT1激活與Ber干預的拮抗DOX心毒性有關的假說,我們測定了在Ber作用下的SIRT1和p66Shc蛋白表達變化。Western Blot 分析結果顯示,1 μmol/L DOX 處理的AC16 細胞中p66Shc 蛋白表達明顯增加(P<0.01),而SIRT1 表達明顯減少(P<0.01)。與此相反,Ber 增強了SIRT1 的蛋白表達,但明顯抑制了p66Shc 的蛋白表達。我們假設Ber 在DOX誘導的心臟毒性中的拮抗作用可能與SIRT1介導的p66Shc 表達抑制有關。為了進一步驗證上述假說,我們在24 h 1 μmol/L DOX 處理前,用SIRT1抑制劑EX527 預處理AC16 細胞1 h,結果顯示,與SIRT1 負性調節p66Shc 表達的觀察結果一致。這進一步表明,與Ber + DOX 組比較,預先加用SIRT1抑制劑EX527預處理AC16細胞組中,Ber上調SIRT1 及下調p66Shc 表達的效應顯著減弱(P<0.01),提示Ber通過激活SIRT1參與調控p66Shc的表達。具體結果見圖2。

圖2 小檗堿(Ber)干預對阿霉素(DOX)誘導AC16心肌細胞SIRT1和p66Shc蛋白表達的影響Figure 2 Effect of Ber intervention on SIRT1 and p66Shc protein expression in AC16 cardiomyocytes induced by DOX
2.4 SIRT1激活對DOX誘導心肌細胞線粒體損傷的影響線粒體在維持Ca2+穩態中起著重要作用,是DOX 對心肌細胞毒性的靶細胞器。線粒體內外膜的電位差稱為線粒體膜電位(MMP),MMP 是控制線粒體基質、細胞呼吸和ATP合成中Ca2+積累的重要參數。為明確DOX 對心肌細胞線粒體是否造成損傷,我們用DOX 作用于AC16 細胞,采用Rh123 染色法測定給藥后24 h MMP 的變化情況。為了進一步研究SIRT1 對p66Shc 的抑制是否能夠防止DOX誘導的線粒體損傷,Ber的保護作用是否參與了這一途徑,本研究觀察了給予1 μmol/L DOX 后心肌細胞內Rh123 熒光強度的相應變化。共聚焦圖像結果(見圖3-A)顯示,1 μmol/L DOX處理AC16細胞24 h可使MMP明顯降低,但1 μmol/L Ber 預處理1 h 能明顯地減輕DOX 對線粒體的損傷作用,使MMP 升高(P<0.01),減弱了DOX 誘導的Rh123熒光強度的降低。而EX725抑制了Ber對DOX 致線粒體損傷的修復作用。這些結果表明,Ber 阻止了DOX 誘導的MMP 的丟失,這可能與SIRT1 的激活有關。因線粒體Ca2+超載導致線粒體功能障礙,我們觀察了Ber是否能夠減弱由DOX治療引起的[Ca2+]m水平的增加。采用Rhod2-AM 熒光探針法檢測評價[Ca2+]m的處理特性,[Ca2+]m也有類似的結果,DOX組心肌細胞[Ca2+]m較對照組顯著增加,而Ber 明顯抑制DOX 誘導的[Ca2+]m的增加,如圖3-B所示。相反,這些改變可以通過SIRT1抑制劑EX527逆轉。結果表明,Ber治療顯著地阻止了DOX誘導的心肌細胞MMP和[Ca2+]m異常。

圖3 小檗堿(Ber)對阿霉素(DOX)誘導后的AC16細胞線粒體損傷的影響Figure 3 Effect of Ber on mitochondrial damage in AC16 cells after DOX induction
2. 5 SIRT1抑制劑干預對Ber減輕DOX所致心肌細胞氧化損傷及凋亡的影響為進一步探討SIRT1/p66Shc通路在Ber修復DOX所致心肌細胞損傷中的作用,利用心肌細胞AC16 觀察了Ber 對心肌細胞氧化應激相關蛋白質(如超氧化物清除劑Mn-SOD)以及凋亡相關因子(如Bax)的影響。Western Blot 分析結果顯示,與對照組比較,DOX處理后Mn-SOD 蛋白表達明顯降低(P<0.01),而Ber + DOX 處理后Mn-SOD 表達明顯升高(P<0.01)。表明Ber可能通過上調Mn-SOD蛋白表達而提高Mn-SOD的活性,提示Ber預處理能夠降低心肌細胞氧化水平。用濃度為1 μmol/L的Ber預處理24 h 后,再用1 μmol/L 的DOX 進行處理24 h,對心肌細胞凋亡蛋白Bax 進行Western Blot 檢測,結果顯示,對照組心肌細胞凋亡蛋白Bax幾乎不表達,表明心肌細胞內無明顯細胞凋亡事件。用1 μmol/L DOX處理24 h后,心肌細胞凋亡蛋白Bax的表達水平出現顯著升高,提示DOX 處理導致心肌細胞發生凋亡,細胞內凋亡相關通路被激活,凋亡蛋白大量表達。而在用1 μmol/L Ber 預處理24 h,再以1 μmol/L DOX處理24 h,心肌細胞凋亡蛋白Bax的表達水平出現明顯的降低,提示Ber預處理能夠減少心肌細胞凋亡。結果表明,Ber 預處理可抑制DOX誘導的AC16細胞氧化應激和凋亡。為了闡明Ber 的抗氧化和抗凋亡活性與SIRT1 的關系,以及SIRT1在Ber拮抗DOX誘導心臟毒性中所發揮的作用,本研究進一步觀察了SIRT1 特異性抑制劑(EX527)是否對Ber 的保護作用有影響。結果發現,用特異性SIRT1 抑制劑EX725 對AC16 細胞進行預處理,可部分逆轉Ber對DOX誘導的心臟毒性的拮抗作用,表現為EX527 預處理可消除Ber 對Mn-SOD 及Bax 表達的影響。結果表明,Ber 對DOX 誘導心臟毒性的拮抗作用可部分通過SIRT1的活化來發揮作用,進一步證實了Ber降低DOX誘導的心臟毒性的氧化損傷及凋亡的效應與SIRT1/p66Shc通路相關。具體結果見圖4。
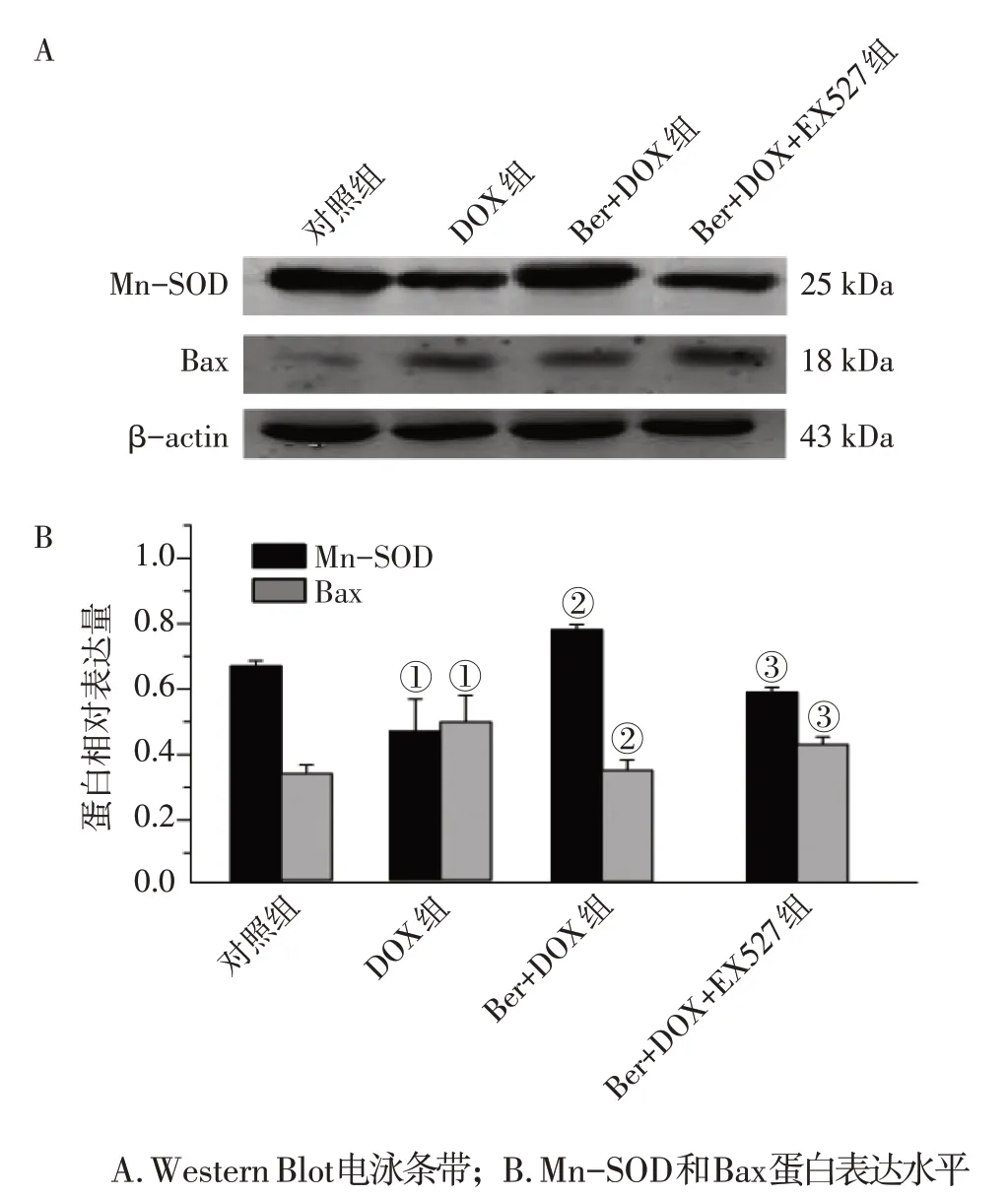
圖4 SIRT1參與小檗堿(Ber)對阿霉素(DOX)誘導的AC16細胞氧化應激和凋亡的拮抗作用Figure 4 The protective effect of SIRT1 involved in Ber on oxidative stress and apoptosis of DOX-induced AC16 cells
3 討論
阿霉素(DOX)致心臟毒性機制尚未完全了解,主要與氧自由基損傷、鈣超載、線粒體損傷、細胞凋亡等有關[29-30]。由于DOX在臨床腫瘤治療中的重要作用,研究和尋找既能減輕其心臟毒性,又能保持其抗腫瘤活性的藥物具有重要意義。值得關注的是,有研究表明DOX激活了p66Shc通路,導致蛋白質轉移到線粒體部分,進一步產生局部氧化應激[8],這可能有助于揭示DOX引起心臟毒性的新機制。故推測,p66Shc 下調可能阻礙DOX誘導的心臟毒性發展。
研究表明,在各種病理條件和疾病狀態下,p66Shc 作為一種氧化應激傳感器,通過其氧化還原酶活性和線粒體通透性轉換孔的開放,轉移到線粒體膜上,增加ROS 的生成,從而導致器官功能障礙[31]。本研究結果證實,p66Shc蛋白表達水平在DOX誘導的AC16心肌細胞損傷的模型中顯著增高,這提示p66Shc 在DOX 引起的心臟毒性中起重要作用,有望成為治療干預候選藥物作用的靶點。而p66Shc 信號通路是一個復雜的過程,目前還沒有特異的p66Shc 抑制劑。但越來越多的實驗和基于種群的證據表明,SIRT1是一個Ⅲ類組蛋白脫乙酰酶,通過表觀遺傳染色質修飾負面調節p66Shc表達[18]。激活的SIRT1有助于細胞對氧化應激產生抵抗[32-34]。基于這些發現,我們假設p66Shc可能是SIRT1 在DOX 誘導的心臟毒性中的作用靶點。本研究中,Western Blot結果顯示,DOX誘導后心肌SIRT1 蛋白表達明顯降低,p66Shc 明顯升高,Ber干預可逆轉這一趨勢。另外,體外實驗進一步證明,EX527作為SIRT1的特異性抑制劑,可以減弱小檗堿(Ber)對AC16 細胞經DOX 處理后p66Shc 表達的抑制作用。與此同時,Ber 可改善DOX 引起線粒體Ca2+超負荷及導致線粒體膜去極化,且這種作用可被EX527 所逆轉。總之,這些數據表明Ber介導的p66Shc抑制至少部分通過激活SIRT1 的表達發生,提示Ber 可能是一個潛在的SIRT1激活劑,并可能通過SIRT1上調來拮抗DOX誘導的心臟毒性。這一發現與文獻研究[35]結果相一致,即SIRT1對多巴胺誘導的線粒體生物合成障礙和心肌細胞毒性具有阻抑作用。SIRT1對p66Shc表達的調節可能是由于SIRT1 降低乙酰化組蛋白H3與p66Shc 啟動子區結合并抑制p66Shc 活性[33]。提示SIRT1/p66Shc 是預防DOX 心臟毒性的關鍵治療靶點,SIRT1/p66Shc通路的激活參與了Ber抗DOX心臟毒性作用。雖然本研究結果表明Ber可以減輕DOX 引起的心肌細胞毒性,但是否同樣在體內有效及其具體上下游信號通路仍不清楚,有待下一步深入的研究。
綜上所述,Ber預處理可以減輕DOX引起的心肌氧化應激和線粒體功能障礙,從而發揮對DOX誘導的心臟毒性的治療作用,其治療機制與SIRT1介導的p66Shc 抑制有關,提示該途徑是減輕DOX心肌毒性的一個新的潛在治療靶點。

