肝硬化并胸水再發(fā)危險因素的預測
周 敏,馬智慧,李加艷,范建華,林 靈,余亭穎,張慧芳,劉 立
(昆明市第三人民醫(yī)院/云南省傳染性疾病臨床醫(yī)學中心肝病科,云南 昆明 650041)
肝性胸水(hepatic hydrothorax,HH)是指各種原因引起的肝硬化失代償期患者在排除原發(fā)性心肺疾病的情況下出現(xiàn)的胸水性質為漏出性的積液,一般在 500 mL 以上[1-3],以右側多見(85%)[4],是肝硬化門脈高壓相對少見的并發(fā)癥。其發(fā)生率報道不一,國外報道0.4%~30%,國內報道2.1%~30.3%[5]。肝性胸水患者通常表現(xiàn)為咳嗽、胸悶、氣短等呼吸系統(tǒng)癥狀,嚴重的心慌、哮喘、行走困難等。通常肝性胸水的出現(xiàn)是肝硬化患者病情加重的表現(xiàn)之一,應該引起臨床醫(yī)生的重視。本研究通過獲取、觀察對比住院患者的相關檢查、實驗室指標,分析胸水再發(fā)的危險因素,并建立胸水再發(fā)風險的預測模型,然后對模型的有效性進行評價,為臨床更早預測胸水再發(fā)的高風險患者提供有效依據(jù)。
1 資料與方法
1.1 研究對象
本課題經昆明市第三人民醫(yī)院倫理委員會嚴格批準。選取2014 年4 月至2019 年12 月在昆明市第三人民醫(yī)院住院,確診為肝硬化失代償期患者并發(fā)大量胸水患者190 例作為研究對象。根據(jù)其經過治療胸水消退后是否發(fā)生胸水再發(fā)分為胸水再發(fā)組(n=29)和無胸水再發(fā)組(n=161)。其中男性116 例,女性74 例,年齡(21~85)歲,平均年齡(52.80±12.16)歲。
1.2 納入和排除標準
納入的標準 :(1)肝硬化的臨床診斷符合中華醫(yī)學會肝病學分會、傳染病學分會修訂的診斷標準[6];(2)入選的患者均符合《新編實用肝膽病學》[7]肝性胸水相關診斷標準;(3)出現(xiàn)胸悶、氣短、呼吸困難、咳嗽等癥狀,經X 線、B 超、CT 等影像學檢查證實為大量胸水;(4)肝硬化胸水患者經穿刺抽取胸水,檢測胸水常規(guī)和胸水生化等結果符合 Light’s 標準的漏出性胸腔積液患者[8];(5)均同意胸腔穿刺置管持續(xù)引流術。排除標準 :(1)患者本人或其監(jiān)護人拒絕進行胸水穿刺的患者;(2)合并肝占位性病變和原發(fā)性心、肺、腎等其他疾病導致的胸腔積液,如結核性胸膜炎等;(3)經評估Ⅱ期及以上的肝性腦病;(4)嚴重精神疾病不能配合者;(5)胸腔穿刺置管時間≤3 d。
1.3 治療方法
一般治療:入組的患者均控制水鈉攝入、適當使用利尿劑、維持酸堿平衡及糾正水電解質紊亂;給予必要的營養(yǎng)補充、輸注白蛋白和新鮮冰凍血漿制品;積極治療原發(fā)性疾病,如乙型肝炎進行抗病毒治療、酒精性肝硬化禁止飲酒等;控制誘發(fā)和高危因素;給予積極保護肝細胞、降酶、降低黃疸、防止并發(fā)癥等綜合治療;呼吸困難者適當吸氧并精心護理。
胸腔穿刺置管持續(xù)引流術:先由彩色超聲多普勤進行胸水定位,做好標識;患者取正坐位,穿刺點附近常規(guī)消毒、鋪洞巾后,給予鹽酸利多卡因注射液局部逐層浸潤麻醉;穿刺點進針直至進入胸腔,回抽見草黃色胸水后,沿穿刺針將彈性導絲緩慢導入,向后退出穿刺針,將留置管小心固定于胸壁皮膚,使用無菌敷料雙層覆蓋,外接引流管與引流袋持續(xù)連接,行緩慢持續(xù)引流;24 h 引流量保持在1 000 mL 以內;當24 h 引流量在100 mL 以下時,復查B 超確定胸腔內已經無明顯胸水后拔管。
1.4 研究方法
病歷資料的收集由課題組7 名肝病科臨床護理工作時間>5 a 的護士,收集2014 年4 月至2019 年12 月入住傳染科的肝硬化合并大量胸水病例190 例,2 組患者在入院后均給予了病因治療(如乙肝引起者抗病毒、酒精性肝病者嚴格戒酒等)、抗肝纖維化、保護肝細胞、調節(jié)免疫功能等基本相同的治療方法,并進行了胸腔穿刺置管引流術,出院后隨訪患者胸水再發(fā)情況。隨訪患者經過治療后胸水再發(fā)的情況,收集患者入院時的基線臨床資料及化驗指標,其中包括:患者年齡、性別、住院日數(shù)、血小板、肌酐、門靜脈血流脈沖多普勒、置管時間等,采取雙人核對的方法收集和錄入研究資料。將其是否發(fā)生胸水再發(fā)分為無胸水再發(fā)組(n=161)和胸水再發(fā)組(n=29)。
1.5 統(tǒng)計學處理
采用SPSS21.0 軟件進行統(tǒng)計分析,計量資料如果服從正態(tài)分布則采用平均數(shù)±標準差描述,組間比較采用t檢驗;計數(shù)資料采用卡方檢驗,將單因素分析具有統(tǒng)計意義的指標納入多因素分析,使用Logistic 回歸模型對肝硬化胸水發(fā)生危險因素進行多因素分析,使用AUROC 曲線驗證預測模型預測的敏感性和特異性。P<0.05 為差異有統(tǒng)計學意義。
2 結果
2.1 一般資料
本研究調查的190 例患者中,男性126 例,占比66.3%,女性64 例,占比33.6%;年齡21~85 歲,平均(52.80±12.16)歲;課題組收集患者的一般資料、實驗室資料等。資料包括住院患者年齡、住院天數(shù)、總膽紅素、谷氨酰轉肽酶、門冬氨酸氨基轉移酶、堿性磷酸酶、丙氨酸氨基轉移酶、總蛋白、胸水總蛋白、前白蛋白、白蛋白、血紅蛋白、血小板、凝血酶原時間、血肌酐、空腹血糖、胰島素、C 肽、門靜脈、門靜脈流速、胃底靜脈曲張程度、置管時間等。一般資料,見表1。
表1 190 例肝硬化失代償期患者一般資料()Tab.1 General data of 190 patients with decompensated liver cirrhosis()

表1 190 例肝硬化失代償期患者一般資料()Tab.1 General data of 190 patients with decompensated liver cirrhosis()
2.2 肝硬化合并胸水患者胸水再發(fā)的單因素分析
肝硬化失代償期并大量胸水患者共190 例,胸水再發(fā)29 例(15%),未再發(fā)161 例(85%)。2組患者收集的常規(guī)資料進行比較,在住院天數(shù)、谷氨酰轉肽酶、堿性磷酸酶、胸水蛋白、前白蛋白、血小板、凝血酶原時間、異常凝血酶原、血肌酐、胰島素、C 肽、門靜脈內徑、門靜脈流速置管時間比較有顯著差異(P<0.05)(表2)。而年齡、總膽紅素、門冬氨酸氨基轉移酶、丙氨酸氨基轉移酶、總蛋白、白蛋白、血紅蛋白、白細胞、脾臟(長度、厚度、內徑)等結果無顯著差異。
表2 190 例肝硬化失代償期胸水再發(fā)單因素分析()Tab.2 Single factor analysis of 190 cases of pleural effusion in decompensated stage of liver cirrhosis()
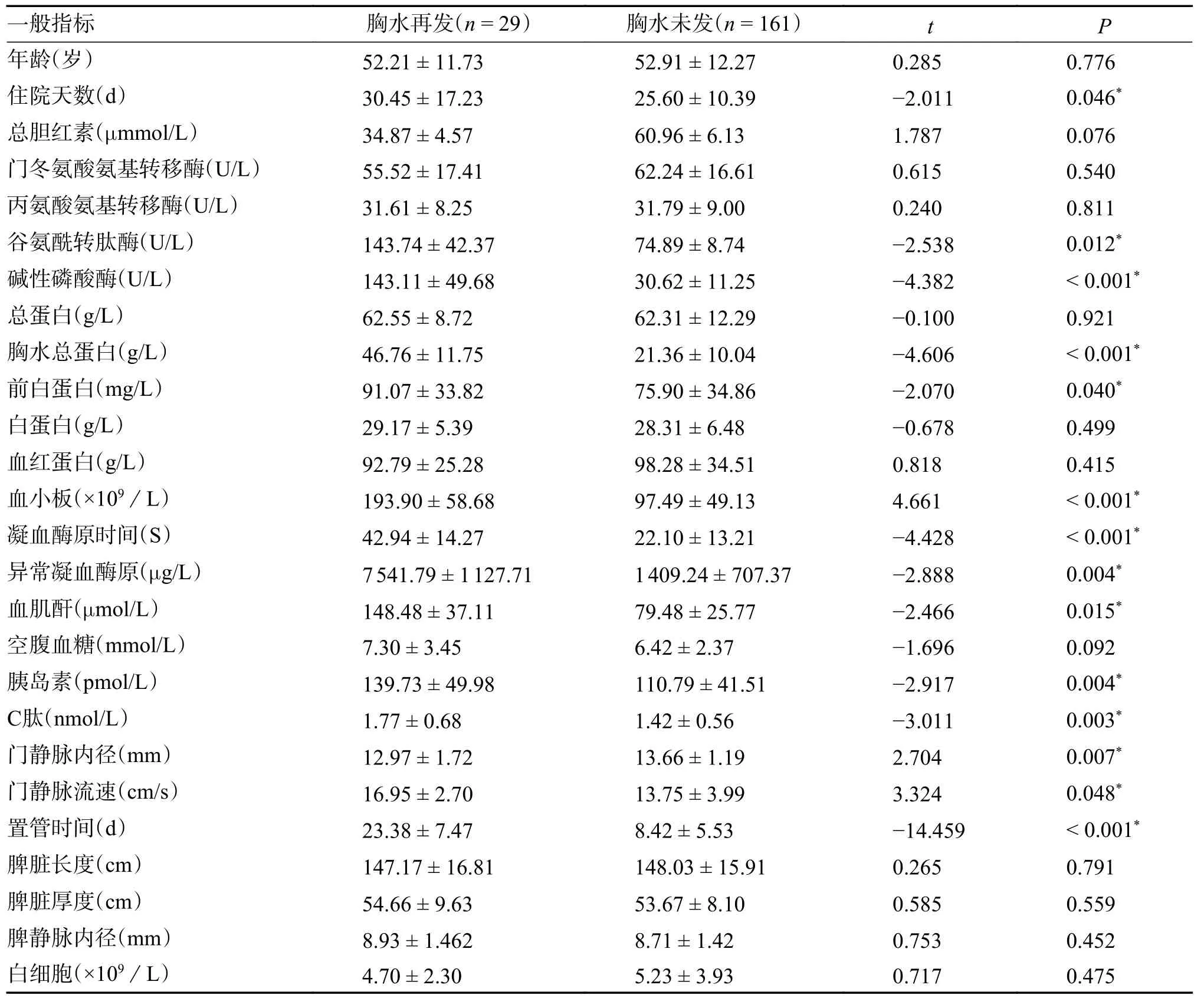
表2 190 例肝硬化失代償期胸水再發(fā)單因素分析()Tab.2 Single factor analysis of 190 cases of pleural effusion in decompensated stage of liver cirrhosis()
*P<0.05。
2.3 190 例肝硬化失代償期大量胸水患者胸水再發(fā)多因素分析
將2 組患者單因素分析差異有統(tǒng)計學意義的結果納入進行多因素分析,結果顯示血小板(0R=1.018)、血肌酐(0R=0.978)、門靜脈流速(0R=0.660)、引流置管時間(0R=1.801),差異有顯著性(P<O.05),是患者胸水再發(fā)的獨立危險因素,建立預測模型為P=ex/(1+ex),X=-0.873 +0.017×血小板+0.013×血肌酐+0.415×門靜脈流速+0.588×置管時間,見表3。

表3 肝硬化失代償期患者胸水再發(fā)Logistic 回歸多因素分析結果Tab.3 Results of logistic regression multivariate analysis of recurrent pleural effusion in patients with decompensated liver cirrhosis
2.4 ROC 曲線圖
使用ROC 曲線檢驗建立的預測模型與肝硬化患者實際胸水再發(fā)的擬合效果。肝硬化合并胸水患者胸水再發(fā)風險預測模型中各危險因素的ROC曲線下面積為:血小板:0.673、血肌酐:0.619、門靜脈流速:0.831、置管時間:0.969,模型的敏感性為89.7%,特異性為92.9%,正確率為91.8%。提示本研究預測模型預測效果良好,見圖1、表4。
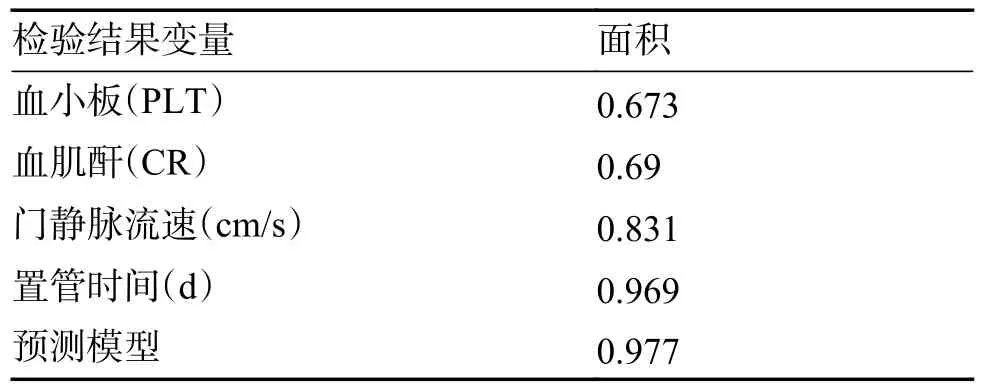
表4 曲線下面積Tab.4 Area under curve

圖1 肝硬化合并胸水患者胸水再發(fā)風險預測模型ROC 曲線Fig.1 ROC curve of pleural effusion recurrence risk prediction model in patients with liver cirrhosis complicated with pleural effusion
3 討論
3.1 胸水再發(fā)獨立危險因素的形成
有研究顯示,肝硬化失代償期患者胸水再發(fā)和肝硬化患者的肝臟受損程度、原發(fā)病所導致的門靜脈高壓、血漿膠體滲透壓下降、凝血功能障礙、內分泌紊亂、腎臟因素、門靜脈高壓相關[9],肝硬化失代償期時患者的肝臟功能受損嚴重、肝臟合成功能下降,血漿白蛋白水平明顯降低,易致體液漏出到腹腔和胸腔。同時肝硬化時,肝組織結構發(fā)生變化,門靜脈血流受阻,門靜脈壓力升高使胸膜淋巴液循環(huán)障礙,淋巴液會滲透進入胸腔。另外,腹水致腹內壓升高也可使腹水經橫膈膜間隙進入胸腔內。總之,肝硬化患者胸水形成的原因及機制非常的復雜,患者一旦出現(xiàn)胸水,會出現(xiàn)胸悶、氣短、呼吸困難等嚴重臨床癥狀。如不及時處置,后果嚴重。
本研究表明,血小板減少是肝硬化失代償期并大量胸水經治療消失后,胸水再發(fā)獨立危險因素。分析肝功能嚴重失代償、門靜脈壓力增高、脾功能亢進,破壞血液細胞是導致其減少的原因之一,表明血小板的減少與肝臟功能的損害的程度關系密切;其次,嚴重肝臟功能失代償時,骨髓造血功能亦會受到影響,致其血小板及其他血細胞減少;本研究通過觀察對比顯示:190 例肝硬化失代償期合并大量胸水患者中,胸水再發(fā)的29 例患者血小板更低,提示血小板減少胸水再發(fā)的風險越高,預后越差。
本研究中,血肌酐升高也是胸水再發(fā)獨立危險因素。MELD 評分是通過對總膽紅素、血肌酐、INR 以及肝臟原發(fā)疾病受損嚴重程度作為參數(shù)進行量化后計算得出來的,是一個評估終末期肝病患者的病情嚴重程度的指標[10]。本文結果顯示,其在未發(fā)組與再發(fā)組之間差異具有顯著性,后者血肌酐更高,說明肝功能嚴重受損,腎臟供血供氧能力弱,胸水再發(fā)的風險高。
本研究提示,門靜脈血流速度跟胸水再發(fā)密切相關。文獻報道,林殿杰等學者[11]使用胸腔鏡對23 例的肝性胸水患者進行檢查,其中,胸壁靜脈曲張顯露的12 例,奇靜脈曲張顯露的5 例,說明患者的門靜脈高壓在胸水形成的過程中起著非常重要的作用。本研究通過觀察對比顯示:胸水再發(fā)患者門靜脈血流速度更慢,這表示門靜脈壓越高,血流速度越緩慢的患者,胸水再發(fā)的風險越高。
胸腔引流置管時間是胸水再發(fā)獨立危險因素。文獻報道:應用胸腔置管引流的方法可以導致感染氣胸、電解質紊亂、腎功能損傷、出血、肝性腦病、復張性肺水腫、敗血癥、腹腔感染和肺部感染等[12]。患者術后放置胸管時間延長,胸水量增多[13]。這與本研究的結論一致。
3.2 胸水再發(fā)的預測模型的建立
肝硬化并大量胸水經治療消退后,胸水再發(fā)的預測模型的建立,本研究中確立血小板、血肌酐、門靜脈流速、引流置管時間是胸水再發(fā)的4個獨立影響因素。預測模型為P=ex/(1+ex),X=-0.873+0.017×血小板+0.013×血肌酐 +0.415×門靜脈流速+0.588×置管時間,ROC 曲線下面積:為0.773(95%CI:0.619~0.969).敏感性為89.7%,特異性為92.9%,正確率為91.8%,提示本研究預測模型預測效果良好。
3.3 建立肝硬化并胸水再發(fā)危險因素預測模型的重要意義
肝硬化失代償期合并胸水是肝硬化患者比較危險的一種并發(fā)癥[14]。近年來發(fā)病率趨勢增多,一旦發(fā)病,預后較差。如若胸水反復發(fā)作,則嚴重影響肝硬化患者的預后,生存質量較差,部分甚至死亡。因此有必要對這類患者進行風險進行早期識別和預測。醫(yī)護人員可以通過對該模型內指標進行采樣、收集、評估,提出針對性預見性醫(yī)療護理方案,來達到減少胸水再發(fā)的風險。
3.4 研究的局限性
本研究為單中心的研究,有待多中心進行驗證。期待有更多的研究團隊加入,以進一步完善該模型.為臨床早期識別肝硬化合并胸水患者胸水再發(fā)高危人群提供參考依據(jù)。
肝硬化并胸水再發(fā)的患者中血小板、血肌酐、門靜脈流速、引流置管時間風險是重要危險因素,本研究構建的肝硬化并胸水再發(fā)風險預測模型可以對這類患者起到一定早期預測的作用。從而減少胸水再發(fā)機率,改善肝硬化患者的預后,提高生存質量。

