基于列線圖分析的肝癌微血管侵犯的術前預測
史遠斌 張水軍
鄭州大學第一附屬醫院(河南省肝膽胰外科相關疾病診療工程研究中心,河南省器官移植免疫調節研發國際聯合實驗室)肝膽胰外科 鄭州 450052
肝細胞肝癌(hepatocellular carcinoma,HCC)簡稱肝癌,是全球發病率第六和病死率第三的惡性腫瘤[1]。盡管在HCC的預防和治療方面做出了巨大的努力,但HCC切除術后2 a的復發率仍為50%,5 a的復發率高達75%;即使行肝移植術,復發率也超過35%[2]。HCC微血管侵犯(microvascular invasion,MVI) 是影響HCC復發和肝切除術后患者生存的危險因素,可見于15%~57.1%的HCC術后標本中[3-4]。MVI是HCC侵襲性行為的病理學特征[5]。因此,術前預測發生MVI的危險因素對選擇HCC的治療方式具有重要意義[6]。近年來,多項研究報道了預測HCC發生MVI的各種MRI影像征象,包括腫瘤邊緣不光滑、腫瘤體積較大[7]、動脈期瘤周強化[8]、肝膽期瘤周低信號[9]等。當HCC病灶>5 cm時,MVI檢出率明顯增加[10]。本研究的目的是在本中心的臨床數據中,利用MRI征象及檢驗指標建立一個預測MVI(單個肝癌≤5cm)的模型。
1 資料與方法
1.1臨床資料采集查閱鄭州大學第一附屬醫院住院病歷系統中2019-09—2021-09行肝切除術的≤5 cm的新診斷單發HCC患者746例次,均經術后病理證實。納入標準:(1)經病理證實單個腫瘤且≤5 cm。(2)術前1個月內接受增強MRI掃描,成像清晰。排除門靜脈及肝靜脈癌栓。(3)病理報告及相關檢驗指標完整。(4)Child-Pugh分級為A或B級。(5)行根治切除術,術后病理學檢查切緣陰性。排除標準:(1)術前接受抗腫瘤治療(這些治療可能會影響MVI的發生)。(2)有其他腫瘤病史。經上述標準篩選后最終納入171例患者。本研究由鄭州大學第一附屬醫院倫理委員會批準。所有方法均按照相關指南和規定進行。
1.2方法
1.2.1 術前主要實驗室生化檢驗 包括乙型病毒性肝炎(HBV)及丙型病毒性肝炎(HCV)檢測、谷丙轉氨酶(ALT)、谷草轉氨酶(AST)、谷氨酰轉肽酶(GGT)、血小板計數(PLT)、中性粒細胞淋巴細胞比值(NLR)、凝血酶時間(TT)、凝血酶原時間(PT)、總膽紅素(TBil)、直接膽紅素(DBil)和甲胎蛋白(AFP)等。
1.2.2 MRI成像及圖像分析 使用Siemens 3.0T MR掃描儀,采用8通道體部線圈。平掃包括T2WI(呼吸觸發軸位脂肪抑制快速自旋回波序列)、T1WI(屏氣-VIBE序列)、DWI序列(軸位單次激發自旋回波-回波平面成像序列,b值取0、800 s/mm2)。動態增強掃描采用高壓注射器經肘靜脈快速注射釓噴替酸葡甲胺(Gd-DTPA)或釓塞酸二鈉(Gd-EOB-DTPA),用量0.2 mL/kg。使用屏氣-VIBE序列采集四期,含平掃、動脈期(約20 s)、門靜脈期(約60 s)、延遲期(約180 s)和肝膽期(20 min)。根據肝臟影像報告及數據系統(LI-RADS)2018版評估病灶的下列影像特征:(1)腫瘤大小。定義為在橫斷面T2加權圖像上的最大直徑。(2)腫瘤邊緣。在T2加權圖像上分為光滑邊緣和非光滑邊緣,不光滑病灶分為局灶結節外生長、匯合型多結節,以及不規則浸潤。(3)動脈期瘤周強化。定義為動脈期圖像上病灶周圍實質的一過性強化。病灶周圍實質的強化在門靜脈期減退,并在延遲期消失[11-12]。(4)動脈期邊緣強化。動脈期圖像上腫瘤邊緣出現的不規則或者楔形強化,在門脈期及平衡期呈等信號。(5)放射包膜。在門脈期或延遲期橫斷面圖像上,腫瘤周圍薄的、線性強化結構定義為放射包膜(分為3組:完整的放射包膜、不完整的放射包膜和無放射包膜)。(6)瘤內動脈。在動脈期病灶內延續的血管增強影。
1.2.3 手術及術后組織病理學檢查方法 采取開放或腹腔鏡肝切除術。術后對手術切除的標本由專職病理醫師進行評估。病理特征包括:(1) 根據Edmondson-Steiner四級分類法(Ⅰ~Ⅳ)進行組織學腫瘤分級。(2)腫瘤病灶大小、衛星結節、脈管侵犯等。MVI是指在腫瘤放射包膜或瘤周肝實質內由內皮細胞排列的血管內發現癌栓。
1.3統計學方法計數資料報告為整數,比較采用卡方檢驗或Fisher精確檢驗。計量資料報告為均數及標準差,比較采用獨立樣本t檢驗或Mann-Whitney U檢驗。將變量納入單因素Logistic回歸方程分析后,將有統計學意義的變量(P<0.05)納入到多因素Logistic回歸模型中,多因素Logistic回歸采用逐步回歸法,分析影像MVI 的獨立危險因素。P<0.05為差異有統計學意義。上述數據分析在SPSS v24.0 (SPSS, Chicago, Illinois)中完成。列線圖、ROC曲線及DCA曲線均使用R軟件3.5.3 (http://www.r-project.org/)繪制。
2 結果
2.1HCC患者MRI影像及血液檢測指標納入本研究171例患者的臨床病理特征和MRI征象見表1。其中有MVI 56例(32.75%),無MVI 115例(67.25%)。單因素分析顯示,有MVI及無MVI患者間的年齡(P=0.001)、AFP(P=0.006)、腫瘤病理直徑(P=0.001)、腫瘤邊緣(P<0.001)、放射包膜(P<0.001)、動脈期瘤周強化(P<0.001)和瘤內動脈(P<0.001)差異均有統計學意義(P<0.05)。
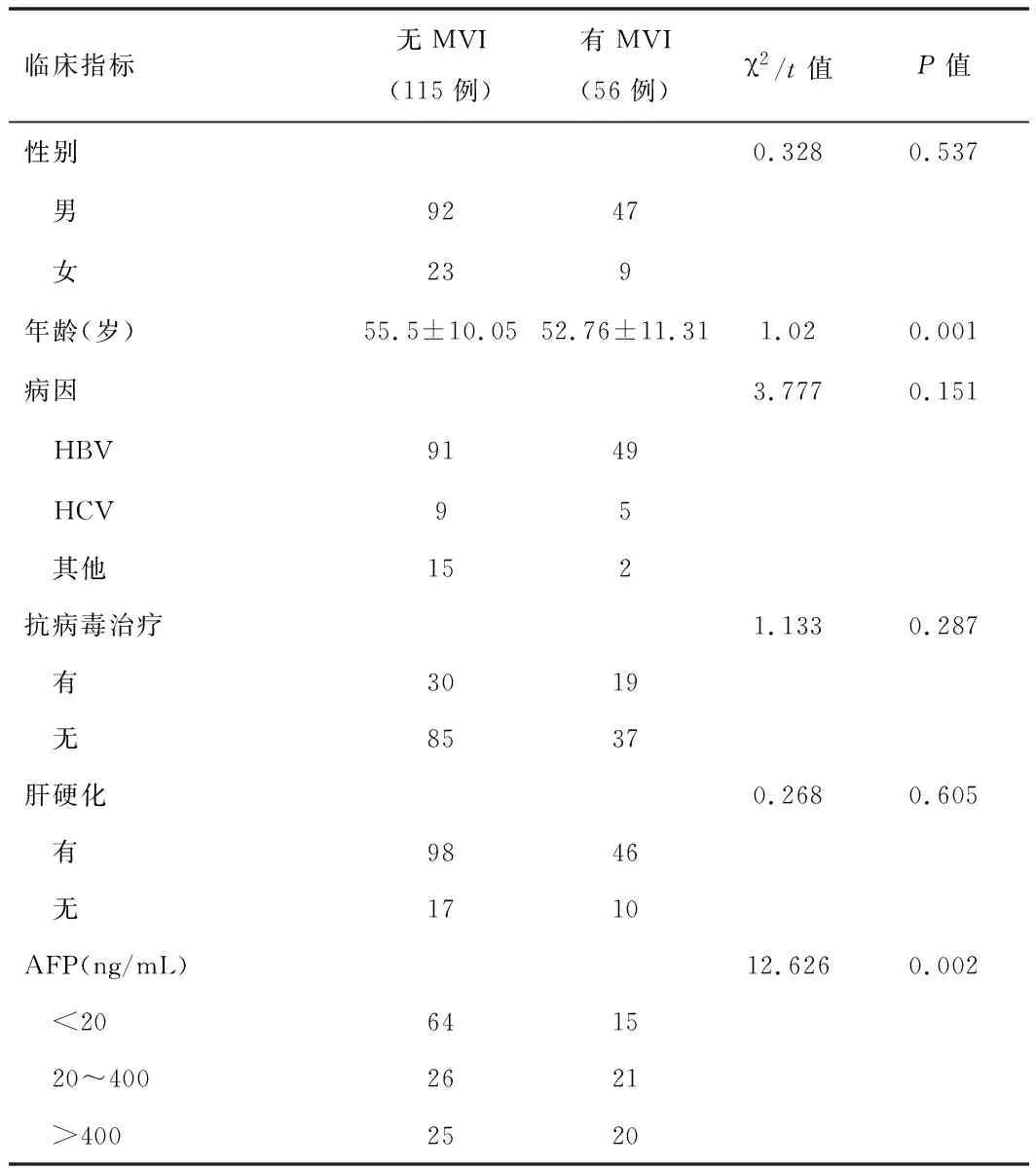
表1 171例肝癌患者臨床及影像資料
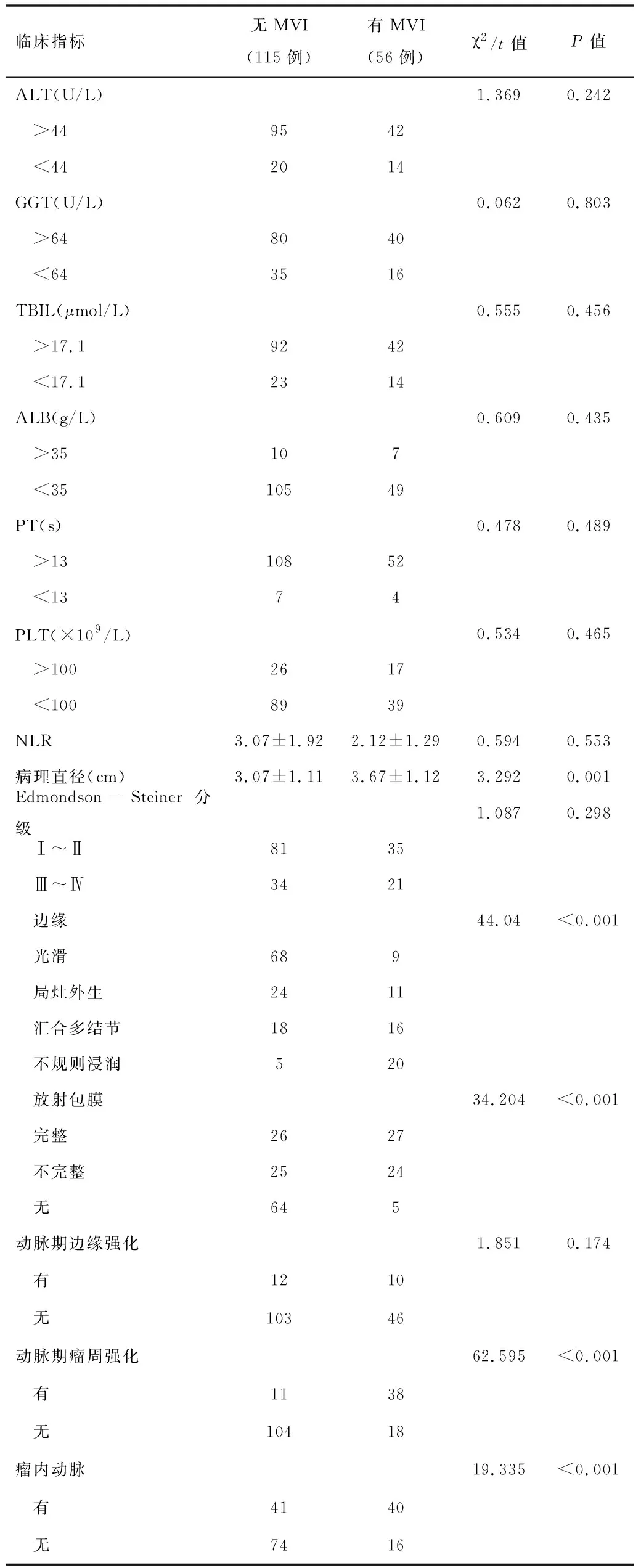
續表1
2.2單因素及多因素Logistic回歸分析影像MVI的危險因素將表1中的臨床指標分別納入到單因素及多因素Logistic回歸,結果顯示,AFP(P=0.006)、放射包膜(P=0.008)及動脈期瘤周強化(P<0.001)對預測MVI的發生具有統計學意義(P<0.05)。其中,AFP為20~400 ng/mL組和>400 ng/mL組MVI的發生率比<20 ng/mL組更高(分別為OR=5.6,P=0.007和OR=7.066,P=0.003)。放射包膜不完整組相對于放射包膜完整組具有更高的MVI發生概率(OR=7.681,P=0.003)。發生動脈期瘤周強化組比無瘤周強化組更可能發生MVI(OR=12.603,P<0.001)。見表2。

表2 影響MVI的單因素及多因素Logistic分析
2.3預測MVI方面的性能將表2中多因素Logistic回歸分析中有統計學意義的3個指標使用R語言繪制列線圖(圖1)及DCA曲線(圖3),用于術前預測MVI。該模型在預測MVI方面的性能較佳(圖2),曲線下面積為0.872(0.814~0.931)。
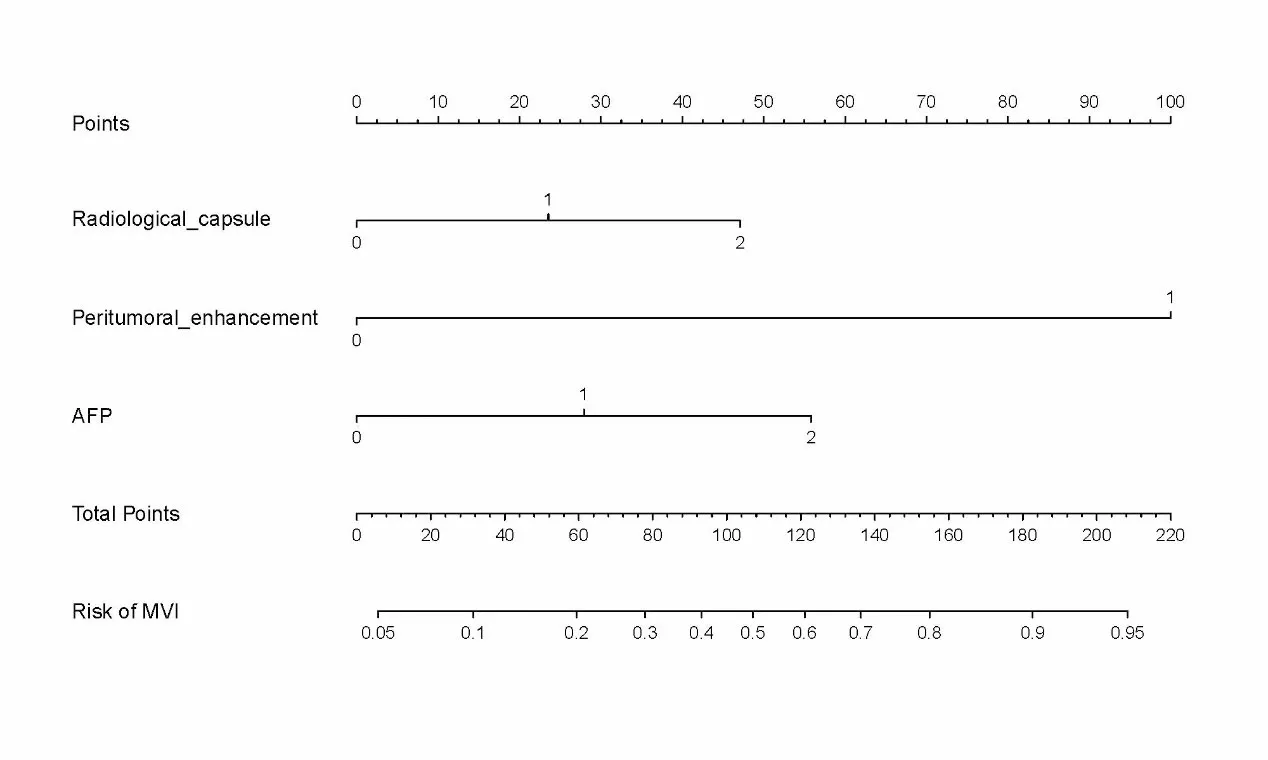
圖1 預測肝癌MVI列線圖
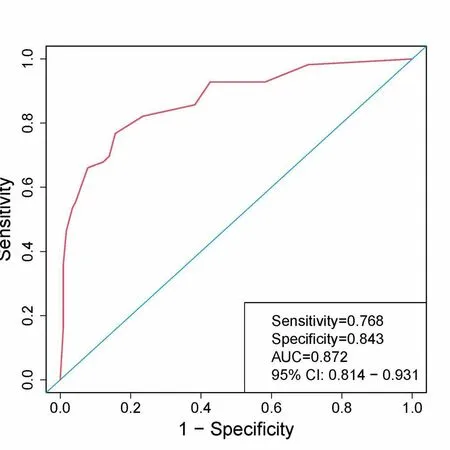
圖2 列線圖預測MVI的ROC曲線
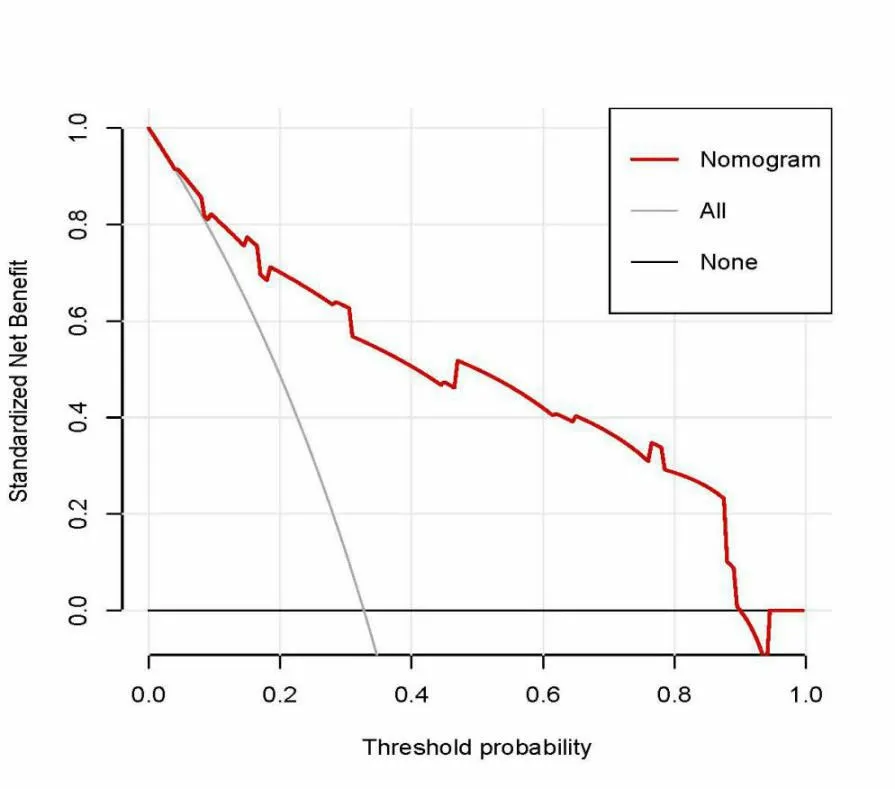
圖3 列線圖繪制的DCA曲線
3 討論
MVI是影響HCC復發的重要因素。術前預測早期(BCLC 0期或A期)HCC患者的MVI對制定個體化治療策略具有重要意義,并有助于對高危患者選擇更積極的治療方法,以降低術后復發率和延長無病生存期。本研究納入了單個HCC病灶且最大直徑≤5 cm的患者,結果表明,AFP> 20 ng/mL、動脈期瘤周強化和不完整放射包膜是HCC患者發生MVI的獨立危險因素。依此構建的列線圖預測效能較為穩健。
本研究單因素分析顯示,較大的腫瘤直徑與較高的MVI發生率顯著相關(OR=4.346,P=0.002)。然而在多因素分析中卻不是(OR=1.007,P=0.978)。其原因可能是各項研究中HCC大小的選擇偏倚,本研究只納入了早期患者。Lee等[7]報道AFP>15 ng/mL是MVI的危險因素(OR=3.46,P=0.001),本研究中AFP>20 ng/mL是MVI的危險因素。有報道表明血清高水平AFP與MVI的發生獨立相關。雖然目前尚不清楚這些腫瘤標志物水平升高導致HCC患者MVI風險增加的原因,但有報道稱高水平AFP及低分化腫瘤可能通過產生PIVKA-Ⅱ促進肝癌周圍血管生成,從而促進肝癌的血管侵襲[13]。
Cho E S等[14]報道放射包膜可以作為防止HCC擴散和發展的邊界。另一項臨床分析表明,有放射包膜的腫瘤與無放射包膜腫瘤相比,其腫瘤衛星灶和靜脈侵襲的發生率較低[15]。本研究結論與之類似,放射包膜不完整及無放射包膜的病灶更傾向發生MVI(OR=7.681,P=0.003)。
Zhang R等[16]報道動脈期瘤周強化對預測MVI有較高的特異性,但敏感度較低。癌旁組織是腫瘤發生發展中優先侵入的部位,進一步發展為脈管微小癌栓甚至肝內外擴散轉移。動脈期瘤周強化可能是由于腫瘤周圍的微小腫瘤癌栓阻塞了門靜脈的微小分支而導致門靜脈血流減少,繼而造成了動脈過度補償灌注[12]。本研究中瘤周強化(OR=12.603,P<0.001)對MVI的預測作用最強。
綜上所述,動脈期瘤周強化、血清AFP高水平、不完整放射包膜是HCC患者MVI的獨立危險因素。依此建立簡便實用的列線圖,經DCA曲線檢驗術前預測效率較高。本研究是單中心回顧性研究,且樣本量有限,結論可能與其他中心存在偏差。MVI可分為M1和M2,本模型并不能區分MVI分級,對積極治療方法的指導還有待改進。目前放射組學是微血管侵襲評估和預測最前沿的方法[17],可以提高預測的效能,我們將在后續研究中應予應用。

