內鏡黏膜下剝離術在早期胃癌患者中的應用
黃文寶 陳俊杰 許秋泳 黃偉平 蒲蕙
胃癌為消化道常見惡性腫瘤,當前胃癌已逐漸呈年輕化發病趨勢。食欲不振、腹脹、上腹隱痛為其主要癥狀,且隨著疾病的發展腫瘤破裂出血后,患者可能出現便血或嘔血情況,嚴重影響生活質量,威脅生命[1-2]。及早發現及治療對提高患者生存質量具有重要意義[3]。胃癌根治術為當前重要治療手段,而部分患者術后生活質量改善情況不佳,且術后并發癥及復發率均偏高,其創傷面積大也會在一定程度上增加術后病死率及并發癥發生率[4]。因此尋找科學、有效的治療方式是臨床研究重點。隨著內鏡技術的發展,內鏡黏膜下剝離術(endoscopic submucosal dissection,ESD)已逐漸廣泛應用在臨床上,可通過內鏡對腫瘤進行局部切除,術后恢復快、疼痛較輕、并發癥少[5]。當前已有研究提出ESD在早期胃癌中療效較佳[6]。但較少研究分析該術式對患者術后胃蛋白酶水平及復發率等的影響,故本文研究如下。
1 資料與方法
1.1 一般資料
選取2019年4月-2021年1月福建醫科大學附屬漳州市醫院進行治療的92例早期胃癌患者。納入標準:(1)均診斷為早期胃癌[7];(2)超聲內鏡或胃鏡顯示腫瘤組織未累及肌層;(3)符合手術指征。排除標準:(1)合并其他腫瘤;(2)潰瘍型未分化癌;(3)臨床資料不完整。根據信封法將其分為試驗組(n=46)和對照組(n=46)。其中試驗組男24例,女22例;年齡35~76歲,平均(55.47±5.21)歲;腫瘤直徑0.8~2.3 cm,平均(1.54±0.21)cm;腫瘤部位:21例胃竇,10例賁門胃底,15例胃角;病理分型:7例低分化,14例中分化,25例高分化;浸潤深度:黏膜下、黏膜內分別5、41例。對照組男25例,女21例;年齡35~75歲,平均(55.49±5.36)歲;腫瘤直徑0.8~2.3 cm,平均(1.55±0.22)cm;腫瘤部位:22例胃竇,11例賁門胃底,13例胃角;病理分型:8例低分化,15例中分化,23例高分化;浸潤深度:黏膜下、黏膜內分別6、40例。兩組一般資料比較差異無統計學意義(P>0.05),有可比性。本研究經倫理委員會批準,患者均知情并同意參與本研究。
1.2 方法
兩組完成相關入院檢查后給予全身麻醉。對照組給予胃癌根治術治療。穿刺,隨后建立氣腹壓力,采用四孔法將操作器材及腹腔鏡放置入其中,并觀察病灶情況(于腹腔鏡下),依據患者腫瘤實際情況選擇合適術式,采用近端切除、全胃切除治療胃中上部腫瘤,采用遠端切除胃下部腫瘤,且需在腫瘤充分暴露后進行手術切除,阻斷胃部周圍血液循環,切斷、結扎胃網膜血管,并對周圍淋巴進行清掃,在切除腫瘤后給予止血、沖洗、縫合,并在術后放置引流管。試驗組給予ESD治療。麻醉生效后于內鏡輔助下在病灶表面噴灑靛胭脂(0.1%~0.4%)染色,對病灶范圍進行分析,在病灶邊緣0.5~1.0 cm處做電凝標記,并應用靛胭脂+腎上腺素+氯化鈉混合液進行多點注射,并使用針形切開刀切開病變邊緣,應用IT刀環繞病灶切開,剝離黏膜下層,至剝離病灶組織,同時對黏膜下進行多次注射,并在術中及時止血保證術野清晰,創面有小血管暴露,則需采用氬離子血漿凝固處理,若存在明顯裂孔或腔外脂肪,則需給予止血鉗夾閉,測量病灶大小,固定并送病理檢查。
1.3 觀察指標及評價標準
(1)臨床療效:依據文獻[8]比較兩組術后1個月臨床療效,治愈為經手術切緣檢查顯示無腫瘤細胞存在,且胃蛋白酶指標恢復正常水平;有效為經手術切緣顯示殘留少量腫瘤細胞,且胃蛋白酶指標恢復正常水平;無效為經手術切緣顯示有病變部位黏膜層下有淋巴或血管浸潤,需要再次給予手術治療。總有效率=(顯效+有效)例數/總例數×100%。(2)圍手術期指標:記錄兩組整塊切除率、治愈性切除率、術中出血量、手術時間、住院時間、腸鳴音恢復時間。整塊切除:指滿足病變整塊切除,腫瘤直徑在2 cm以下,分化型癌,深度為pT1a,術后病理提示水平切緣及垂直切緣陰性,無淋巴及血管浸潤[9]。治愈性切除:病灶整塊切除,大小在2 cm及以下,水平切緣及垂直切緣均為陰性,無合并潰瘍,且無脈管浸潤的分化型黏膜內癌[7]。(3)相關因子:抽取兩組術前及術后血清,采用型號為BS-400全自動生化分析儀(深圳邁瑞生物醫療電子股份有限公司),ELISA法檢測糖類抗原125(CA125)、糖類抗原 724(CA724)、表皮生長因子(EGF)及胃泌素-17(G-17)水平。(4)炎癥因子:應用ELISA法檢測兩組術前及術后炎癥因子水平,包括超敏C反應蛋白(hs-CRP)、白介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)。(5)胃蛋白酶指標:采用化學發光法檢測兩組術前及術后胃蛋白酶原指標,包括胃蛋白酶原比值(PGR)、胃蛋白酶原Ⅱ(PGⅡ)、胃蛋白酶原Ⅰ(PGⅠ)。(6)并發癥:記錄兩組術后1個月內并發癥(胃食管反流、腸粘連梗阻、幽門狹窄、胃出血、切口感染、賁門胃底部穿孔)發生率。(7)生存率:比較兩組術后1年生存率。
1.4 統計學處理
本研究數據采用SPSS 20.0統計學軟件進行分析和處理,無序分類資料以率(%)表示,采用χ2檢驗,計量資料以(±s)表示,采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 兩組臨床療效比較
兩組總有效率比較差異無統計學意義(P>0.05),見表1。

表1 兩組臨床療效比較[例(%)]
2.2 兩組圍手術期指標比較
試驗組術中出血量少于對照組,手術時間、住院時間、腸鳴音恢復時間均優于對照組(P<0.05),兩組整塊切除率及治愈性切除率比較差異均無統計學意義(P>0.05),見表2。
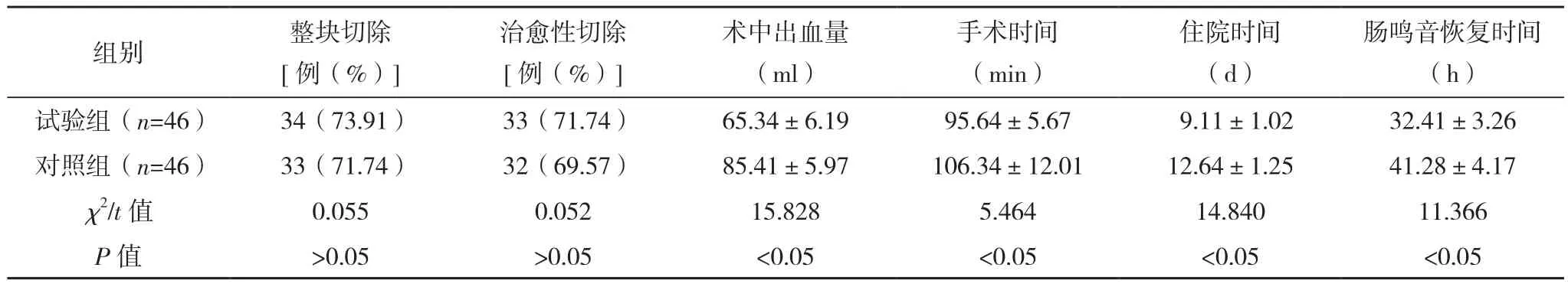
表2 兩組圍手術期指標比較
2.3 兩組相關因子比較
術前,兩組CA125、CA724、EGF、G-17水平比較差異均無統計學意義(P>0.05),術后,兩組CA125、CA724、EGF、G-17水平均顯著降低,且試驗組CA125、CA724、EGF、G-17水平均低于對照組(P<0.05),見表 3。
表3 兩組相關因子比較(±s)

表3 兩組相關因子比較(±s)
*與本組術前比較,P<0.05。
組別 CA125(U/ml)CA724(U/ml)EGF(μg/ml)G-17(pmol/L)術前 術后 術前 術后 術前 術后 術前 術后試驗組(n=46) 85.46±7.21 20.36±2.14* 31.26±2.17 10.33±1.05* 1.81±0.26 0.84±0.15* 21.55±2.03 14.26±1.05*對照組(n=46) 85.69±6.21 27.41±2.19* 31.29±2.33 16.59±1.21* 1.83±0.25 1.26±0.35* 21.56±2.33 17.64±1.21*t值 0.164 15.616 0.064 26.502 0.376 7.897 0.022 14.309 P值 0.870 0.000 0.949 0.000 0.708 0.000 0.983 0.000
2.4 兩組炎癥因子比較
術前,兩組hs-CRP、IL-6、TNF-α水平比較差異均無統計學意義(P>0.05),術后,兩組hs-CRP、IL-6、TNF-α水平均顯著降低,且試驗組hs-CRP、IL-6、TNF-α水平均明顯低于對照組(P<0.05),見表 4。
表4 兩組炎癥因子比較(±s)
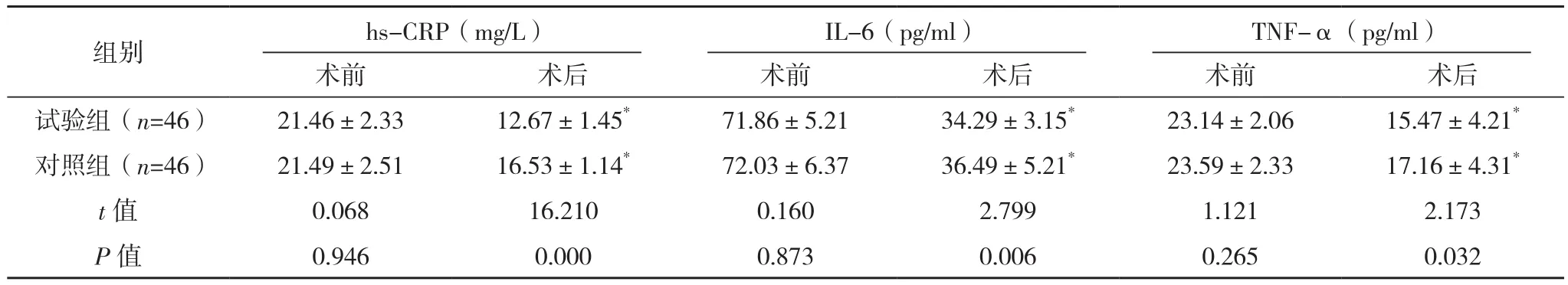
表4 兩組炎癥因子比較(±s)
*與本組術前比較,P<0.05。
組別 hs-CRP(mg/L)IL-6(pg/ml)TNF-α(pg/ml)術前 術后 術前 術后 術前 術后試驗組(n=46) 21.46±2.33 12.67±1.45* 71.86±5.21 34.29±3.15* 23.14±2.06 15.47±4.21*對照組(n=46) 21.49±2.51 16.53±1.14* 72.03±6.37 36.49±5.21* 23.59±2.33 17.16±4.31*t值 0.068 16.210 0.160 2.799 1.121 2.173 P值 0.946 0.000 0.873 0.006 0.265 0.032
2.5 兩組胃蛋白酶指標比較
術前,兩組PGR、PGⅠ、PGⅡ水平比較差異無統計學意義(P>0.05),術后,兩組PGR、PGⅠ水平均顯著升高,PGⅡ水平降低,且試驗組PGR、PGⅠ水平均高于對照組,PGⅡ水平低于對照組(P<0.05),見表 5。
表5 兩組胃蛋白酶指標比較(±s)
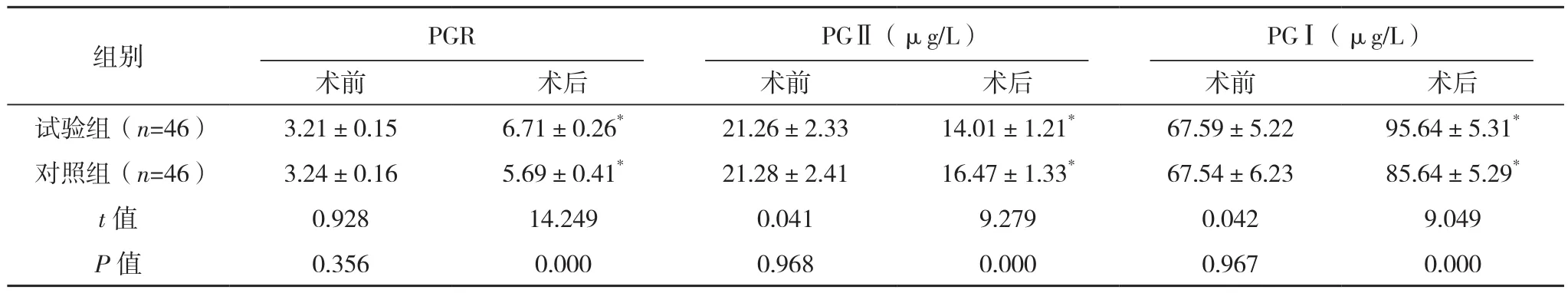
表5 兩組胃蛋白酶指標比較(±s)
*與本組術前比較,P<0.05。
組別 PGR PGⅡ(μg/L)PGⅠ(μg/L)術前 術后 術前 術后 術前 術后試驗組(n=46) 3.21±0.15 6.71±0.26* 21.26±2.33 14.01±1.21* 67.59±5.22 95.64±5.31*對照組(n=46) 3.24±0.16 5.69±0.41* 21.28±2.41 16.47±1.33* 67.54±6.23 85.64±5.29*t值 0.928 14.249 0.041 9.279 0.042 9.049 P值 0.356 0.000 0.968 0.000 0.967 0.000
2.6 兩組并發癥比較
試驗組術后1個月并發癥發生率顯著低于對照組(P<0.05),見表 6。
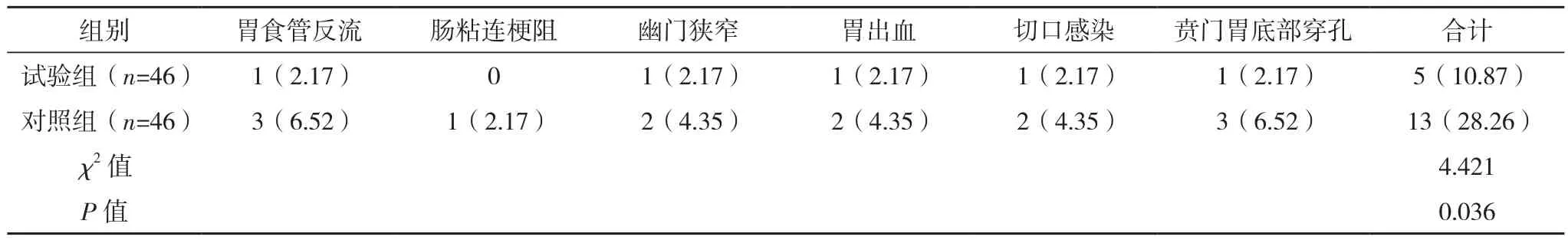
表6 兩組并發癥比較[例(%)]
2.7 兩組生存率比較
對患者進行隨訪,試驗組術后1年生存率為100%(46/46);對照組術后1年生存率為97.83%(45/46),兩組生存率比較差異無統計學意義(χ2=1.011,P>0.05)。
3 討論
隨著醫療技術的發展,近年來,胃癌檢出率明顯提升,而早期診斷、防止腫瘤擴散是改善胃癌患者預后的關鍵。保留胃功能手術較為保守,效果尚佳,但患者術后恢復時間較長,且部分患者還需要進行二次手術,限制其臨床應用;縮小胃切除范圍根治術,極易出現淋巴結轉移,影響術后恢復;早期胃癌根治術可保證最有效的切除,但需要進行淋巴結清掃,且術后創傷會影響患者恢復情況,因此尋找科學、有效手術方式是臨床亟待解決問題之一[10-12]。
ESD是一種在內鏡輔助下,一次性切除早期胃癌的術式。本研究發現兩組總有效率比較差異無統計學意義(P>0.05)。提示采用ESD及胃癌根治術治療早期胃癌效果相當。本研究中試驗組術中出血量少于對照組,手術時間、住院時間、腸鳴音恢復時間均優于對照組(P<0.05),兩組整塊切除率及治愈性切除率比較差異均無統計學意義(P>0.05)。提示采用ESD治療早期胃癌更能有效減少術中出血量,縮短手術時間及住院時間,分析可能是因為ESD為微創操作,創傷面積小,患者術后恢復期短。本研究發現術后,試驗組CA125、CA724、EGF、G-17水平均低于對照組(P<0.05)。提示采用ESD治療早期胃癌能有效促進相關因子水平恢復,分析可能是因為ESD可進行位點治療,完全切除病變,并避免腫瘤細胞在周圍區域播散種植,降低腫瘤相關因子水平[13-14]。本研究發現術后,試驗組hs-CRP、IL-6、TNF-α水平均明顯低于對照組(P<0.05)。提示采用ESD治療早期胃癌能有效減輕機體炎癥反應,分析可能是因為ESD對患者創傷較小,炎癥反應程度較輕,且在內鏡的輔助下,能避免損傷周圍組織器官,減輕應激反應[15]。有研究提出,在致癌因子作用下,早期胃癌患者胃底腺主細胞及黏液頸細胞PG基因受損,表現為PGⅠ減少,PGⅡ升高[16]。本研究發現術后,試驗組PGR、PGⅠ水平均高于對照組,PGⅡ水平低于對照組(P<0.05)。分析可能是因為ESD可最大限度保留胃部正常結構,能有效改善胃壁受損病理結構,并促進患者胃黏膜功能恢復,因此胃蛋白酶功能也隨之恢復較佳[17-18]。本研究發現試驗組術后1個月內并發癥發生率顯著低于對照組(P<0.05)。提示采用ESD治療早期胃癌可有效降低患者術后并發癥。分析可能是因為ESD治療,針對部分面積較大、不規則形態的深度早期胃癌,切除率良好,進一步減少術后復發,另外ESD為微創操作,能極大程度降低對患者胃部組織、器官的損傷,減少并發癥發生[19-21]。本研究中兩組術后1年生存率比較差異無統計學意義(P>0.05)。提示采用ESD治療不會影響短期內生存質量。
綜上所述,ESD與胃癌根治術治療早期胃癌均具有一定效果,但ESD治療可有效降低血清炎癥因子及相關因子水平,促進胃蛋白酶水平地恢復,降低并發癥發生率及復發率,可為臨床治療提供指導意義。

