磁共振SWI和QMS技術在中樞神經系統退行性疾病中的應用特點
馬怡群,溫 杰,張東銳
(1.滄州醫學高等專科學校 醫學技術系,河北 061000;2.河北省滄州中西醫結合醫院 影像中心,河北 061000)
中樞神經系統退行性疾病包括帕金森病、阿爾茨海默病、亨廷頓病等,其主要病理特點是異常的神經元細胞在神經系統或整個大腦的部分區域中迅速死亡,最終導致大腦功能的喪失,包括認知和運動能力[1]。鐵元素在神經核團的過量沉積被認為是引起神經細胞衰落和凋亡的因素之一,因此測量腦內的鐵沉積量有助于相關疾病的診斷。與PET和SPECT核醫學神經影像學技術相比,磁共振技術在腦鐵含量測量方面有無電離輻射、檢查成本低、性價比高等優點。鐵作為一種順磁性物質,過量的鐵沉積會引起腦組織局部磁場磁化率微觀變化,磁共振磁敏感加權成像(susceptibility-weighted images,SWI)和定量磁敏感成像(quantitative susceptibility maps,QSM)都可以利用組織間的磁化率差異來測量鐵含量,但是基于重建算法的不同,兩者在臨床應用中有著各自的優缺點。本文以帕金森病為例,討論SWI和QSM 這兩種技術在中樞神經系統退行性病變中的應用特點,通過物理原理分析其產生差異的原因。
1 材料與方法
1.1 研究對象
本實驗的研究對象為臨床確診的30例早期PD患者,年齡67.4±82歲,男女各占一半,要求家族史和帕金森病嚴重程度相當,正常對照組人數、年齡等要求與病例組相匹配。在檢查前,所有被試者均排除包括有進行性核上麻痹和其他神經退行性疾病、頭部損傷史、腦炎、暴露于神經抗精神病藥物的患者。
1.2 檢查方法
所有被試者均利用3.0 T磁共振設備進行常規MRI序列、QSM 序列及SWI序列掃描,把黑質、紅核、蒼白球、殼核、尾狀核、丘腦作為感興趣區。掃描結束后,由兩位經驗豐富的影像科醫師對以上6個感興趣腦區進行測量,獲得數據。其中,利用QSM技術成像時,對傳入工作站的原始影像進行圖像后處理,獲得磁敏感圖,測量其磁敏感值。利用SWI技術成像時,對原始圖像經過后處理,獲得SWI圖像,并在校正相位圖上測量其相位值。所有腦區都取最大層面作為感興趣區,連續測量三次,取其雙側的平均值。采用SPSS 19.0統計軟件進行數據處理。對PD組和對照組的磁敏感值、相位值以均數±標準差的形式表示,分別進行組間獨立樣本t檢驗,比較兩組同一感興趣區的磁敏感值和相位值差異,以P<0.05為差異有統計學意義。
2 結果
2.1 QSM 檢測比較各個腦區磁敏感值
在QSM 檢測中,發現PD組黑質、殼核的磁敏感值顯著高于對照組,差異有統計學意義(P<0.05),而兩組間其他腦區相比,磁敏感值均無顯著性差異(P>0.05)。見表1。
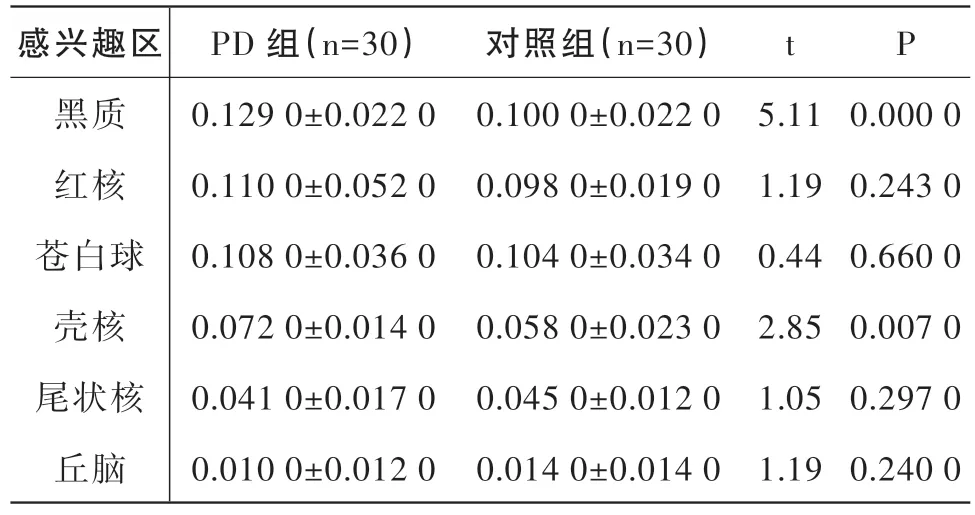
表1 PD組和健康對照組各個感興趣腦區磁敏感值比較
2.2 SWI檢測比較各個腦區相位值
在SWI檢測中,發現PD組黑質的相位值顯著高于對照組,差異有統計學意義(P<0.05),見表2。而兩組間其他腦區相比,相位值均無顯著性差異(P>0.05)。見表2。
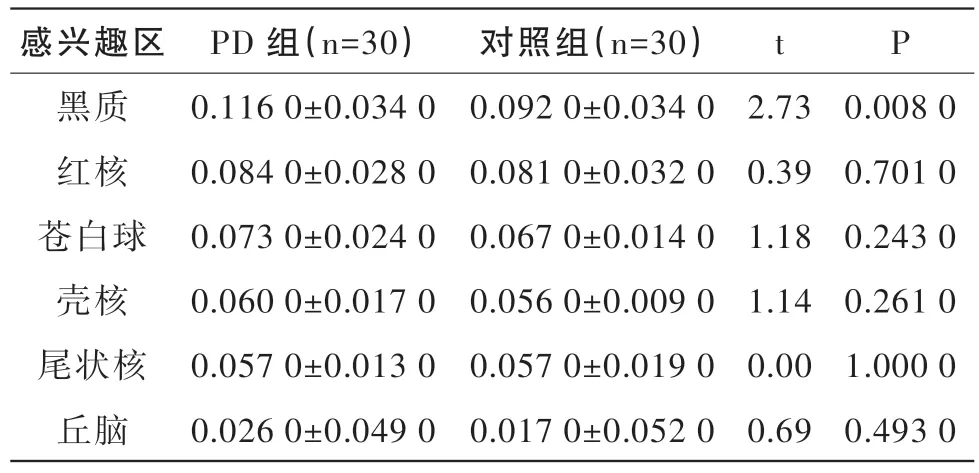
表2 PD組和健康對照組各個感興趣腦區相位值比較
3 討論
帕金森病(PD)是最常見的神經退行性疾病之一,臨床特點就是發病初期病理改變不太明顯,隨著腦部神經元的退行變性和丟失,多種癥狀才會逐漸顯現。鐵對大腦的生理生化過程是必不可少的,然而,由于它的異常積累,導致過氧化氫反應超載,由此產生的羥基自由基會引起氧化應激,進而導致神經元的凋亡,因此,它被認為是致病因素之一[2],在分布上,具有區域特異性和時間特異性[3]。許多研究表明,PD患者過量鐵沉積往往存在于一些特定的腦區,如黑質、殼核、紅核等部位。不同腦區的鐵沉積可以作為多種PD臨床亞型鑒別的指標之一[4]。有學者認為,不同腦區的鐵含量進展情況會隨疾病病程的發展而改變,如黑質和蒼白球中的鐵會隨病程的加重而增加,尤其是在疾病后期增加更為顯著。紅核和殼核的鐵含量在PD早期顯著增加,但在PD后期可能不會繼續增加[5]。Kathuria等(2020)[6]研究發現,黑質體-1的缺失雖然不能區分特發性帕金森病和非典型帕金森綜合征,但是可以作為對退行性帕金森綜合征診斷的潛在影像學標志物。Eichhof(2021)[7]比較SWI和QSM這兩種技術,證實在QSM 圖中的黑體-1可視化效果最佳。Ren等(2022)[8]利用SWI技術鑒別早期帕金森病和多系統萎縮-帕金森病亞型,發現后者的豆狀核后部狹窄,定量的形態學變化為臨床輔助診斷提供了參考,這可能有助于醫生在早期區分這兩種病癥。這些鐵沉積的特征和研究進一步證實了帕金森病是一種高度特異性的疾病。因此,及時和準確地檢測大腦不同區域的腦鐵沉積情況,有助于PD之類的神經退行性疾病的診斷。
本文檢測鐵沉積采用SWI和QSM 兩種方法,SWI利用相位圖間接反映不同腦區的鐵含量,而QSM通過磁化率圖能對同一腦區的鐵含量進行更加精確的測量。對兩組被試者分別采用這兩種技術檢查,發現QSM檢查中,黑質和殼核的磁敏感值與正常對照組相比,具有顯著差異;SWI檢查中,只有黑質的相位值與正常對照組相比,具有顯著差異,說明這兩個部位均出現了鐵的異常沉積,并且QSM 技術更加敏感。在現有的磁共振新技術中,SWI和QSM都是利用組織間的磁化率差異來成像,鐵作為一種順磁性物質,局部組織含量越高,引起的磁場偏移現象就越嚴重,原則上利用兩種技術推斷出過量鐵沉積的感興趣區應該一致,但是基于原理的不同,殼核用SWI檢測無明顯差別,而QSM卻能檢測出顯著差異。
從物理原理上分析這兩種技術在臨床使用中產生差異的原因,它們的序列基礎都是利用梯度回波技術得到相位信息圖,初步處理后,再進行解纏繞和去除背景場,SWI得到相位掩膜圖,QSM得到局部場圖。SWI是用處理好相位掩膜圖的n次方乘以原始的幅值相,得到磁化率加權圖像,而QSM是用處理好的局部場圖進行反演獲得真實的磁化率分布。把每個主要步驟拆開,按數據處理流程依次如下:①在對相位信息圖的初步處理上,SWI對相位圖作線性擬合,一般采用線性最小二乘法,但是噪聲點較多,在進行線性擬合時,偏離大,導致結果偏差較大,磁共振信號的噪聲分布復雜,采用這種方法進行場圖擬合,除躁效果欠佳;而QSM采用基于最小二乘法的非線性擬合,直接對相位信號進行處理,不需要提前在時間維上解纏繞,雖然計算復雜,但是除噪效果好,為后續處理提供更多的有用信號。②解決相位解纏繞的問題,SWI圖像相位處理主要采用零差濾波法,優點是算法簡單且運行時間短,容易實現,能在一定程度上濾除相位偽影,但是同時也濾掉了一部分有用信號,它沒有專門針對噪聲相位進行解纏繞,并不能完全解決相位纏繞的問題;QSM在解決相位纏繞問題上常用的是拉普拉斯法和區域生長法,兩者分別從空間維和時間維上更加徹底地解決了噪聲相位纏繞的問題。③背景場去除,SWI常用的是零差高通濾波法濾除總場圖中的低頻部分,但對具有高頻背景場的邊界部分濾波效果不理想。同時,局部場中低頻信息也被濾除,減少了有用信號,可能使最終的重建結果中含有磁化率偽影,降低圖像質量,影響有效信號的提取;QSM有偶極場投影法、復雜調和偽影去除法和拉普拉斯邊界值法等,其中前兩者都會在邊界處產生偽影,一定程度上影響診斷,而拉普拉斯法采用經典的偏微分方程拉普拉斯方程或者泊松方程,它用各種算法求解邊界值,最大限度地接近真實值,正是這種基于物理和數學的方法,使背景場的濾除效果更好。因此,QSM比SWI更能得到真實的有效信息。④經過前面幾步的處理,SWI得到相位掩模版,QSM得到局部場圖,SWI將原始的幅值圖與相位掩膜版的n次方相乘得到磁化率加權圖像,QSM通過對局部場圖進行磁化率反演獲得真實磁化率分布圖,常用的有傅里葉域法和空間域法。QSM所用的這些特殊的重建算法與SWI相比,計算更加復雜,但它最終的圖像會更加精確。因此,從理論上講,QSM技術克服了SWI技術的一些弊端,在反映鐵含量分布方面也更為準確和敏感[9]。
從臨床使用上看,SWI和QSM都屬于非侵入性的磁共振技術,都具有高空間分辨率、無創、多序列和高重復性的優點。已經有大量的文章報道SWI測量顱鐵含量的有效性,然而它的測量結果不夠準確,尤其是疾病發展早期,容易漏檢[10],本次研究也證明了這個問題。SWI的臨床應用較為廣泛,它還可以利用組織間的磁化率差異來增強圖像對比度,最終在MRI數據中產生不同的相移。例如,SWI采用最小強度投影技術獲得高分辨率的腦靜脈結構輪廓,這是它在所有MRI技術中獨有的特征[11]。多項研究證明,SWI已被熟練應用于各種微出血的診斷,其敏感性高于CT[12]。SWI使用氧氣作為對比劑,不僅能夠幫助區分舊出血和最新的出血,還可以識別活動性出血,避免使用造影劑,更利于人體檢測[13]。SWI對脫氧血液和顱內礦物質沉積較為敏感,被廣泛用于顱內出血、創傷性腦損傷、中風、腫瘤和一些神經變性疾病的診斷[14]。盡管如此,SWI對磁化率的測量并非直接的,而是間接的。隨著新技術QSM和磁化率張量成像的發展,這一問題已經得到解決。從目前來看,QSM技術已被證實是定量計算顱內鐵含量最準確的方法[15]。本次研究發現,QSM在疾病的早期階段檢測出黑質和殼核中鐵含量增加異常,提示QSM可能作為一種早期診斷工具,與以往的研究結果一致。QSM還可以評估大腦兩側黑質內鐵沉積的不對稱性[16],亦可用于檢測在病程發展中鐵含量的增加快慢,這與疾病進展息息相關[17]。腦深部電刺激術(deep brain stimulation,DBS)作為一種治療神經退行性疾病的新技術,最早用于治療帕金森病,現在也用于阿爾茨海默病。DBS手術是在患者大腦特定部位植入刺激電極,通常選在丘腦底核(subthalamus nucleus,STN)中。手術前需要精確定位橢球狀丘腦底核的大小和位置,最大限度保證手術的治療效果,避免電極放置不正確產生的副作用。與CT和超聲等其他影像方式相比,MRI可以說是STN成像的最佳成像工具,但STN在傳統的MRI序列上仍然不能很好地顯示出來。由于STN 具有較高的鐵含量,與T2加權(T2w),T2*加權(T2*w)和SWI相比,QSM 的顯示效果最好。使用7TMRI的QSM 可以更好地提高STN的可視化影像對比度,還可以有效地檢測STN中下端的鐵的增加量,在組織學上已經得到驗證。因此,QSM是目前最好的DBS手術成像技術,可以顯著降低與DBS電極放置不準確相關的無效治療率[18]。
兩者相比,QSM有以下優點:①QSM可以進行磁化率量化分析,在評價鐵含量上更加準確和敏感。②QSM對含鐵腦區的大小和形狀的描述更加準確,不會因磁場的形狀、回波時間、方向和強度的改變而產生顯著差異。與此相反,SWI中相位圖會受到含鐵組織的幾何形狀和靜態主磁場的定位方向等因素影響,導致它不能真實反映磁化率的空間分布。因此,通過測量相位值來反映相關腦區含鐵量的準確率較QSM低。③QSM可以區分各種分子磁化率,在檢測順磁鐵和抗磁鈣化上,準確率高于SWI,這在腫瘤分類中很有用,還可以測量創傷性腦損傷患者的微出血[19]。SWI會因為參數選擇的差異影響腦出血檢測的準確性,QSM的定量磁化率圖可以有效克服諸如回波時間等參數對成像信號的影響。④在臨床上,QSM可用于監測PD患者的鐵螯合劑去鐵治療,也可監測血腦屏障封堵后多發性硬化病變的陰燃性炎癥和血腦屏障封堵前多發性硬化病變的活動性炎癥[20]。
兩者相比,QSM的缺點:①多回波序列執行時間較長,整個腦掃描通常需要5-10 m in,是一種較慢的成像技術。在這段時間里保持病人的頭部穩定并不容易,特別是像患有帕金森這樣疾病的被檢者,不適合進行臨床檢查[21]。②由于QSM采集數據的方式是3D采集,與SWI成像相比,盡管它已借助于高性能計算機采用多種優化算法,但在進行計算重建時仍具有相當大的難度。同樣,在QSM 技術中,哪種TE值最適合評估對腦鐵最敏感的問題仍未完全解決。以上種種原因,使得QSM在臨床使用中不如SWI普及[22]。
定量磁化率圖譜提供了一種新的、定量的磁化率對比,因此可作為組織磁化率的體內表征。QSM有望為健康和病變組織中有關其成分的變化提供獨特的病因學診斷信息,該方法向獲得更具體的組織特性成像邁進重要一步。此外,該技術是神經成像設備的一個主要補充,鑒于其較高的特異性,在常規應用中具有重要意義。因此,QSM作為一種定量評估組織特性的MRI工具,其不可或缺的地位越來越突出[23]。
綜上所述,QSM作為近幾年興起的磁共振成像技術,已經在越來越多的定量檢測中顯示出了優勢,并在很多科研和臨床中取得了良好的效果。雖然目前一些缺點制約著其發展,但相信隨著科學技術的進步,QSM定會帶給醫療界不一樣的驚喜。

