首次療效評估中腫瘤最長徑之和變化對晚期肝內膽管癌化療患者生存預后的預測價值
董雨龍, 陶晨潔, 婁 成, 陳熙昀, 魏 煒, 韓 琴, 袁振剛
(海軍軍醫大學附屬東方肝膽外科醫院腫瘤科,上海 200438)
肝內膽管癌是一種復雜的上皮惡性腫瘤[1],肝內第二常見的惡性腫瘤,僅次于原發性肝癌[2-3],其發病率占原發性肝惡性腫瘤的10%-15%[4-5]。近些年肝內膽管癌的發病率逐年上升[6-7]。相比肝細胞癌,肝內膽管癌的惡性程度更高,預后更差[1,8]。根治性手術切除仍然是目前是肝內膽管癌唯一可能治愈的方法[9-10]。但早期肝內膽管癌往往缺乏明顯癥狀,大多數患者一經發現已進入晚期,失去了手術根治的機會。即使可手術的患者,術后的復發率也很高,達到50-60%[11],總體5年的生存率也只有25%-31%[12]。對于不可切除的局晚期或晚期肝內膽管癌患者,目前NCCN和CSCO等指南推薦一線治療方案是以含吉西他濱的化療方案為主[13-14]。晚期肝內膽管癌整體的治療過程持續時間長,時間跨度大。因此,臨床上在治療過程中迫切需要相關的指標準確判斷患者預后。
相關文獻報道晚期肝內膽管預后的指標,常見的如腫瘤標志物CA199等[15-16]。但CA199本身是一種分布于肝、膽道、胰腺、胃腸等多種器官組織細胞表面的糖脂質。同時也受黃疸、炎癥等多種因素的影響[17],對肝內膽管癌預后價值存在一定的偏差。而腫瘤最大徑之和(sum of the largest tumor diameters, SLD)的變化能客觀反映腫瘤浸潤范圍和生長速度的重要依據[18]。因此,實體瘤療效評價標準1.1被制定和應用于評估實體瘤的療效標準。根據標準,將療效分為4種,即完全緩解(complete response, CR)、部分緩解(partial response, PR)、病情穩定(stable response, SD)和病情進展(progressive response, PD)。首次療效評估在晚期肝內膽管癌一線治療過程中非常重要,不同的療效結果直接影響到患者后續的治療策略以及對治療的信心和依從性等。但目前關于晚期肝內膽管癌化療后療效與生存的預后相關性研究較少。本研究旨在探討晚期肝內膽管癌接受一線化療后首次療效結果對患者生存預后的價值,為肝內膽管癌的治療提供臨床依據。
1 資料與方法
1.1 一般資料
回顧性收集了2018年10月—2022年12月海軍軍醫大學附屬東方肝膽外科醫院107例晚期肝內膽管癌患者的數據。納入標準如下: (1) 結合病理組織學及影像學檢查明確診斷為晚期肝內膽管癌(基本上所有患者存在淋巴結或遠處器官轉移);(2) 接受不同的姑息性一線化療方案,主要以吉西他濱為主;(3) 基于增強CT或增強MRI等檢查,有可測量腫瘤大小;(4) ECOG評分≤2分;(5) 有完整與腫瘤相關性的OS,排除車禍等意外死亡。最終分析的排除標準如下: (1) 同時合并其他的惡性腫瘤;(2) 影像學上不可測量的病灶;(3) 一線化療前和化療過程中出現感染、黃疸、血栓形成、外傷、嚴重心、肝、腎等功能不全等;(4) 同時聯合放療、介入等局部治療;(5) 除外聯合免疫治療的患者;(6) ECOG評分≥3分。
1.2 腫瘤大小測量
(1) 基于胸部CT、腹部增強CT或MRI等影像學檢查,患者基線采用增強CT或MRI檢查,一線評估療效時對應的采用增強CT或增強MRI進行對比腫瘤大小;(2) 本研究納入的病例均有可測量的病灶,每個器官選取不超過2個靶病灶,最多不超過5個靶病灶(雙器官被認為是同一器官,如肺、腎、腎上腺),轉移性淋巴結大小至少15 mm以上為靶病灶;(3) 基于實體瘤療效評價標準1.1,本研究中將首次療效評估中對比前后腫瘤大小,將腫瘤SLD縮小至少超過30%為SLD(1)組;SLD增加至少超過20%納入SLD(3)組;介于兩者之間的為SLD(2)組。
1.3 化療方案
主要的治療方案如下。(1) GP方案: 吉西他濱1 000 mg/m2,第1、8天靜滴;順鉑40 mg/m2,第1、8天靜滴,21 d為1個周期。(2) Gemox方案: 吉西他濱1 000 mg/m2,第1、8天靜滴;奧沙利鉑130 mg/m2,第1天靜滴,21 d為1個周期。(3) GS方案: 吉西他濱1 000 mg/m2,第1、8天靜滴;替吉奧根據體表面積給藥,<1.25 m2,每次40 mg口服,2次/日;1.25-1.5 m2,每次50 mg口服,2次/日;>1.5 m2,每次60 mg口服,2次/日,連續服用14 d,停用7 d,21 d為1個周期。
1.4 觀察內容
年齡、性別、乙肝病毒感染、血管侵犯、腫瘤分化、丙氨酸轉氨酶(alanine transaminase, ALT)、天冬氨酸轉氨酶(aspartate aminotransferase, AST)、總膽紅素(total bilirubin, TBIL)、白蛋白(albumin, ALB)、SLD、CA199、D-二聚體(D-dimer)、總生存時間(overall survival, OS)等數據。平均在化療后2個月左右進行首次療效評估。主要基于增強CT或增強磁共振等影像檢查結果和Recist1.1版實體瘤療效評價標準。我們將化療前后療效分為3組即SLD(1)、SLD(2)和SLD(3)組。同時,為了進一步分析療效與生存預后的影響,依據化療前后SLD(2)的變化,將SLD(2)組分為2部分,其中SLD(2+)表示對比基線SLD從0增加至20%;SLD(2-)表示SLD從0縮小至30%。
1.5 統計學處理
采用SPSS 23.0進行統計分析,分類變量的頻率分布采用χ2檢驗或Fisher精確檢驗進行比較。使用Kaplan-Meier法繪制OS生存曲線,log-rank檢驗評估各組間曲線的顯著性差異。采用使用單因素和多因素分析Cox比例風險模型對OS進行分析,兩側P<0.05為差異有統計學意義。
2 結 果
2.1 患者的基本特征
回顧性納入107例晚期肝內膽管癌患者進入本研究。其中女性39例(36.4%),男性68例(73.6%)。年齡范圍為29-77歲,患者中位年齡為55歲。根據RECIST1.1版實體瘤評估標準,平均2個月左右評估SLD變化,其中PR患者18例,SD患者54例,PD患者35例,尚無CR患者。根據受試者工作特征(ROC)曲線分析CA199和D-二聚體,CA199和D-二聚體最佳截斷值分別為380 U/mL和1.29 mg/L,其他一般情況及臨床指標詳見表1。
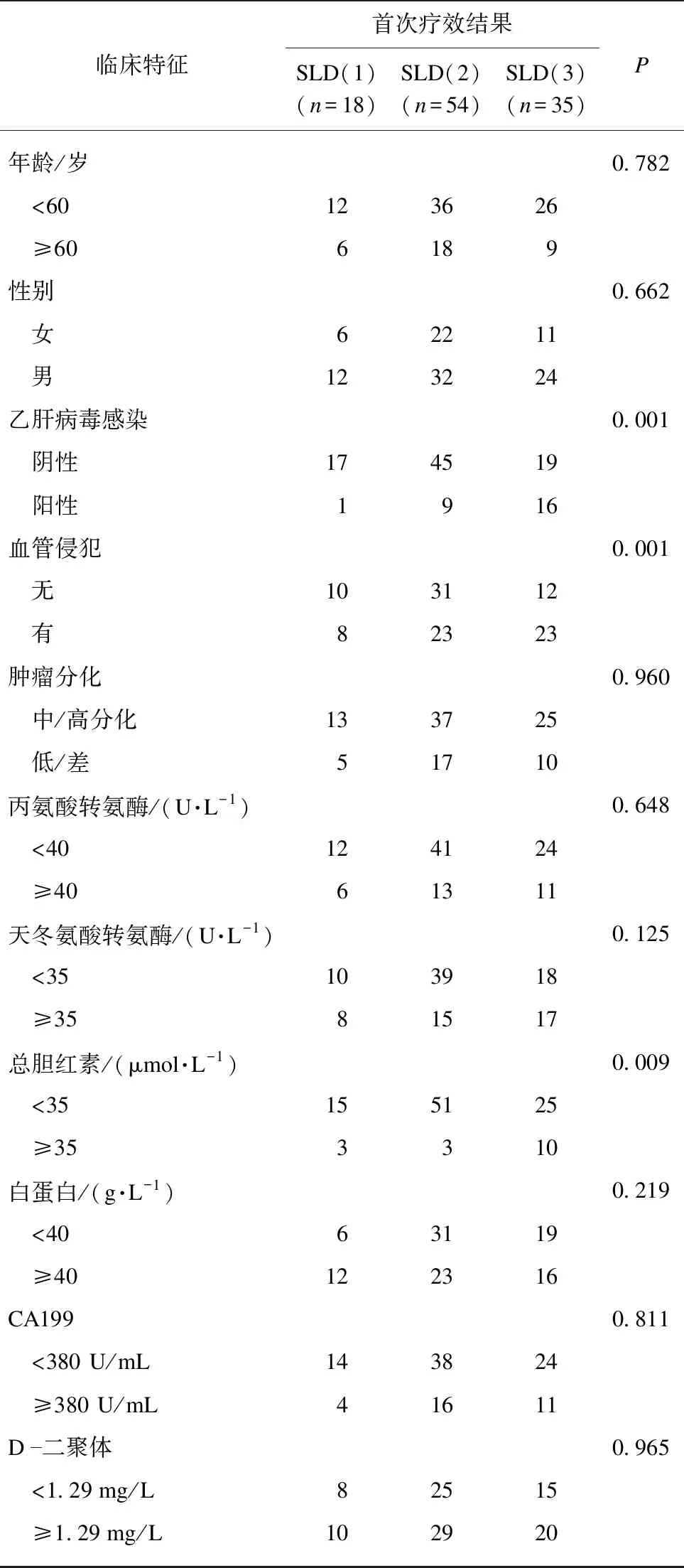
表1 不同化療療效組與臨床基本特征指標比較
2.2 不同療效組的患者與生存分析
SLD(1)組的中位OS為16.3個月,SLD(2)組的為13.2個月,SLD(3)組的為7.4個月,差異有統計學意義(P<0.001)。SLD(1)組中6、12、24個月的生存率分別為100%、72.2%和16.7%;SLD(2)中6、12、24個月的生存率分別為90.7%、53.7%和7.4%;SLD(3)組中6、12、24個月的生存率分別為57.1%、20%和0%(圖1)。為進一步分析療效與生存預后的關系,我們依據化療前后SLD的變化,將SLD(2)組分成2組。化療后SLD從0%減小至30%的這部分患者納入到SLD(2-)組,而將化療后SLD從0%增大至20%的這部分患者納入到SLD(2+)組。對于SLD縮小的這部分患者,SLD(2-)和SLD(1)組的中位OS分別為13.9個月和16.4個月,差異無統計學意義(P=0.053)。然而,對于SLD(2+)和SLD(3)組的中位OS分別為11.3個月和7.4個月,差異存在顯著統計學意義(P=0.012),見圖2。
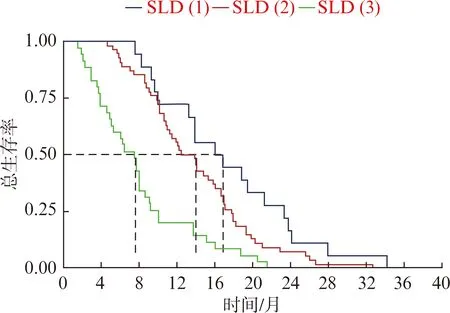
圖1 不同化療療效分組的生存曲線
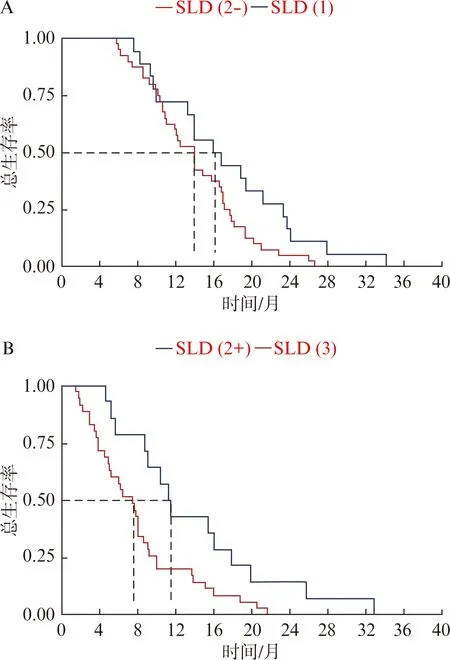
圖2 SLD(2)增大和縮小組化療療效分組的生存曲線
2.3 單因素和多因素Cox分析
對接受化療的患者的生存情況進行隨訪,最長時間36個月。Cox回歸模型顯示,單因素分析結果表明血管侵犯(HR=1.519,95%CI: 1.035-2.231,P=0.033)、丙氨酸轉氨酶(HR=1.696,95%CI: 1.086-2.649,P=0.020)、天冬氨酸轉氨酶(HR=1.763,95%CI: 1.160-2.678,P=0.008)、總膽紅素(HR=2.374,95%CI: 1.366-4.127,P=0.002)、CA199(HR=1.703,95%CI: 1.112-2.608,P=0.014)、D-二聚體(HR=1.826,95%CI: 1.225-2.723,P=0.003)、SLD(1)組(HR=0.488,95%CI: 0.287-0.828,P=0.008)、SLD(3)組(HR=2.924,95%CI: 1.914-4.465,P<0.001)與患者OS相關,見表2。多因素分析顯示CA199(HR=2.084,95%CI: 1.359-3.194,P=0.001)、D-二聚體(HR=1.822,95%CI: 1.140-2.911,P=0.012)、SLD(1)組(HR=0.564,95%CI: 0.321-0.991,P=0.046)、SLD(3)組(HR=3.012,95%CI: 1.873-4.842,P<0.001)是OS的獨立預后影響因素,見表3。
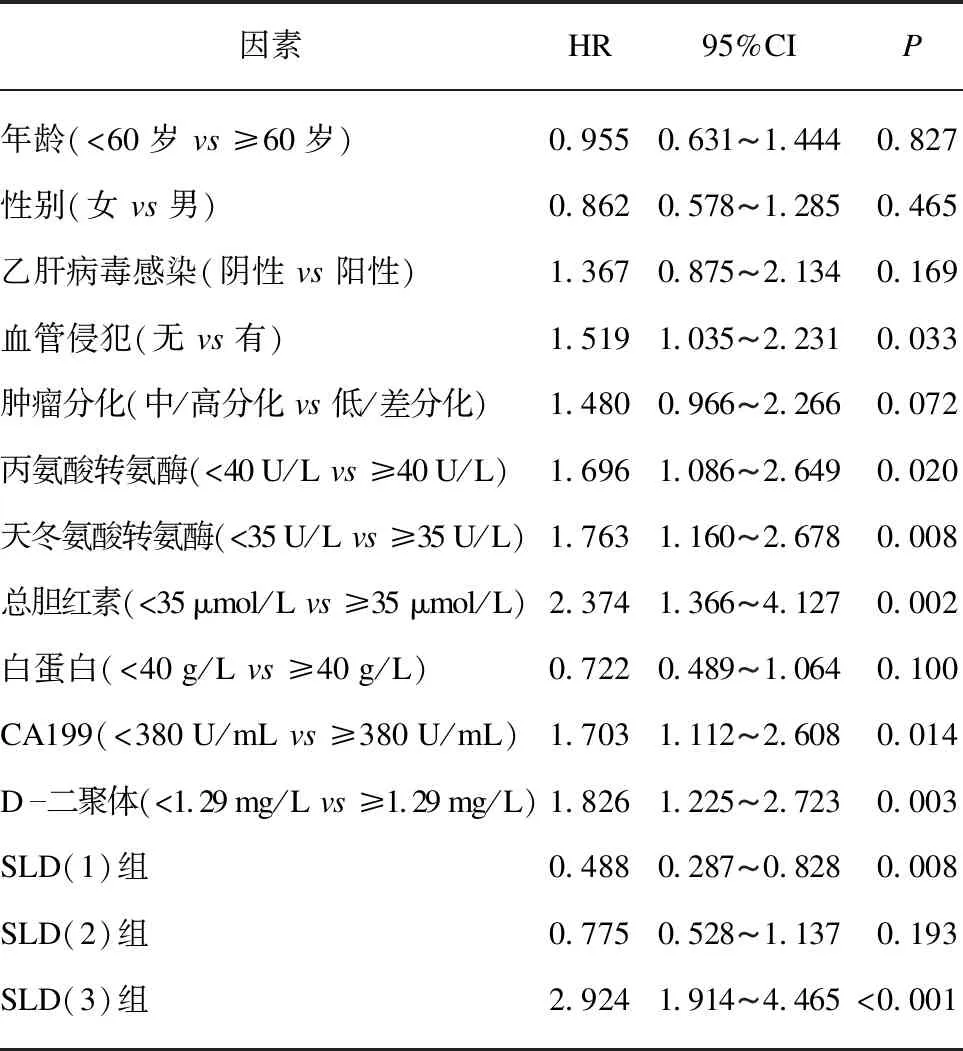
表2 單因素Cox分析臨床特征與化療后患者生存之間的關系
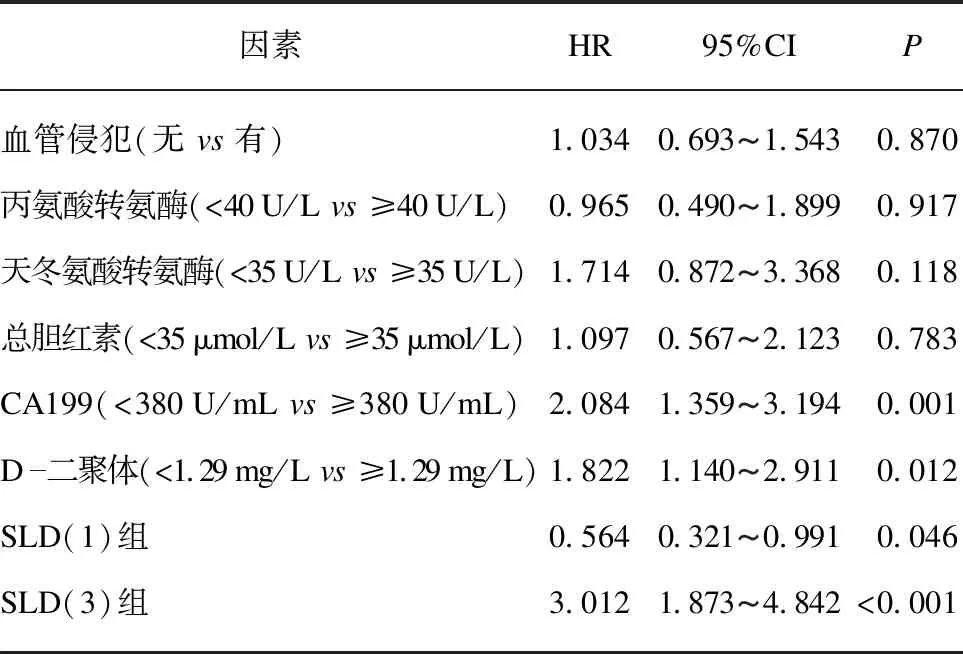
表3 多因素Cox分析臨床特征與化療后患者生存之間的關系
3 討 論
近些年來,腫瘤大小在多種惡性腫瘤中作為判斷患者的預后的重要因素之一。WHO及RECIST1.1等腫瘤評價標準將T分期納入其中,也體現了腫瘤大小對評估患者的病情及預后的重要性。腫瘤體積的大小表現在腫瘤細胞浸潤的范圍,在一定程度上體現了腫瘤的生物學性質,也是肝內膽管癌治療后療效評估的重要客觀依據[18]。治療前后SLD的增大或縮小直接影響到腫瘤侵犯的廣度和深度,從理論上說腫瘤體積越大,侵犯正常組織的范圍也越大,對患者的預后也越差[19-21]。反之預后則越好。相關研究表明在結直腸癌等惡性腫瘤中,腫瘤的長徑大小與組織學分期正相關,而與預后呈負相關[22-23]。這與本研究結果類似。但這些研究是以基線腫瘤大小來預測患者預后,缺乏動態觀察腫瘤大小的變化對患者預后的影響。然而,動態評估腫瘤大小對患者預后影響的這一類的文章非常少,尤其是膽道腫瘤中。因此,本研究進一步探究化療前后SLD的變化對晚期肝內膽管癌預后生存的影響。
在本研究中,共納入了107例晚期一線肝內膽管癌患者,接受了不同化療方案進行治療。通過首次化療后療效評估結果,發現SLD(1)組的晚期肝內膽管癌患者的中位生存時間明顯較前SLD(2)和SLD(3)組延長,同時也發現患者6、12、24個月的OS率也明顯優于SLD(2)組和SLD(3)組。在單因素和多因素Cox分析結果中,SLD(2)組和SLD(3)組差異都顯示出明顯的統計學意義,提示為獨立的預后因素。而SLD(2)組并沒有顯示明顯的差異。為進一步觀察化療前后SLD的變化與OS預后的影響,本研究將SLD(2)組分為SLD(2-)和SLD(2+)兩組。在SLD增大范圍內,SLD(2+)組和SLD(3)組的中位OS差異有統計學意義,提示腫瘤侵犯的范圍越大,患者的生存預后越差。而在SLD縮小的范圍內,SLD(2-)組和SLD(1)組沒有明顯地顯示腫瘤縮小的程度與患者的生存預后相關。對于SLD(3)組和SLD(2+)組患者存在明顯的差異,筆者推測可能由于腫瘤體積增大或數量增多,增加了梗阻性黃疸、肝功能不全、腸梗阻等并發癥的發生概率,一定程度上阻礙了后續的治療進程。同時病情惡化的程度也可能加重了患者的心理負擔,影響到后續治療的信心。而對SLD(2-)組和SLD(1)組這部分患者,筆者分析是可能是較好的治療效果使腫瘤侵犯的范圍縮小,減少或延緩了對重要組織器官的壓迫,降低了出現嚴重的并發癥的概率,對后續的治療影響較小,導致SLD(2-)組和SLD(1)組患者生存時間不是很明顯。總體來看,首次療效評估對肝內膽管癌患者意義重大,SLD(1)組的患者預后較好,SLD(3)組的患者預后明顯較差。而對SLD(2)組的這部分患者要區分對待,SLD增大組的患者整體生存預后比SLD縮小組的預后要差,但是明顯比SLD(3)組患者的預后明顯改善。
本研究也存在一些局限性。雖然存在明確納入和排除標準,但首先這是一個可能涉及混雜的因素的單中心回顧性研究。此外,因為嚴格的納排標準,盡量減少干擾因素,但同時也限制了總體的樣本量;另外,不同的化療藥物可能會影響到療效,引起結果的偏倚。但綜合不同的化療方案導致的首次療效變化更能體現出它對晚期膽管癌預后的意義。筆者觀測到首次療效評估中的SLD縮小>30%和SLD增加>20%是晚期肝內膽管癌患者預后的獨立因素。因此,對于晚期肝內膽管癌患者的治療,尤其是一線治療,要重視化療的方案的制定及首次化療后療效評估后的結果。對于SLD增加的患者,需要差別對待,應盡早調整后續的治療方案。可見,這一指標為晚期肝內膽管癌患者的治療和預后提供了一個新的方向,幫助臨床醫生預判病情發展趨勢,制定相應的治療方案及隨訪計劃。

