1型糖尿病患者的B細胞及B細胞亞群中程序性死亡受體配體1的表達
李思誠, 郭鶴鳴, 黃 韻, 劉翠平, 方 晨, 胡 吉
(1. 蘇州大學附屬第二醫院 內分泌科, 江蘇 蘇州, 215004;2. 蘇州大學附屬第一醫院江蘇省臨床免疫學研究所/江蘇省臨床免疫學重點實驗室, 江蘇 蘇州, 215006)
1型糖尿病(T1DM)的特征是胰島β細胞的自身免疫破壞,導致胰島素缺乏和終身外源性胰島素依賴[1]。研究[2]表明, B細胞在自身免疫性糖尿病中發揮著不可替代的作用。B細胞消耗性抗體利妥昔單抗可延遲近期發病患者的T1DM進展。程序性死亡受體配體1(PD-L1)被認為是調節性B細胞的重要特征,其可通過與程序性死亡受體-1(PD-1)的直接相互作用調節免疫應答[3]。研究[4]表明, PD-L1阻斷加速了非肥胖糖尿病(NOD)小鼠的糖尿病發病,提示PD-L1在T1DM中具有關鍵的保護作用。本課題組既往研究[5]發現,T1DM患者血清中的可溶性PD-L1水平降低。雖然B細胞的自身抗原遞呈被認為可以啟動自身免疫,但目前尚不清楚B細胞上的PD-L1是否參與了T1DM的發生。相關研究[6]表明,自身免疫性糖尿病患者循環中B細胞的頻率發生了改變。本研究深入探討這些B細胞,以期能更好地了解T1DM患者循環B細胞中PD-L1的表達。
1 資料與方法
1.1 樣本收集
本研究收集了2023年在蘇州大學附屬第二醫院內分泌科就診的患者血樣。T1DM的診斷標準參照參考文獻[7]。患者來自T1DM的各個階段(T1DM組,n=25)。選取年齡、性別與T1DM患者相匹配的健康人群(健康對照組,n=25)。此外,健康人群自述健康,并經口服葡萄糖耐量試驗(OGTT)證實無糖尿病,所有糖尿病自身抗體陰性,同時除外炎癥、傳染病、癌癥或任何其他自身免疫性疾病。參與者知情并同意本研究。本研究已獲得蘇州大學附屬第二醫院倫理審查委員會批準。
1.2 臨床指標收集
記錄受試者的年齡、性別和病程等信息。檢測肌酐(Cr)、尿素(BUN)、尿酸(UA)、白蛋白/肌酐(ACR)、丙氨酸轉氨酶(ALT)、天冬氨酸轉氨酶(AST)、甘油三酯(TG)、總膽固醇(TC)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、空腹血糖(FPG)、糖化血紅蛋白(HbA1c)、空腹c肽(FCP)。采用放射配體法檢測胰島自身抗體[谷氨酸脫羧酶自身抗體(GADA)、胰島素瘤相關抗原2自身抗體(IA-2A)、鋅轉運蛋白8自身抗體(ZnT8A) ]。
1.3 流式細胞術
通過靜脈穿刺收集受試者4 mL外周血樣本,采集的真空管中含有EDTA抗凝。在50 μL全血中加入異硫氰酸熒光素(FITC)、藻紅蛋白(PE)、降鈣素原(PCT)和藻藍蛋白(APC)標記的抗人單抗,并以相應熒光標記的IgG1或IgG2作為同型對照。具體標色方案為: ① CD19-PE,PD-L1-FITC; ② CD19-PE,CD27-APC,PD-L1-FITC; ③ CD19-PE, CD5-APC, CD1d-PCT,PD-L1-FITC; ④ CD19-PE,CD21-APC, CD23-PCT, PD-L1-FITC。在室溫避光孵育30 min后,用Beckman Coulter OptiLyse C裂解液進行紅細胞溶解和細胞固定。磷酸鹽緩沖液(PBS)洗滌2次后,取細胞懸液(500 μL/次),用COULTER Epics XL流式細胞儀(Beckman COULTER)檢測。
1.4 統計學分析

2 結 果
2.1 2組B細胞和B細胞亞群表達
采用流式細胞術檢測外周血CD19+細胞(B細胞)。T1DM組和健康對照組的B細胞頻數比較,差異無統計學意義(P=0.08)。流式細胞術在外周血樣本中識別出6個主要的CD19+B細胞亞群: 幼稚B細胞(CD19+CD27+)、記憶B細胞(CD19+CD27+)、B10 (CD19+CD5+CD1d+)、邊緣區B細胞(MZB)(CD19+CD23-CD21+)、濾泡B細胞(FoB)(CD19+CD23+CD21-)和過渡性T2-邊緣區前體B細胞 (T2-MZP)(CD19+CD23+CD21+) 。T1DM組和健康對照組的B細胞亞群頻率比較,差異無統計學意義(P>0.05)。在T1DM患者中,B細胞亞群的頻率無系統性差異。見圖1。
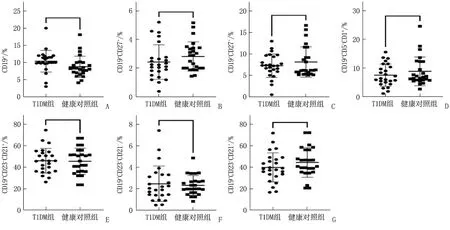
A: B細胞; B: 記憶B細胞; C: 幼稚B細胞; D: B10細胞; E: MZB細胞; F: FoB細胞; G: T2-MZP細胞。
2.2 B細胞亞群上PD-L1的表達
與健康對照組的(14.06±5.72)相比, T1DM組CD19+細胞上PD-L1的表達頻率為(6.51±3.92), 差異有統計學意義(P<0.05)。T1DM組患者CD19+CD27+細胞上PD-L1表達為(13.43±10.45), CD19+CD27-細胞上PD-L1表達為(11.17±7.69); 健康對照組CD19+CD27+細胞上PD-L1表達為(23.57±9.81), CD19+CD27-細胞上PD-L1表達為(15.59±6.14)。T1DM組CD19+CD27+細胞、CD19+CD27-細胞上PD-L1的表達頻率低于健康對照組,差異有統計學意義(P<0.05), 見圖2、圖3。2組PD-L1在B10[T1DM組為(18.15±8.48), 健康對照組為(23.44±17.75),P=0.19]、MZB[T1DM組為(19.71±12.89), 健康對照組為(21.22±8.04),P=0.62]和FoB[T1DM組為(41.50±24.15), 健康對照組為(41.77±23.08),P=0.97]細胞上的頻率比較,差異無統計學意義。T1DM組PD-L1在T2-MZP細胞中表達頻率(35.48±18.17)低于健康對照組(44.92±14.62), 差異有統計學意義(P=0.048 6), 見圖4、圖5。
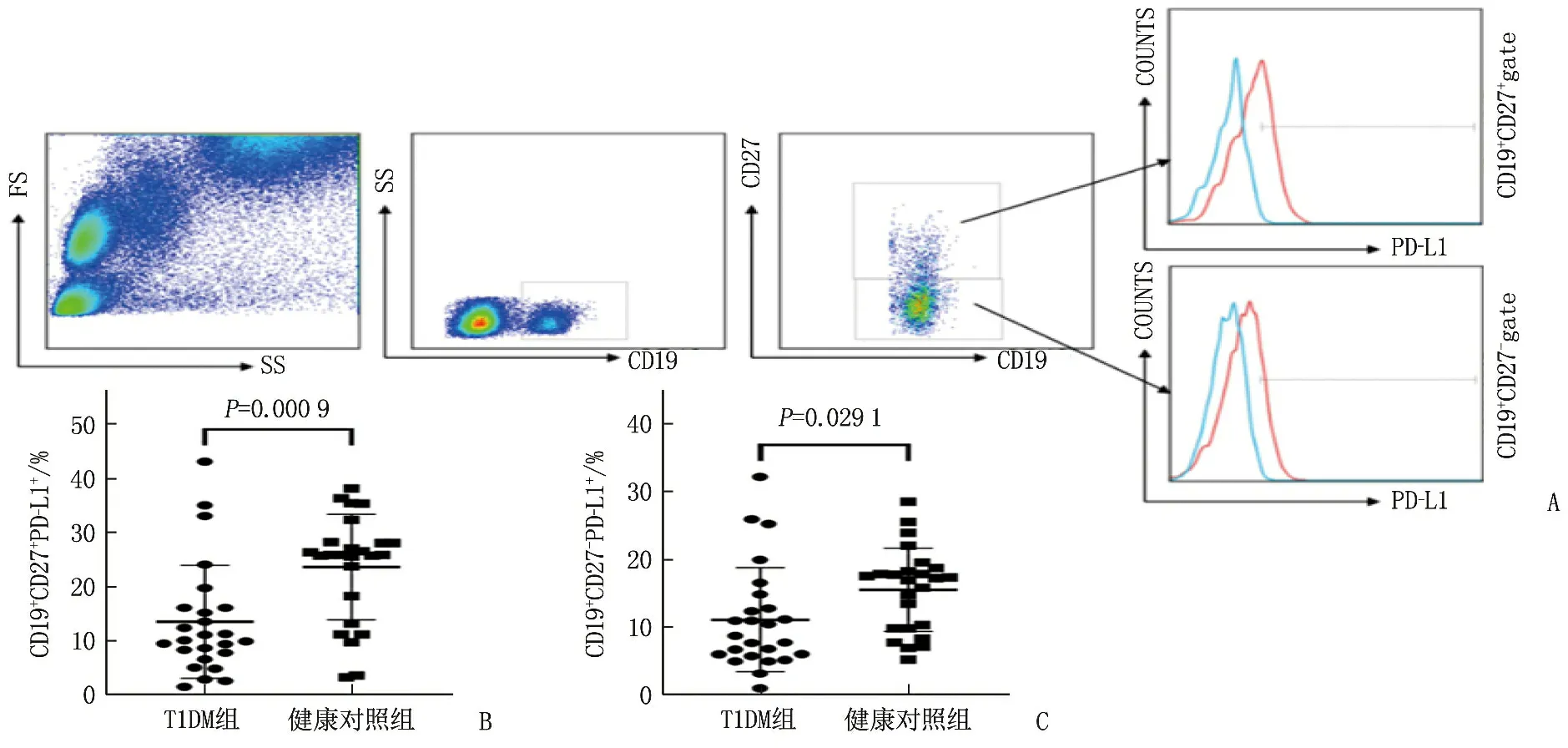
A: CD19+CD27+和CD19+CD27-細胞中PD-L1表達的門控策略; B: T1DM組與健康對照組CD19+ CD27+細胞上PD-L1的表達比較; C: T1DM組與健康對照組PD-L1在CD19+ CD27-細胞上的表達比較。
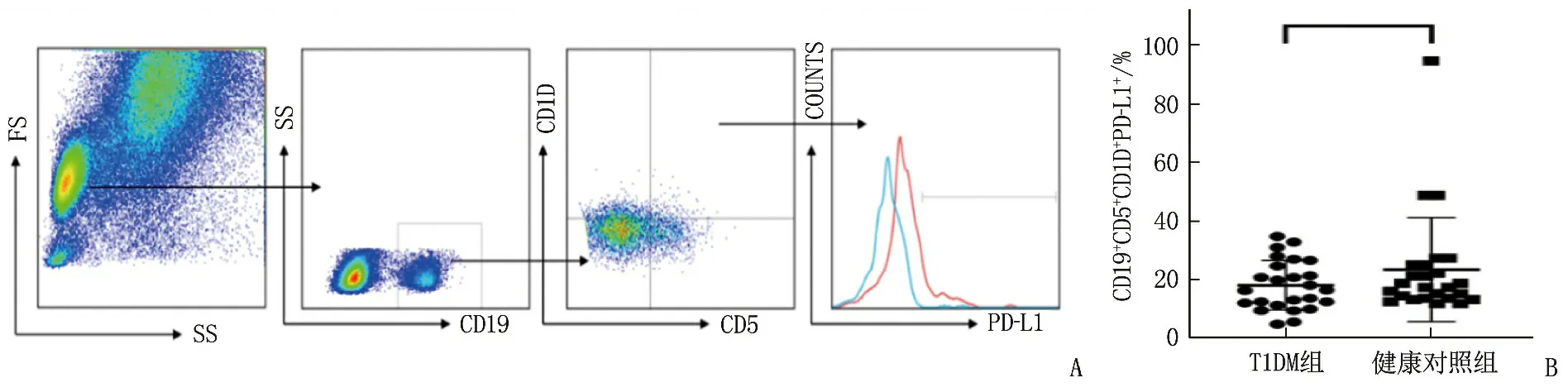
A: CD19+CD5+CD1D+細胞中PD-L1表達的門控策略; B: T1DM組與健康對照組 CD19+CD5+CD1D+細胞上PD-L1的表達比較。每個點代表個體PD-L1的比例。水平線表示平均值。
2.3 臨床特征與B細胞亞群PD-L1的相關性
T1DM患者的臨床特征見表1。MZB細胞表面PD-L1表達與BUN呈正相關(P<0.01); FoB細胞表面PD-L1表達與LDL水平呈負相關(P=0.016), 與HDL水平無相關性(P=0.268), 見表2。
表1 T1DM患者臨床特征

表2 B細胞亞群PD-L1水平與臨床特征之間的相關性
3 討 論
B細胞通過體液免疫直接發揮作用,并作為關鍵抗原提呈細胞在T細胞介導的自身免疫性糖尿病的啟動過程中發揮作用[8]。研究[9]發現, T1DM患者的胰島功能和血糖水平與B細胞亞群相關。自身免疫性糖尿病與抗PD-1/PD-L1抗體治療有關,研究[10-11]表明T1DM患者CD4+T細胞中PD-1的表達顯著降低,表明PD-1/PD-L1通路在T1DM中對破壞β細胞起關鍵作用。本研究旨在探討T1DM患者外周血中不同B細胞亞群上PD-L1的表達情況。本研究的主要發現為T1DM患者外周血B細胞,尤其是T2-MZP B細胞和記憶B細胞上PD-L1的表達水平降低。
B細胞在T1DM發生發展中的重要性已經在NOD小鼠中得到證實,缺乏B細胞的NOD小鼠不會發生T1DM[12]。同樣,通過抗CD20單克隆抗體選擇性消耗B細胞,可防止糖尿病的發生[2]。提示B細胞在T1DM的發生發展中有重要作用。B細胞亞群在免疫調節方面也發揮了重要作用,調節性B細胞通過白細胞介素-10 (IL-10)依賴的方式調節T細胞應答,在炎癥、感染和自身免疫性疾病中發揮調節功能[13]。MZB細胞和FoB細胞作為重要的抗原遞呈細胞,尤其是抗原特異性抗原遞呈細胞,能夠有效激活并促進CD4+T細胞增殖[14]。自身抗原通過Toll樣受體(TLR)激活B細胞,通過FasL誘導致病性T細胞凋亡,并通過分泌TGF-β抑制抗原遞呈細胞的功能來破壞免疫耐受。本研究發現, CD19+B細胞頻率在T1DM組和健康對照組中無顯著差異,這與既往研究結果相一致。本研究中, B細胞亞群頻率在T1DM組和健康對照組中無顯著差異。有研究[9]表明,與健康對照組和2型糖尿病(T2DM)患者相比, T1DM或LADA患者MZB細胞百分比增加,FoB細胞百分比降低。研究人群數量不足可能是導致這種差異的原因。
本研究還關注了B細胞上PD-L1的表達。PD-1/PD-L1在T細胞上的研究較多,在B細胞上的研究較少,但已知PD-1及其配體PD-L1可參與調節B細胞功能[15]。一項研究[16]表明, Treg上PD-1上調需要B細胞上PD-L1的表達,即B細胞通過PD-L1向Treg提供激活信號,從而抑制免疫應答。同時, B細胞可通過上調PD-L1的表達,抑制自身免疫病中的炎癥反應,高表達PD-L1的B細胞通過減弱T細胞的活化和抗體的產生[17]而顯著抑制體液反應。相反,缺乏PD-L1可能向T細胞提供抑制信號,導致免疫應答的激活。本研究發現, T1DM患者CD19+B細胞上PD-L1的表達低于健康對照組,提示PD-L1的表達減低,導致對免疫應答的抑制減弱,進而導致了T1DM的發生。除總B細胞(CD19+)外,本研究還評估了B細胞亞群上PD-L1的表達。研究發現,與健康對照組相比,初始B細胞上的PD-L1表達無差異,但記憶性B細胞上的PD-L1表達較低。已有研究[18]表明,記憶性B細胞比初始B細胞反應更快、更劇烈。首先,記憶性B細胞比初始B細胞被更早招募進入分裂,經歷更多的分裂輪數;其次,記憶B細胞具有更多細胞表面受體,如CD21、CD27和TACI, 這使得記憶B細胞能夠更快、更迅速地對共刺激信號做出反應[19-20]; 再次,記憶性B細胞表達高水平的CD80和CD86, 這有助于向輔助性T細胞尋求幫助。因此提出以下假設: 由于PD-L1的表達水平減低,使記憶B細胞在T1DM的發病機制中發揮了更強的作用。
研究[21]表明,產生IL-10的B細胞(Breg)在T1DM的啟動中發揮著不可或缺的作用。相關研究[22-23]在膠原誘導的關節炎小鼠模型中,發現分泌IL-10的B細胞表型為CD21+CD23+。Breg細胞可以通過增加PD-L1的表達來抑制自身免疫病中的炎癥反應[17]。因此, Breg細胞上PD-L1表達的降低可能促進自身免疫性糖尿病的炎癥反應。本研究納入的B細胞亞群中,只有T2-MZP上的PD-L1表達降低。這表明抑制T1DM中炎癥的Breg可能是T2-MZP。探究B細胞亞群PD-L1水平與臨床特征之間的相關性時,發現PD-L1在FoB細胞上的表達與LDL呈負相關,與既往研究[24]中血糖、血脂與免疫細胞相關的結果一致。
綜上所述, T1DM患者B細胞表面PD-L1的表達頻率較健康對照組低。PD-L1可能在T1DM的發病中起保護作用。PD-L1高表達的B細胞可能為自身免疫性糖尿病的治療提供新的有效策略。但本研究存在一定局限,本研究未檢測到IL-10和TGFb等炎性細胞因子,因此無法直接探討PD-L1對B細胞功能的影響,還需進一步深入研究。

