家庭護士食療理論解讀
程俊香 劉洽 朱瑞芳 馮耀清 張歡 趙奕雯 李曉樂 王倩 郭丹丹 韓世范
基金項目 2023—2024年度山西省大健康產業高質量發展科研專項課題,編號:DJKZXKT2023002,DJKZXKT2023157;2024年度山西省中醫藥科研課題,編號:2024ZYYA024
作者簡介 程俊香,副主任護師,博士研究生在讀
通訊作者 韓世范,E?mail:shifan.han@sxmu.edu.cn
引用信息 程俊香,劉洽,朱瑞芳,等.家庭護士食療理論解讀[J].護理研究,2024,38(12):2069?2075.
Interpretation of family nurses dietary therapy theory
CHENG Junxiang, LIU Qia, ZHU Ruifang, FENG Yaoqing, ZHANG Huan, ZHAO Yiwen, LI Xiaole, WANG Qian, GUO Dandan, HAN Shifan
Nursing College of Shanxi Medical University, Shanxi 030001 China
Corresponding Author? HAN Shifan, E?mail: shifan.han@sxmu.edu.cn
Keywords? family nurse; dietary therapy theory; non?nutrients; chronic diseases; inflammation; oxidative stress; metabolic disorders
摘要? 相關數據顯示慢性病已成為威脅人類健康的主要因素,食療在慢性病的治療和康復過程中顯示了積極的作用,現代醫學、營養學的不斷發展也賦予了食療新的生命力,使人們獲得更加健康的飲食的同時也為臨床非藥物慢性病干預管理提供了新思路。目前學者關注的是飲食模式或單個營養素如何作用于人體,缺乏科學系統理論的支持,而家庭護士食療理論可以構建具有地區特色的慢性病飲食干預方案,為慢性病食療干預提供理論依據。
關鍵詞? 家庭護士;食療理論;非營養素;慢性病;炎癥;氧化應激;代謝障礙
doi:10.12102/j.issn.1009-6493.2024.12.001
世界衛生組織發布的《2019年世界衛生統計報告》顯示,慢性非傳染性疾病(簡稱慢性病)已成為導致人類死亡的主要原因,癌癥、心血管疾病、糖尿病和慢性呼吸系統疾病導致的死亡總人數約為3 320萬人,比2000年增加了28%,心臟病占所有死因總數的16%,糖尿病死亡人數增加了70%,男性糖尿病死亡人數增加了80%[1]。隨著我國經濟的高速發展,人們的行為、生活方式、生態環境和疾病譜都發生了改變,2017年導致我國居民死亡的前5位疾病分別為腦血管疾病(死亡率為149.4/10萬,占總死亡20.2%)、缺血性心臟病(死亡率為123.9/10萬,占總死亡16.7%)、慢性阻塞性肺疾病(COPD,死亡率為68.4/10萬,占總死亡9.2%)、肺癌(死亡率為49.0/10萬,占總死亡6.6%)和阿爾茨海默病(死亡率為34.7/10萬,占總死亡4.7%)[2]。在危險因素歸因中,高血壓、高體質指數(BMI)以及高膽固醇的比重明顯上升[2],反映出我國居民普遍存在不健康的飲食模式,慢性病管理成為當前衛生保健的首要任務。臨床和實驗室研究表明,多數慢性病的發生與氧化應激、炎癥以及代謝異常密切相關,健康的膳食結構對于干預這些慢性病非常有效,為制定和實施慢性病的三級預防策略提供了指導。
1? 健康飲食模式
地中海飲食目前被認為是一種健康的飲食模式,2010年被評為人類非物質文化遺產。這種飲食模式的特點是大量攝入水果和蔬菜、全谷物、豆類、堅果、魚、白肉、橄欖油,適量食用發酵乳制品,低攝入量的紅肉,以及適量飲用葡萄酒。人們對地中海飲食模式的關注源于Keys等[3?4]于1958—1964年開展的“七國研究”,該研究經過5~15年的隨訪觀察,比較了美國、日本、芬蘭、荷蘭、前南斯拉夫、意大利和希臘不同群體的飲食習慣,發現地中海國家,特別是希臘,心血管疾病和一般疾病的死亡率較低,且預期壽命更長。流行病學調查的證據顯示,地中海飲食模式可以顯著降低多種疾病的發病率,包括癌癥、糖尿病、消化系統疾病、心血管疾病以及肥胖,同時也可以降低總體死亡風險[5?7],也可有效改善代謝綜合征[8]。
DASH飲食(dietary approaches to stop hypertension)是美國在1997年的一項高血壓防治計劃中發展出來的一種飲食策略。DASH的首次臨床試驗探究了3種不同飲食模式對血壓水平的影響,其中富含水果、蔬菜和低脂乳制品的“組合”模式,即“DASH”飲食,相比對照組蔬菜水果飲食而言,顯著降低了參與者的收縮壓(SBP)和舒張壓(DBP)[9]。隨后進行的多項臨床試驗表明,單獨采用DASH飲食或結合生活方式的調整,例如限制鈉鹽攝入、增加體育鍛煉以及控制體重,均被證實為有效降低血壓水平的飲食方案[10]。一項針對88 517名護士長達24年的跟蹤隨訪研究發現,采用DASH飲食與冠狀動脈疾病和腦卒中的發病風險顯著降低相關[11],表明飲食依從程度直接影響了飲食干預的有效性。對于高度依從于飲食方案的參與者來說,其飽和脂肪酸攝入減少,從而有助于降低心血管疾病的發病率。
近年來,我國以營養指南等科學研究成果為基礎,對傳統膳食模式進行了改良,形成了東方膳食模式、江南膳食模式、傳統中醫藥膳食模式等一系列健康膳食模式,這些模式在改善疾病和促進健康方面的效果已得到證實。研究發現,這些膳食模式與多種慢性病的發病率呈負相關,同時人群的預期壽命也相對較高[12?13]。在日本傳統的健康飲食模式中也有相似結果的報道[14]。目前,各國根據相關研究制定了各自的營養指南,這些指南主要側重于宏量營養素(如脂肪、蛋白質、維生素和礦物質等)的比例平衡。然而,無論是改良傳統飲食模式以構建健康膳食結構,還是直接制定國家營養指南,對于非營養素的關注程度都相對較低,其重要性并沒有得到充分關注。現代營養學將維持人體生命活動所必需的糖類、蛋白質、脂肪、維生素、礦物質和水六大營養素稱為必需營養素,必需營養素是維持人體健康不可或缺的一部分,但食物中的非必需營養素(也稱非營養素)同樣對人類健康至關重要。非營養素是指存在于植物類草藥、食物中,具有與營養素不一致的化學結構,溶于水或乙醇等媒介中,對人體產生綜合性、系統性、整體性、協調性調節健康的活性成分。植物性的生物活性成分種類繁多,如類黃酮、植物雌激素、酚酸類化合物、類胡蘿卜素、硫化物等。地中海飲食模式對健康指數的積極影響主要歸因于橄欖中所含的橄欖油及堅果中的油酸、角鯊烯、植物甾醇等活性物質,這些物質對人體免疫活性細胞具有抗氧化、抗炎以及對代謝的調節作用。此外,這些化合物還能夠相互協同作用,共同降低慢性病發展的風險[15?17]。盡管在單一化合物對慢性病干預方面的研究頗多,但大多數研究僅著眼于微觀層面,致力于探究某一疾病特定通路或靶點的作用機制,對于非營養素的研究卻缺乏宏觀系統的理論支持。預防性管理策略在全球范圍內具有普適性,系統性理論能夠為研究者和從業者提供指導,以展開相關研究并實施干預措施。
2? 食療理論及食療的發展
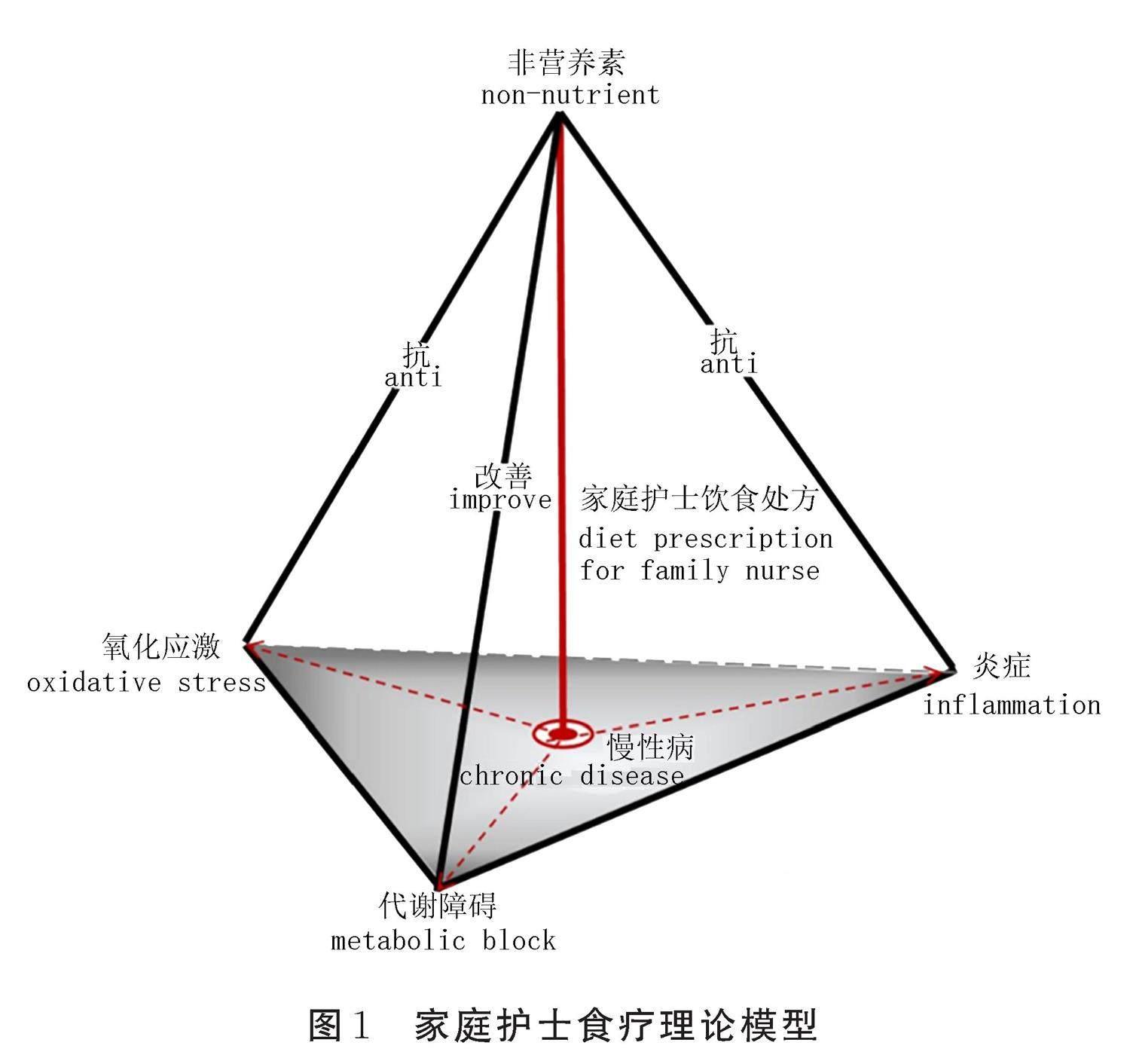
2023年,我國韓世范等[18]首次提出了家庭護士食療理論,該理論從慢性病的病理生理學角度闡述了非營養素慢性病干預的基本原理,填補了健康膳食模式和相關指南疾病治療原理不清的空白,并創新性地提出了家庭護士食療理論模型。該理論模型以非營養素的整體干預為頂,將導致慢性病的氧化應激、炎癥和代謝障礙三要素視作一個等邊三角形的正三棱錐結構(見圖1)。該模型貫穿整個慢性病管理過程,通過對氧化應激、炎癥和代謝障礙3個關鍵靶點進行干預,輔助治療慢性病。非營養素的食療應用與現代營養學的發展密切相關,這為家庭護士食療理論的提出打下了堅實的基礎。
2.1 國外食療的發展
古印度治療體系阿育吠陀中記載:“飲食不好,藥物無效;飲食合理,藥物無需”,闡述了食物、藥物和健康之間的密切關系,強調了食物在其中的關鍵作用[19]。西方的食療傳統可以追溯到古希臘時期,被譽為“醫學之父”的希波克拉底提出了“food is medicine”(食物即藥物)的概念,直接強調了食物在維護健康方面的重要性。這一理念將食物與藥物平等看待,對后期西方食療理論的發展影響深遠[20]。在古羅馬時代,塞爾蘇斯在他的著作《論醫學·養生總論》中闡述了眾多食物養生的理論,強調了按照季節合理搭配食物,并根據營養含量將食物分為高、中、低3類。著名醫師蓋倫繼承了希波克拉底的體液學說,在《論自然之力》中闡述了食物與體液的相互關系,并強調了食物烹制過程對營養的影響。歐洲中世紀,阿維森納繼承并發展了希波克拉底和蓋倫的醫學理論,其代表作《醫典》中詳細區分了食物的屬性,強調了食物與人體相互作用的重要性。同時,結合了中國和印度的醫學思想,考慮了食物的偏性,提出了通過調整飲食抵消食物的不良影響的觀點,并強調了日常飲食的合理搭配[20]。以上理論雖然強調了飲食在維持健康和疾病預防中的作用,但直到18世紀對于具體食物營養價值的深入研究才進入了化學分析的階段。
營養學之父拉瓦錫通過對豚鼠進行的實驗證明了人體熱能與氧消耗之間的聯系。19世紀西方化學、物理、生物等基礎學科的飛速發展為營養學的興起奠定了基礎。營養學逐漸在世界范圍內受到了廣泛關注,其初始階段主要集中于對營養素如蛋白質、能量等方面的研究[19]。生物化學學科的迅速發展為營養學注入了新的活力。通過運用化學理論、技術和方法對有機生命體進行研究,得以揭示能量在體內動態和靜態代謝中的規律,使人類從微觀層面對食物在體內的代謝過程有了更深刻的理解。同期研究人員還發現了許多具有維生素特性的物質,并對膳食中的礦物質進行了廣泛的研究,從而證實了它們實際上是復雜的多元素混合物;同時也發現了許多由于營養素缺乏而引起的疾病,例如腳氣病、壞血病、佝僂病等[21]。分子生物學、電子顯微鏡、超速離心機、微量化學技術等先進技術在生命科學領域的廣泛應用將食療研究從宏觀推進到了微觀領域,這使人類能夠更加深入地研究活性物質,即非營養素的成分、功能、作用機制,以及它們在人體細胞代謝中的作用等。同時,這也為人類更深入地認識各種疾病的發生和發展奠定了基礎。
2.2 國內食療的發展
人類考古學的研究表明,原始人類的飲食主要依賴于采集和狩獵。原始的生產方式決定了遠古人類飲食結構的單一,以野果和生肉為主食,很大一部分時間都處于不能充饑的狀態。直到火的出現才使人類的食物逐漸由生食(寒食)進步到熟食。火的應用提高了食物的利用率,擴大了食物的來源,進一步改善了營養狀況,促進了大腦的發育。同時,火也起到了消毒滅菌的作用,加速了人類的進化。隨著生產力的不斷提升,農業和畜牧業的興起引領了人類飲食結構的巨變。古代中國周朝時期的《周禮》中記載著“食醫”的傳統,主要為天子調配“六食”“六飲”“六膳”等,這標志著食物功能的逐步多元化。食物的意義不再局限于填飽肚子,而逐漸融入了養生保健的理念。在同時期的《黃帝內經》中有關于食療的記載:“毒藥攻邪,五谷為養,五果為助,五畜為益,五蔬為充,氣味合而服之,以補精益氣;藥以祛之,食以隨之”等,這些原則對后期中醫的發展產生了深遠的影響[22]。
秦漢時期,《金匱要略方論》明確指出:“所食之味,有與病相宜,有與身為害,若得宜則益體,害則成疾”。《神農本草經》中收錄了365種草藥,其中大棗、人參、枸杞子、五味子、地黃、薏苡仁、茯苓、沙參、生姜、蔥白、當歸、貝母、杏仁、烏梅、鹿茸、核桃、蓮子、蜂蜜、桂圓、百合、附子等,都是富含藥性的食材,常用于配制藥膳。隋朝太醫巢元方所著《諸病源候論》詳細闡述了“養生方導引法”和“養生方”,繼承和發揚了《黃帝內經》的思想,將食療融入了日常生活實踐中[23]。唐宋時期是我國封建社會發展的鼎盛時期,此時期的醫學著作記載的食療、食治都有進一步的發展,《本草拾遺》《千金要方》《千金翼方》《食治》《食療本草》《食性本草》《食鑒》《養老奉親書》《食治通說》《保生要錄》《圣濟總錄》《太平圣惠方》《諸病源候論》《東京夢華錄》等都對食療有著傳承與引領的作用[24]。《飲膳正要》著于元代,將蒙古族特色飲食融入食療,其中記載了203種食物,強調“正常人應加強飲食營養的攝取,以預防疾病”。此書還詳細記載了飲食衛生、服用藥食的禁忌以及食物中毒的表現[25]。明代醫學以五行學說為核心,通過調控“五味”與五行相應,拓展了食療的理論基礎,其中《本草綱目》等著作涵蓋了300多種谷類、蔬菜、水果等食材,同時還提及了食物與藥物的相互作用和飲食的禁忌。隨著清朝時期的食療理論逐漸成熟,出現了大量的食療方劑,例如《食治秘方》《食物本草會纂》《食物常用藥物》《本草飲食譜》《食養療法》《養小錄》《醒園錄》等,這些著作為人們提供了豐富的食療知識,也為食療的實踐應用提供了靈活的配伍參考。其中王孟英在《隨息居飲食譜》中詳細記載了每類食材的名稱、功效、性味、宜忌、產地優劣等[26]。民國時期,隨著西方醫學傳入中國,食療理論逐漸融入了現代醫學的理念,諸如《食物療病法》《家庭食物療法》等體現了傳承與融合,對當代食療的探索與研究產生了深遠影響。
我國高度關注人民健康,特別重視傳統醫學的傳承與發展。為了貫徹落實《“健康中國2030”規劃綱要》,以提升國民的營養健康水平,國務院辦公廳于2017年6月30日發布了《國民營養計劃2017—2030》。該計劃明確強調了大力發展傳統食養服務,并加強了對傳統食養的指導和推動。隨著社會的進步,生活方式、飲食結構和生產方式的多元化,使慢性病成為當今威脅人類健康的主要問題之一,對慢性病的干預與管理已然成為當前健康工作的要點之一。現代營養學以及分子生物學、組學技術的快速發展,使人們能夠從微觀層面理解食物的結構與功能,以及食物與機體相互作用的機制,這為傳統食療提供了循證基礎。同時,大量基礎研究也揭示了慢性病如糖尿病、循環系統疾病、非酒精性脂肪肝、癌癥、衰老等與炎癥、氧化應激、代謝障礙等之間的關聯[27?30]。
3? 氧化應激、炎癥、代謝障礙與慢性病的關系
3.1 氧化應激
氧化應激是體內氧化與抗氧化作用失衡的一種狀態,傾向于氧化,導致氧化還原信號和控制的中斷和/或分子損傷[31]。活性氧自由基(ROS)不僅是造成氧化應激的主要原因,也是參與信號轉導的重要物質。ROS不僅可以調節機體免疫炎癥因子的產生,同時也可以誘導細胞凋亡[32]。當代快節奏的生活方式使人們的飲食結構發生了很大的變化,據相關調查,居民膳食結構呈現以下趨勢:能量攝入過多、高熱量食物比例顯著增加;西式飲食、油炸食品、快餐、酗酒等使身體組織不斷受到氧化應激的攻擊[33]。氧經過單電子還原形成超氧自由基,從而啟動自由基的繁殖。此外,氧也可以轉化為過氧化氫和羥基自由基。自由氧自由基具有極為活躍的不成對電子,為了達到穩定狀態,它們會尋找其他電子。此外,在缺氧條件下,呼吸鏈反應過程中也可能產生一氧化氮等,可能進一步導致活性物質的產生,例如活性醛、丙二醛和4?羥基壬烯醛等[34]。氧化應激的主要目標包括蛋白質、脂質以及DNA/RNA。ROS/活性氮自由基(RNS)可以攻擊蛋白質,氧化氨基酸會導致細胞結構和功能受損,從而對細胞造成不可逆轉的損傷,最終導致細胞壞死和凋亡過程。此外,ROS也可以攻擊脂質,氧化細胞膜表面的脂質,改變其結構和功能。同時,ROS通過修改DNA/RNA的堿基、干擾遺傳物質的功能以及增加誘變的機會,也會引發或誘發多種疾病[35]。因此,自由基和抗氧化狀態之間需要平衡以實現適當的代謝功能。
3.2 炎癥
炎癥是機體的一種天然防御反應,與許多疾病因素相關,例如微生物和病毒感染、暴露于過敏原、輻射和有毒化學物質、自身免疫和慢性病、肥胖、飲酒、煙草使用和高熱量飲食等[35]。氧化應激、慢性炎癥反應與許多非傳染性疾病相關。系統性慢性炎癥是一種持續低水平的炎癥反應,可能通過氧化應激等機制,導致組織和器官受損[36]。在慢性病中,ROS增加會引發氧化應激和蛋白質氧化,進而釋放炎癥信號分子,其中過氧化物還原蛋白2(PRDX2)已被認定為一個重要的炎癥信號分子[37]。研究表明,在糖尿病大鼠的大腦中,總抗氧化標志酶的脂質過氧化、亞硝酸鹽水平、丙二醛和總氧化劑狀態較低[38]。糖尿病誘導的氧化應激增加了促炎細胞因子如腫瘤壞死因子?α(TNF?α)和白細胞介素?6(IL?6)等的水平,并上調了炎癥分子血管細胞黏附分子?1(VCAM?1)、細胞間黏附分子?1(ICAM?1)以及核因子?κB(NF?κB)的表達,導致神經元退化,從而引發了糖尿病性腦病。炎癥刺激誘導了氧化還原活性細胞內酶PRDX2的釋放,PRDX2作為氧化還原依賴性炎癥介質,激活了巨噬細胞,促使其產生和釋放TNF?α,從而引發炎癥反應。許多研究也指出,氧化應激和慢性炎癥狀態為代謝性障礙的發展奠定了基礎[39]。
3.3 代謝障礙
氧化應激和慢性炎癥通過改變細胞和細胞核的機制(包括受損DNA的損傷修復和細胞周期調節),成為導致癌變、肥胖、糖尿病和心血管疾病等病理發展的重要潛在因素[40],低度炎癥、氧化應激與代謝異常共存,炎癥和氧化應激過程中產生的活性物質(如過氧化酶等)可以攻擊或改變每個已知的細胞成分的功能[41]。代謝障礙是指機體對物質的消化、吸收、排泄出現病理性、不協調的供需不平衡狀態,可以表現為單一物質的紊亂,也可以涉及多種物質。舉例來說,糖代謝紊亂會導致糖尿病,脂代謝紊亂則可能引起高脂血癥,而尿酸代謝紊亂則可能引發痛風等疾病。以糖尿病為例,2型糖尿病病人在發病前數年內可檢測到與肥胖有關的胰島素抵抗,特別是中心性肥胖。體積肥大的內臟脂肪細胞容易受到細胞死亡的影響,其基質血管部分更容易被巨噬細胞浸潤。這一現象與細胞因子(TNF?α、IL?6以及誘導的一氧化氮合酶的表達)密切相關。在糖尿病發生時,高血糖促使糖和氨基在蛋白質和核酸上反應,形成不可逆的翻譯修飾化合物,即晚期糖基化終產物(AGEs)。這些物質會積聚在血管細胞外基質中,并導致糖尿病的血管損傷,同時,也會刺激ROS產生,從而進一步增強AGE的形成。AGEs具有抗原性,可以誘導免疫反應,進一步印證了氧化應激、炎癥與代謝障礙之間的病理生理關系[42]。基于抗炎、抗氧化、改善代謝的慢性病管理逐漸引起臨床以及科研的關注,近年來大量研究也已證實非營養素抑炎抗氧化功能在慢性病干預方面的突出功能[43?46]。
4? 基于理論的實證研究
團隊基于家庭護士食療理論模型,于2022年提出非營養素的慢性病食療護理方案[47?51](臨床注冊號:ChiCTR2200066645),該方案觀察優化非營養素的膳食模式改善超重/肥胖慢性病病人的代謝指標水平,旨在驗證理論的有效性。采用隨機、單盲設計方法,最終招募并完成316例慢性病病人(冠心病72例、高血壓60例、糖尿病63例、高尿酸血癥60例和非酒精性脂肪肝61例),基于家庭護士食療理論模型,分為試驗組(非營養素膳食組)和對照組(普通膳食組)。試驗組為增加非營養素膳食攝入組,采用家庭護士代用茶聯合食療方案,根據每例病人每日所需能量的不同,為病人制定個性化的飲食食譜(增加富含非營養素食材的攝入);對照組為普通膳食組,即每天飲用家庭護士代用茶,所有參與者被告知不改變既往的運動及藥物使用習慣。茶飲指導:在干預前1周1次發放42 d量,干預前兩組病人均接受茶飲指導,家庭護士代用茶每日2包(能量22 kcal,蛋白質0.37 g,脂肪0.06 g,糖類5.11 g),餐間飲用,300~500 mL開水沖泡3 min以上,待茶色變淡、茶味消失后(約3杯),拆包食盡茶米;兩組按要求規律飲茶6周。
家庭護士食療理論指導下食療方案原則:1)為了符合居民日常膳食制作的實際情況,并提高膳食干預實踐的可行性和實施性,不要求對膳食進行精確計量,而是提供食材種類和重量的參考值,盡量符合家庭日常膳食狀態。2)健康膳食模式在家庭護士食療理論指導下結合實際情況選擇食物:推薦富含非營養素的新鮮水果、蔬菜,每日蔬菜攝入量達到500 g以上,30~50 g/d膳食纖維,≥30%為可溶性纖維,主食推薦全谷物粗糧,至少占每日攝入主食的三分之一;在脂肪攝入方面,避免反式脂肪酸,推薦用多不飽和脂肪酸和單不飽和脂肪酸取代飽和脂肪酸,比如食用橄欖油、堅果和菜籽油,堅果作為兩餐之間零食每日攝入不超過50 g;每日蛋白質推薦優質蛋白來源,選擇肉、蛋、豆、奶,肉類選擇魚類、雞胸肉、瘦牛肉、羊肉等;推薦病人選擇低血糖生成指數食物,以利于血糖控制。3)每日所需熱量計算:根據病人BMI及身體活動量計算每日需要能量,每日所需總熱量=標準體重×每日每千克體重熱量攝入;參考食物交換份法為病人制定1 d食譜。每日能量占比:早餐、午餐、晚餐各1/3,在3次正餐間進行2次加餐,加餐食品為由正餐中勻出10%能量的食物,遵循少食多餐的原則。主要評價指標包括:1)形態學指標,如腰圍、血壓、身高、體重、BMI;2)生理生化指標,如空腹血糖(FPG)、空腹胰島素(FINS)、糖化血紅蛋白(HbA1c)、三酰甘油(TG)、總膽固醇(TC)、高密度脂蛋白膽固醇(HDL?C)和低密度脂蛋白膽固醇(LDL?C)、尿素氮(BUN)、尿酸(UA)、血漿同型半胱氨酸(Hcy)、胰島素抵抗指數(HOMA?IR)。結果顯示,試驗組病人體重、BMI、腰圍、血壓、FPG、HOMA?IR、HbA1C、TG、TC、LDL?C、HDL?C、尿酸水平及脂肪肝情況較干預前均得到顯著改善,試驗組相較于對照組在代謝指標改善效果方面更為顯著。說明堅持家庭護士食療方案對于改善慢性病代謝指標有積極效應,從而也驗證了家庭護士食療理論的可靠性。
為進一步證實該理論的科學性及有效性,課題組于2024年在前期研究的基礎上進行了非營養素的優化膳食模式對于改善超重/肥胖代謝綜合征病人的抗氧化、抗炎癥、調整代謝研究。主要通過基于家庭護士食療理論的飲食模式干預對慢性病的共同基礎代謝綜合征病人代謝指標的影響,旨在優化先前食療方案的實際效果并形成可以推廣的飲食模式。采用隨機、單盲設計方法,最終招募并完成70例代謝綜合征病人的干預研究,研究人員向符合納入標準的受試者提供完整的知情同意書。干預組為優化非營養素膳食組,實施基于家庭護士食療理論指導下構建的代餐飲食模式,根據每例受試者的特殊性,構建以非營養素為主的個性化飲食餐單,餐單中主食為家庭護士代餐粉,早、午、晚三餐各1袋,每袋20 g,300 mL溫水沖飲,其余與富含非營養素膳食組相同,保持受試者原有用藥和運動情況不變,詳細告知受試者飲食具體內容和注意事項,提高受試者依從性和臨床實效性。對照組為富含非營養素膳食組,以非營養素為主的個性化飲食餐單,綜合考慮受試者的體重、飲食習慣、職業、病情等情況,制定個性化飲食餐單,餐單中主食為粗糧,其余選擇非營養素含量豐富的食物,用家庭護士代用茶(主要成分為苦蕎、枸杞)作為日常飲用水增加非營養素含量,每袋3 g,每天2袋,使用300 mL 80 ℃以上熱水沖泡3 min以上,每日沖飲次數至少3次,以便充分發揮產品功效。餐單為1周方案(定量的主食、蔬果和瘦肉,餐間加適量堅果和乳制品),根據受試者反饋情況,及時調整飲食模式。
測量結局指標:1)主要結局指標,即體重、胰島素抵抗指數;2)次要結局指標,包括人體測量學指標(BMI、腰圍)、生化指標[糖代謝指標(FPG、FINS)、脂代謝指標(TC、TG、HDL?C、LDL?C)、肝腎功能指標(丙氨酸氫基轉移酶、天門冬氨酸氨基轉移酶、血尿素氮、血肌酐、尿酸)、同型半胱氨酸]、炎癥指標(超敏?C反應蛋白)、氧化應激指標(丙二醛、超氧化物歧化酶)。所有指標測量在干預前及干預后2 d測量。結果表明2種飲食模式均可降低受試者體重,對改善糖脂代謝指標、肝腎功能有一定效果,其中優化非營養素膳食組飲食模式對體重、FINS、尿酸指標的改善程度明顯優于富含非營養素膳食組飲食模式;同時,優化非營養素膳食模式可降低受試者收縮壓和同型半胱氨酸,改善炎癥指標,提高超氧化物歧化酶活性。該研究方案證實了家庭護士食療研究方案在抗炎、抗氧化方面的作用,提高了調節代謝的作用效果,形成了可復制飲食模式,對于兩組飲食模式的長期效果還需進一步的研究探索證明。這一發現為慢性病防治提供了新的思路和方法,在理論層面,證實健康膳食模式和非營養素成分在慢性病防治中的作用機制,揭示了慢性病食療的內在邏輯;在實踐層面,以家庭護士飲食模式為例,展示了慢性病食療在實際應用中的有效性和可行性。
材料說明:家庭護士?代用茶是一種以可食用的苦蕎麥顆粒為主要原料,通過沖泡方式飲用的代用茶。該產品符合標準號:GH/T 1091—2014的執行標準,生產許可證編號:SC11461012208320。家庭護士?代餐粉是一種優化了非營養素搭配比例以大豆分離蛋白為主要原料,包含黃酮、多糖、甾醇、β?葡聚糖、生物堿等主要非營養素成分的代餐產品。該產品符合標準號:GB/T 29602的執行標準,生產許可證編號:SC106210213011970,由山西醫科大學食療科技研究中心提供給受試者免費使用。
5? 成果技術鑒定
家庭護士食療理論、基于家庭護士食療理論構建的慢性病飲食管理模式及其指導下開發的兩款功能性食品(即家庭護士?代用茶、家庭護士?蛋白復配粉)作為韓世范教授及其研究團隊的代表性研究成果,經受住了來自慢性病管理、大健康等領域多名專家學者的全面評估與鑒定。經鑒定,家庭護士食療理論、慢性病飲食管理模式及兩款功能性食品等創新成果達到國際領先水平,其全產業鏈創新符合新質生產力的要素特征,產學研深度結合,對于推動大健康產業的創新發展具有重要意義。
6? 小結
綜上所述,全球范圍內慢性病管理仍面臨著極大的挑戰。雖然健康飲食模式的干預被證實有效,但食療的內在作用機制一直缺乏系統理論的指導。家庭護士食療理論在病理生理機制層面提出了一種干預方式,通過構建非營養素慢性病干預的理論模型填補了該領域的空白。應用該理論,可以從現代醫學病理生理角度解釋健康膳食模式、中醫食療及異病同治、同病異治背后的主要原理,亦對中西醫結合理論完善有積極意義。隨著科學技術的不斷發展,對非營養素的探究也將不斷深入。家庭護士食療理論模型將對未來非營養素慢性病管理的干預和研究提供了系統指導,并為不同地域的慢性病三級預防、臨床和社區干預策略的制定和實施提供理論支持;其也將指導1+3=N種健康膳食模式的實現(1=非營養素,3=抗炎、抗氧化、調節代謝),為人類健康發展提供護理特色的食療方案。
參考文獻:
[1]? World Health Organization.World health statistics overview 2019:monitoring health for the SDGs,sustainable development goals[R].Geneva:World Health Organization,2019:1.
[2]? 殷鵬,齊金蕾,劉韞寧,等.2005—2017年中國疾病負擔研究報告[J].中國循環雜志,2019,34(12):1145-1154.
[3]? KEYS A,MENOTTI A,KARVONEN M J,et al.The diet and 15-year death rate in the seven countries study[J].American Journal of Epidemiology,1986,124(6):903-915.
[4]? BUZINA R,KEYS A,MOHACEK I,et al.Coronary heart disease in seven countries.Ⅴ.Five-year follow-up in Dalmatia and Slavonia[J].Circulation,1970,41(Suppl 4):I40-I51.
[5]? ESTRUCH R,ROS E,SALAS-SALVAD? J,et al.Primary prevention of cardiovascular disease with a Mediterranean diet supplemented with extra-virgin olive oil or nuts[J].The New England Journal of Medicine,2018,378(25):e34.
[6]? HUO R,DU T,XU Y,et al.Effects of Mediterranean-style diet on glycemic control,weight loss and cardiovascular risk factors among type 2 diabetes individuals:a meta-analysis[J].European Journal of Clinical Nutrition,2015,69(11):1200-1208.
[7]? CENNI S,SESENNA V,BOIARDI G,et al.The Mediterranean diet in paediatric gastrointestinal disorders[J].Nutrients,2022,15(1):79.
[8]? CASTRO-BARQUERO S,RUIZ-LEON A M,SIERRA-PEREZ M,et al.Dietary strategies for metabolic syndrome:a comprehensive review[J].Nutrients,2020,12(10):2983.
[9]? APPEL L J.The effects of dietary factors on blood pressure[J].Cardiology Clinics,2017,35(2):197-212.
[10]? BLUMENTHAL J A,BABYAK M A,HINDERLITER A,et al.Effects of the DASH diet alone and in combination with exercise and weight loss on blood pressure and cardiovascular biomarkers in men and women with high blood pressure:the ENCORE study[J].Archives of Internal Medicine,2010,170(2):126-135.
[11]? FUNG T T,CHIUVE S E,MCCULLOUGH M L,et al.Adherence to a DASH-style diet and risk of coronary heart disease and stroke in women[J].Archives of Internal Medicine,2008,168(7):713-720.
[12]? 中國營養學會.《中國居民膳食指南科學研究報告(2021)》簡介[J].營養學報,2021,43(1):1-2.
[13]? CENA H,CALDER P C.Defining a healthy diet:evidence for the role of contemporary dietary patterns in health and disease[J].Nutrients,2020,12(2):334.
[14]? NIU K J,MOMMA H,KOBAYASHI Y,et al.The traditional Japanese dietary pattern and longitudinal changes in cardiovascular disease risk factors in apparently healthy Japanese adults[J].European Journal of Nutrition,2016,55(1):267-279.
[15]? ALASALVAR C, BOLLING B W.Review of nut phytochemicals,fat-soluble bioactives,antioxidant components and health effects[J].British Journal of Nutrition,2015,113(S2):S68-S78.
[16]? 肖建才,劉建功,趙子鶴,等.傳統健康食療產業發展現狀與展望[J].食品與機械,2022,38(6):8-15.
[17]? URQUIAGA I,ECHEVERR?A G,DUSSAILLANT C,et al.Origin,components and mechanisms of action of the Mediterranean diet[J].Revista Medica De Chile,2017,145(1):85-95.
[18]? 韓世范,馮耀清,高文晴.非營養素防治慢性病的食療理論模型[J].護理研究,2023,37(4):565-569.
[19]? 劉婷婷,徐旭,田成旺.不斷發展的中西醫飲食營養療法[J].醫學食療與健康,2021,19(3):28-30.
[20]? 劉帥帥,劉煥蘭,張露文.古代西方醫學中的食療學[J].中國中醫藥現代遠程教育,2021,19(3):63-65.
[21]? 張婉儀.人體營養學的引進及發展研究[D].咸陽:西北農林科技大學,2020.
[22]? 朱建平,鄧文祥,吳彬才,等.“藥食同源”源流探討[J].湖南中醫藥大學學報,2015,35(12):27-30.
[23]? 楊光,蘇芳芳,陳敏.藥食同源起源與展望[J].中國現代中藥,2021,23(11):1851-1856.
[24]? 楊溢,閻志勇,朱曉光,等.藥食同源理論的綜述[J].中國保健營養,2019,29(7):50-51.
[25]? 辛寶,胡晗,錢文文,等.基于傳統食養構建中醫食療研究與應用新體系[J].西部中醫藥,2021,34(1):83-86.
[26]? 陶詩怡,張蘭鑫,劉果.王孟英《隨息居飲食譜》中瓜果食療應用特點簡析[J].環球中醫藥,2020,13(7):1217-1220.
[27]? LUC K,SCHRAMM-LUC A,GUZIK T J,et al.Oxidative stress and inflammatory markers in prediabetes and diabetes[J].Journal of Physiology and Pharmacology,2019,70(6).DOI:10.26402/jpp.2019.6.01.
[28]? STEVEN S,FRENIS K,OELZE M,et al.Vascular inflammation and oxidative stress:major triggers for cardiovascular disease[J].Oxidative Medicine and Cellular Longevity,2019,2019:7092151.
[29]? FARZANEGI P,DANA A,EBRAHIMPOOR Z,et al.Mechanisms of beneficial effects of exercise training on non-alcoholic fatty liver disease(NAFLD):roles of oxidative stress and inflammation[J].European Journal of Sport Science,2019,19(7):994-1003.
[30]? LIN Y N,JIANG M,CHEN W J,et al.Cancer and ER stress:mutual crosstalk between autophagy,oxidative stress and inflammatory response[J].Biomedecine & Pharmacotherapie,2019,118:109249.
[31]? SIES H,JONES D P.Oxidative stress[M].2nd ed.Amsterdam:Elsevier,2007:45-48.
[32]? FORRESTER S J.Reactive oxygen species in metabolic and inflammatory signaling[J].Circulation Research,2018,6:877-902.
[33]? TAN B L,NORHAIZAN M E,LIEW W P P.Nutrients and oxidative stress:friend or foe?[J].Oxidative Medicine and Cellular Longevity,2018,2018:9719584.
[34]? JOHNSON M,GILLBERG C,VINSA I,et al.A randomized controlled trial of a new intervention in early symptomatic syndromes eliciting neurodevelopmental clinical examinations:PR-ESSENCE[J].European Child & Adolescent Psychiatry,2023,32(1):63-74.
[35]? POPRAC P,JOMOVA K,SIMUNKOVA M,et al.Targeting free radicals in oxidative stress-related human diseases[J].Trends in Pharmacological Sciences,2017,38(7):592-607.
[36]? ?URA?KOV? Z.Some current insights into oxidative stress[J].Physiological Research,2010,59(4):459-469.
[37]? HUSSAIN T,TAN B,YIN Y L,et al.Oxidative stress and inflammation:what polyphenols can do for us?[J].Oxidative Medicine and Cellular Longevity,2016,2016:7432797.
[38]? MURIACH M,FLORES-BELLVER M,ROMERO F J,et al.Diabetes and the brain:oxidative stress,inflammation,and autophagy[J].Oxidative Medicine and Cellular Longevity,2014,2014:102158.
[39]? PRABHAKAR O.Cerebroprotective effect of resveratrol through antioxidant and anti-inflammatory effects in diabetic rats[J].Naunyn-Schmiedeberg's Archives of Pharmacology,2013,386(8):705-710.
[40]? RANI V,DEEP G,SINGH R K,et al.Oxidative stress and metabolic disorders:pathogenesis and therapeutic strategies[J].Life Sciences,2016,148:183-193.
[41]? NDREPEPA G.Myeloperoxidase--a bridge linking inflammation and oxidative stress with cardiovascular disease[J].International Journal of Clinical Chemistry,2019,493:36-51.
[42]? PETRIE J R,GUZIK T J,TOUYZ R M.Diabetes,hypertension,and cardiovascular disease:clinical insights and vascular mechanisms[J].The Canadian Journal of Cardiology,2018,34(5):575-584.
[43]? WANG Q,YANG B,WANG N,et al.Tumor immunomodulatory effects of polyphenols[J].Frontiers in Immunology,2022,13:1041138.
[44]? ZHANG Y W,LIU K J,YAN C Q,et al.Natural polyphenols for treatment of colorectal cancer[J].Molecules,2022,27(24):8810.
[45]? RODR?GUEZ-DAZA M C,DE VOS W M.Polyphenols as drivers of a homeostatic gut microecology and immuno-metabolic traits of Akkermansia muciniphila:from mouse to man[J].International Journal of Molecular Sciences,2022,24(1):45.
[46]? VARELA-L?PEZ A,BULL?N P,GIAMPIERI F,et al.Non-nutrient,naturally occurring phenolic compounds with antioxidant activity for the prevention and treatment of periodontal diseases[J].Antioxidants,2015,4(3):447-481.
[47]? 王妍,韓世范,朱瑞芳,等.家庭護士食療方案在超重/肥胖2型糖尿病病人飲食干預中的實證研究[J].護理研究,2023,37(12):2085-2091.
[48]? 張歡,韓世范,陜弋華,等.家庭護士食療方案在超重/肥胖代謝功能障礙相關性脂肪肝病人中的實證研究[J].護理研究,2023,37(12):2092-2099.
[49]? 蔣爾丹,韓世范,石瑩,等.家庭護士食療方案在超重/肥胖高血壓病人飲食干預中的實證研究[J].護理研究,2023,37(12):2107-2113.
[50]? 陜弋華,韓世范,石瑩,等.家庭護士食療方案在超重/肥胖高尿酸血癥病人飲食干預中的實證研究[J].護理研究,2023,37(12):2100-2106.
[51]? 石瑩.超重或肥胖冠心病病人食療護理方案的構建與應用[D].太原:山西醫科大學,2023.
(收稿日期:2024-05-09;修回日期:2024-06-10)
(本文編輯 蘇琳)

