丁氏稻種萌發期耐熱性篩選與評價


摘要" 本研究對P0340、CII141和R289等20份丁氏稻種在種子萌發期進行高溫脅迫處理,以正常培養為對照,測定其發芽勢、發芽率和根、芽長等10項生長指標,利用隸屬函數綜合評價法和分級評價值進行耐熱綜合評估,同時進行相關分析、回歸分析及聚類分析,并結合過氧化氫(H2O2)和丙二醛(MDA)含量測定和超氧化物歧化酶(SOD)、過氧化氫酶(CAT)和過氧化物酶(POD)活性分析,探討不同稻種萌發期生長指標和生理指標的差異,以篩選耐熱性強的稻種。結果表明,高溫處理后,水稻的發芽勢等生長指標在品種間和處理間差異較大;耐熱綜合評估方面,P0340排位較高,耐熱性強;Y595排位較低,耐熱性弱;相關性分析和回歸分析確立了發芽率和幼苗干重可作為耐熱性鑒定的重要指標;聚類分析將參試稻種耐熱性劃分為極強、強、中等、弱和極弱5類,其中耐熱性極強品種為P0340,耐熱性強品種為CII141、R289和Y1544,耐熱性中等品種包括R107和Δ133等10個,耐熱性弱品種包括PII140和PII21等5個,耐熱性極弱品種為Y595;生理指標方面,與對照相比,高溫脅迫下P0340的H2O2和MDA的含量增幅較少,差異無統計學意義(Pgt;0.05);SOD、CAT和POD活性與對照相比顯著增加(Plt;0.05),表明P0340萌發期耐熱性強,活性氧含量累積少,抗氧化能力強。綜上,篩選得到的高耐熱稻種P0340,其可為培育耐熱新品種提供材料基礎。
關鍵詞" 丁氏稻種;耐熱性;萌發期;綜合評價;生理特性
中圖分類號" S326" " " "文獻標識碼" A" " " "文章編號" 1007-7731(2025)02-0001-09
DOI號" 10.16377/j.cnki.issn1007-7731.2025.02.001
Screening and evaluation of heat tolerance during the germination stage in Ting’s rice
ZHONG Weijie1,2" " CHEN Jie1,2" " LIU Hui2" " ZHU Zhenquan2" " RUAN Yang2" " MA Shuaipeng3" " LIU Xiangdong4
LIU Yujia1,2" " LI Xiang1,2
(1Guangdong Provincial Key Laboratory of Utilization and Conservation of Food and Medicinal Resources in Northern Region, Shaoguan University, Shaoguan 512005, China;
2College of Biology and Agriculture, Shaoguan University, Shaoguan 512005, China;
3Guangzhou Experimental Station of Chinese Academy of Tropical Agricultural Sciences, Guangzhou 510140, China;
4State Key Laboratory for Conservation and Utilization of Subtropical Agro-Bioresources, South China Agricultural
University, Guangzhou 510642, China;
Abstract" The study subjected 20 Ting’s rice varieties, including P0340, CII141, and R289 were treated with high temperature stress during seed germination,normal culture was used as control, 10 key germination indexes such as germination potential, germination rate, and root and shoot length were measured. By using the membership function comprehensive evaluation method and grading evaluation value, the heat resistance comprehensive evaluation was carried out. Meanwhile, correlation analysis, regression analysis and cluster analysis were carried out, combined with the determination of hydrogen peroxide (H2O2) and malondialdehyde (MDA) and the activity analysis of superoxide dismutase (SOD), catalase (CAT) and peroxidase (POD), the differences of growth indexes and physiological indexes of different rice varieties at germination stage were discussed, so as to screen rice varieties with strong heat resistance.The results showed that after high temperature treatment, the growth indexes such as germination potential of rice were different between varieties and treatments.In terms of heat resistance comprehensive evaluation, P0340 ranked first, showcasing strong heat tolerance, while Y595 ranked last, indicating weak heat tolerance. Correlation analysis and regression analysis established that germination rate and seedling dry weight could be used as important indexes for heat resistance identification.According to the cluster analysis, the heat resistance of the rice varieties tested was divided into 5 categories:extremely strong, strong, medium, weak and extremely weak. Among them, the variety with strong heat resistance was P0340, the varieties with strong heat resistance were CII141, R289, and Y1544, 10 varieties with medium heat resistance included R107 and Δ133, etc., and 5 varieties with weak heat resistance included PII140 and PII21,etc. The very weak heat resistance variety was Y595. In terms of physiological indexes, compared with control, under high temperature stress, H2O2 and MDA contents of P0340 increased less, the difference was not statistically significant (Pgt;0.05). The activities of SOD, CAT, and POD in P0340 significantly increased compared to the control (Plt;0.05). These findings suggest that P0340 displays strong heat tolerance during the germination stage, characterized by minimal accumulation of reactive oxygen species and enhanced antioxidant capacity. In conclusion, the identification of the high heat tolerance rice variety P0340 in this study offers a valuable genetic resource for the development of new heat tolerance varieties.
Keywords" Ting’s rice; heat tolerance;germination stage; comprehensive evaluation; physiological traits
水稻是主要的糧食作物之一,幼苗的萌發能力及早期生長狀況是衡量其活力的重要指標。溫度對其生長與分布至關重要,Zhao等[1]研究表明,每上升1 ℃,水稻的產量將下降2%。持續高溫會降低水稻種子的發芽潛力,導致發芽率降低,幼苗活力減弱[2-3]。水稻幼苗期生長的適宜溫度在25~28 ℃,在42~45 ℃的高溫環境下,幼苗會出現嚴重的水分流失現象,葉片逐漸枯萎變黃,幼苗和根系的生長受到嚴重抑制,甚至導致幼苗死亡[4-6]。由于遺傳背景不同,稻種對熱脅迫的抗性存在顯著差異。在45 ℃熱脅迫條件下,粳稻日本晴的幼苗幾乎全部枯萎,其耐熱能力較弱[5];而秈稻HT54的幼苗則展現出較高的耐熱性,能夠耐受48 ℃的高溫,持續79 h存活[7]。
篩選耐熱稻種是解決水稻耐熱性栽培的有效途徑之一。近年來,研究人員針對不同稻種的幼苗期耐熱性進行鑒定評價,并篩選獲得耐熱種質[8-10]。如劉進等[8]利用秈稻、粳稻核心種質資源,以耐熱等級和幼苗存活率為指標,篩選出嘉育253、中優早8號和秀水09等20個耐熱品種。季平等[9]認為水稻苗期葉片抗氧化酶活性和質膜損傷程度等可作為耐熱水稻品種篩選的參考指標。稻種資源作為水稻育種工作中不可或缺的物質材料,承載著豐富的遺傳信息。其中,丁氏稻種資源(Ting’s rice germplasm collection),以其獨特性和多樣性而備受矚目[11]。該資源主要由3部分構成:一是丁穎院士收集的7 000余份各地栽培稻,二是盧永根院士收集的2 000余份野生稻資源,三是新型四倍體水稻新種質和水稻染色體單片段代換系。該稻種資源具有豐富的遺傳變異性,含有優良的抗逆基因(耐冷、耐鋁和耐鋅等),為水稻育種提供了寶貴的材料[12-15]。目前,已利用丁氏稻種資源鑒定了一批優良的抗逆材料,但有關丁氏稻種萌發期耐熱性的研究較少。因此,本研究利用廣東省植物分子育種重點實驗室構建的丁氏稻種核心資源,選取P0340和CII141等20種遺傳多樣性豐富的稻種作為研究材料,利用隸屬函數綜合評價等方法對稻種進行耐熱性綜合評價,測定過氧化氫(Hydrogen peroxide,H2O2)、丙二醛(Malondialdehyde,MDA)含量和超氧化物歧化酶(Superoxide dismutase,SOD)、過氧化氫酶(Catalase,CAT)及過氧化物酶(Peroxidase,POD)活性,探究高溫脅迫對水稻苗期生長發育和生理代謝的影響,為耐熱水稻品種的培育提供參考。
1 材料與方法
1.1 供試材料
選取20份丁氏稻種,分別為P0340、CII141、R289、Y1544、Δ134、Δ125、Δ133、R107、Δ151、Y1472-2、P0081、P0116、P0328、DR9、ZB132、Y814、PII140、PII21、P616和Y595,由華南農業大學亞熱帶農業生物資源保護與利用國家重點實驗室提供。
1.2 試驗試劑
生理指標測定試劑盒均采購于南京建成生物工程研究所,包括H2O2測定試劑盒(A064-1-1)、MDA測定試劑盒(A003-3-1)、SOD測試盒(A001-1-2)、CAT測定試劑盒(A007-1-1)和POD測定試劑盒(A084-3-1)。
1.3 試驗方法
試驗于2022—2023年在廣東韶關學院生物與農業學院分子生物學與基因工程研究室進行。參照葉嬋娟等[10]研究方法進行水稻種子的處理,每份水稻品種挑選200余粒飽滿、大小一致的種子,使用10%次氯酸鈉消毒30 min,消毒后用蒸餾水沖洗3次,然后加入蒸餾水至完全沒過種子,在28 ℃恒溫恒濕培養箱(暗培養)中浸種24 h;吸水后的種子轉移到墊有兩層濕潤濾紙的培養皿(直徑10 cm)中,在28 ℃恒溫恒濕培養箱(暗培養)中進行催芽。種子露白后點播到96孔培養板中,用木村B水稻營養液(NS1050)進行培養,定期更換營養液,并置于人工氣候箱中進行苗期耐熱性處理。正常培養環境(對照)設置:28 ℃,13 L∶11 D,濕度80%。模擬高溫環境設置:42 ℃,13 L∶11 D,濕度80%。高溫脅迫處理7 d后測定幼苗生長指標,并將采集的幼苗進行液氮速凍,放入-80 ℃冰箱保存,用于后續生理指標測定。試驗共設3次重復。
1.4 測定指標和方法
1.4.1 生長指標 參照Wang等[16]方法分別計算發芽勢、發芽率、發芽指數和活力指數,計算如式(1)~(4)。測量第7天已發芽種子的芽長、根長和根數,以及幼苗鮮重。隨后,將幼苗放入烘箱中烘干至恒重,稱量幼苗干重,幼苗相對含水量計算如式(5)。
發芽勢=第4天發芽的種子數/供試種子數 (1)
發芽率(%)=第7天發芽的種子數/供試種子數 (2)
發芽指數(%)=∑(每天發芽種子數/相應發芽天數)×100 (3)
活力指數=發芽指數×(第7天的芽長+第7天的根長) (4)
幼苗相對含水量(%)=(幼苗鮮重-幼苗干重)/幼苗鮮重 (5)
1.4.2 耐熱系數 為去除各性狀的單位差異,參照張娟偉等[17]方法,分別計算發芽勢、發芽率、發芽指數、活力指數、芽長、根長、根數、幼苗鮮重、幼苗干重和幼苗相對含水量的耐熱系數,計算如式(6)。
耐熱系數=處理組指標測定值/對照指標測定值 (6)
1.4.3 耐熱性綜合評價 耐熱性綜合評價是將測量的各個單項指標(耐熱系數)通過轉化成新的綜合指標,并采用加權平均法將各品種的隸屬值累加,從而得出耐熱綜合評價值D值。D值越大,說明該品種的耐熱性等級越高[18-19]。利用SPSS 21.0軟件對發芽勢、發芽率和發芽指數等10項指標的耐熱系數進行主成分分析,采用最大方差法提取主成分,將多項指標轉化為少數幾個綜合指標,其中累積貢獻率大于85%,且特征數大于1,并根據各綜合指標的主成分值計算隸屬函數值、權重系數和耐熱綜合評價值,計算如式(7)~(9)。
μ(X_j)=(X_j-X_min)/(X_max-X_min) (7)
W_j=P_j/(∑P_j) (8)
D=∑[μ(X_j)×W_j] (9)
式(7)~(9)中,Xj表示第j個綜合指標的主成分值(j=1,2,3,…,n),Xmax、Xmin分別為在所有稻種中第j個綜合指標的最大值和最小值。Wj為權重,指第j個綜合指標(主成分)在所有綜合指標(主成分)中的重要程度;Pj指通過主成分分析所獲得的第j個綜合指標(主成分)的貢獻率(j=1, 2, 3, …, n)。D值表示綜合評價值(j=1, 2, 3, …, n)。
1.4.4 耐熱分級評價值 參照文獻[20]的劃級方法計算耐熱分級評價值GC,GC值越大,綜合耐熱性越強。以稻種的各耐熱系數平均值x ?_j為基準(j=1, 2, 3, …, n),以標準差s_j作為等級劃分的依據。各稻種的耐熱系數x_ij表示第i個稻種的第j個耐熱系數(i=1, 2, 3, …, n;j=1, 2, 3, …, n),如:x_ij≥x ?_j+s_j,則賦級別值1;x ?_j+s_jgt;x_ij≥x ?_j,則賦值2;x ?_jgt;x_ij≥x ?_j-s_j,則賦值3;x ?_j-s_jgt;x_ij,則賦值4。將同一參試稻種各耐熱系數下的級別值相加,得到各稻種的耐熱級別值總和GV,耐熱分級評價值GC計算如式(10)。
GC=(nm-GV)/(nm-n) (10)
式中,n為指標個數(本研究為10),m為分級級數(本研究為4)。
1.4.5 相關性分析、回歸分析及聚類分析 利用SPSS 21.0軟件對10項指標的耐熱系數進行Pearson相關性分析。以各耐熱系數為自變量,D值為因變量進行逐步分析,同時方差擴大因子值VIF少于5,建立多元回歸方程。根據D值,采用平方歐式距離和組間平均連接法對20份稻種進行聚類分析。
1.4.6 生理指標 根據耐熱綜合評價值和聚類分析結果,挑選5份不同等級耐熱能力的稻種進行生理指標測定,包括H2O2和MDA含量,SOD、CAT和POD活性。依據試劑盒說明書步驟進行各指標測定和計算。生理指標的相對含量或活性計算如式(11)。
相對含量或活性=(處理-對照)/對照 (11)
1.5 數據處理
采用Excel 2019軟件對數據進行整理,使用SPSS 21.0軟件進行主成分、相關性、回歸及聚類分析,使用GraphPad Prism 9.5軟件對數據進行差異分析及作圖。
2 結果與分析
2.1 高溫脅迫對水稻生長指標的影響
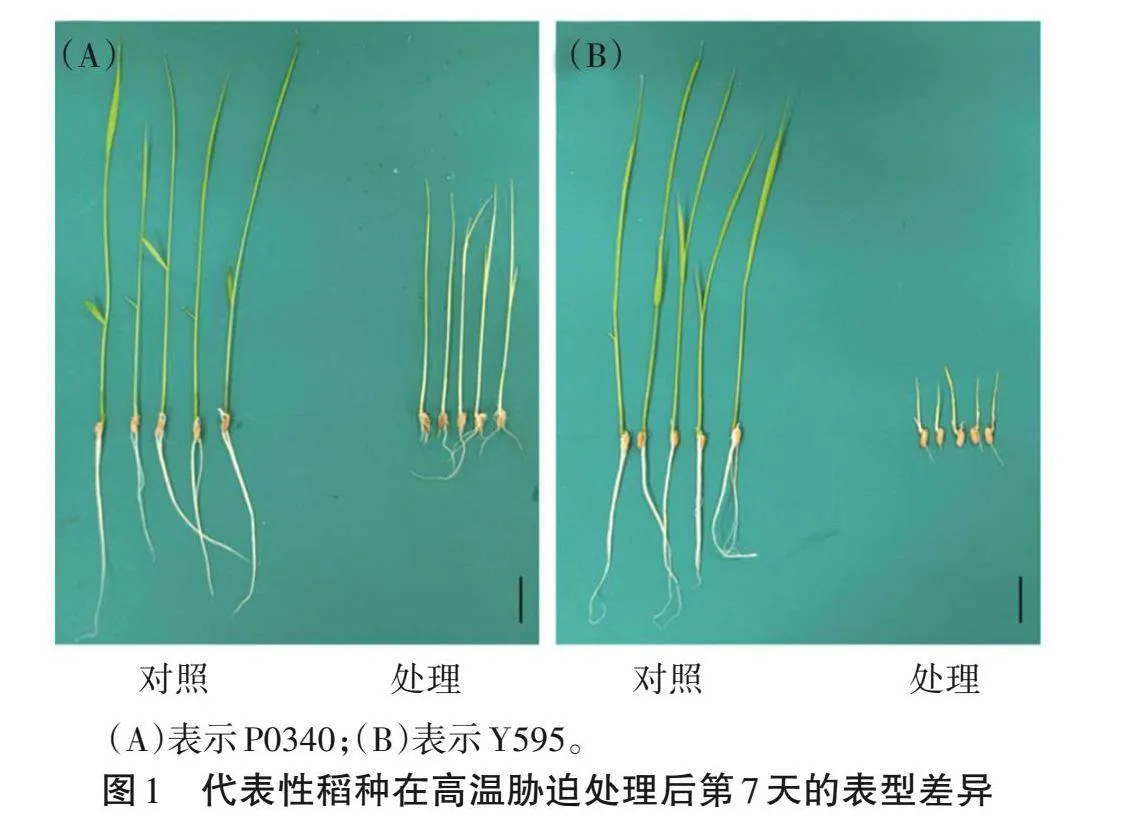
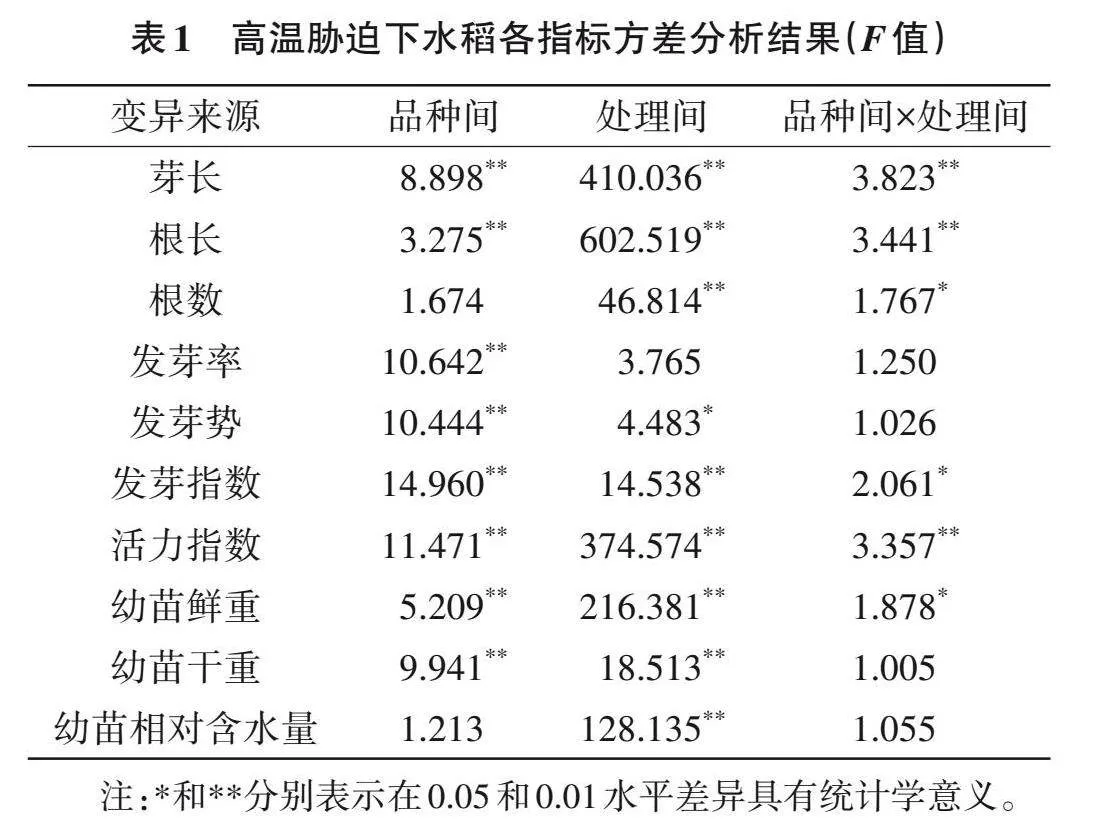
高溫脅迫下,20個參試稻種的表型產生了變化,其中P0340和Y595最為明顯(圖1)。對10個生長指標進行測定,方差分析結果(F值)表明,根數和幼苗相對含水量在品種間差異無統計學意義(Pgt;0.05),芽長、根長、發芽率、發芽勢、發芽指數、活力指數、幼苗鮮重和幼苗干重在品種間差異存在統計學意義(Plt;0.01);發芽率在處理間差異無統計學意義(Pgt;0.05),芽長、根長、根數、發芽勢、發芽指數、活力指數、幼苗鮮重、幼苗干重和幼苗相對含水量在處理間差異存在統計學意義(Plt;0.05)(表1)。說明高溫處理后,不同稻種的單項指標存在顯著差異,直接利用單項指標不能準確評價稻種的耐熱性。
2.2 耐熱性綜合評價及分級評價
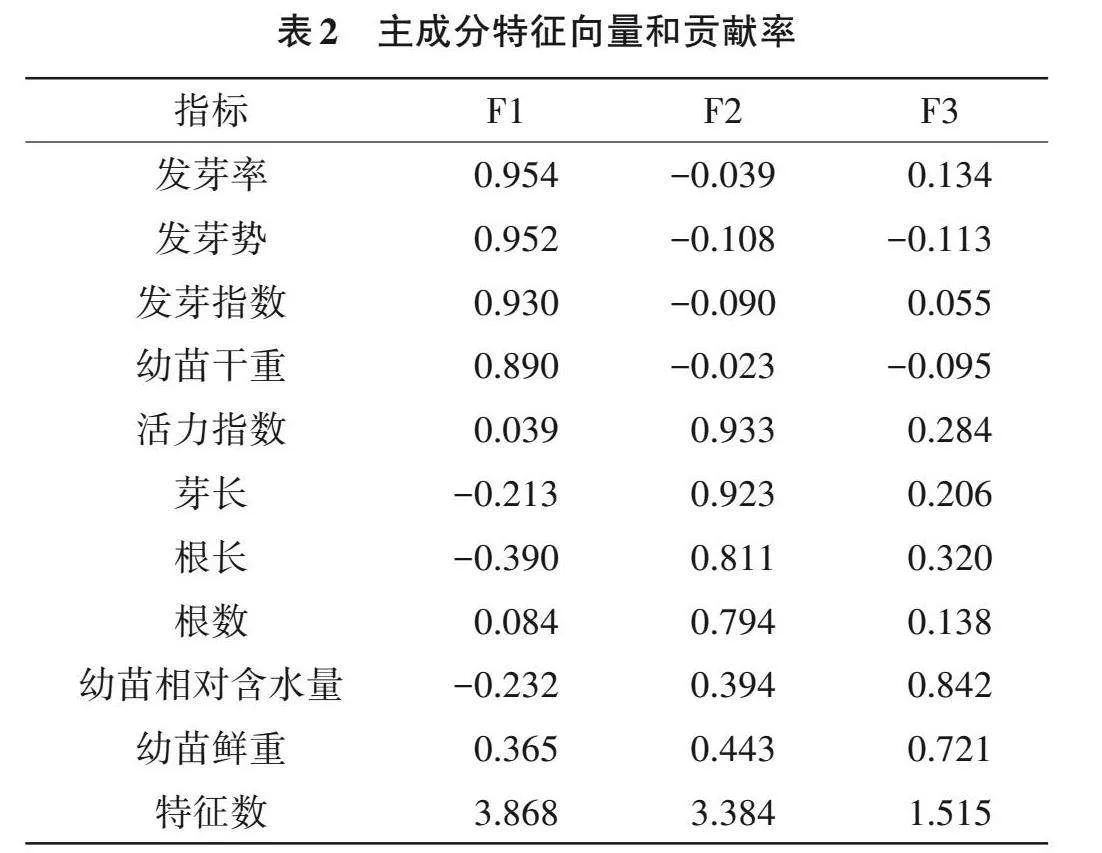
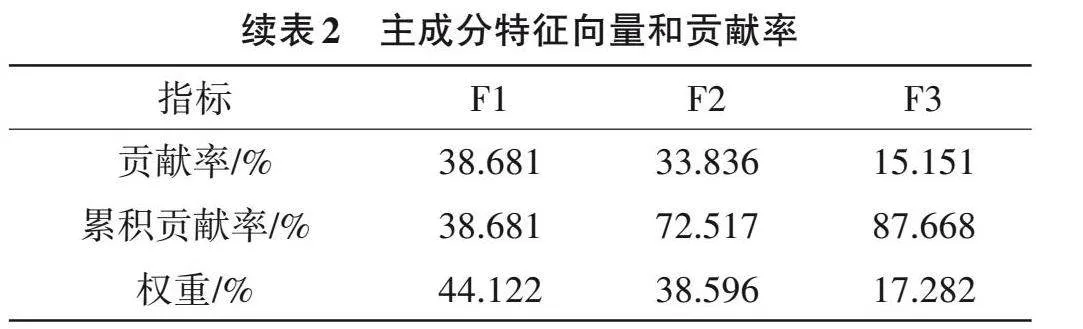
主成分分析提取了累積貢獻率大于85%且特征值大于1的前3個主成分(F1,F2和F3),分別解釋了38.681%、33.836%和15.151%的數據變異,合計可解釋表型總變異的87.668%,可較好代表10個原始指標,即綜合指標1、2和3。其中,發芽率、發芽勢、發芽指數和幼苗干重包含在F1中,F2包含活力指數、芽長、根長和根數,F3包括幼苗相對含水量和幼苗鮮重(表2)。
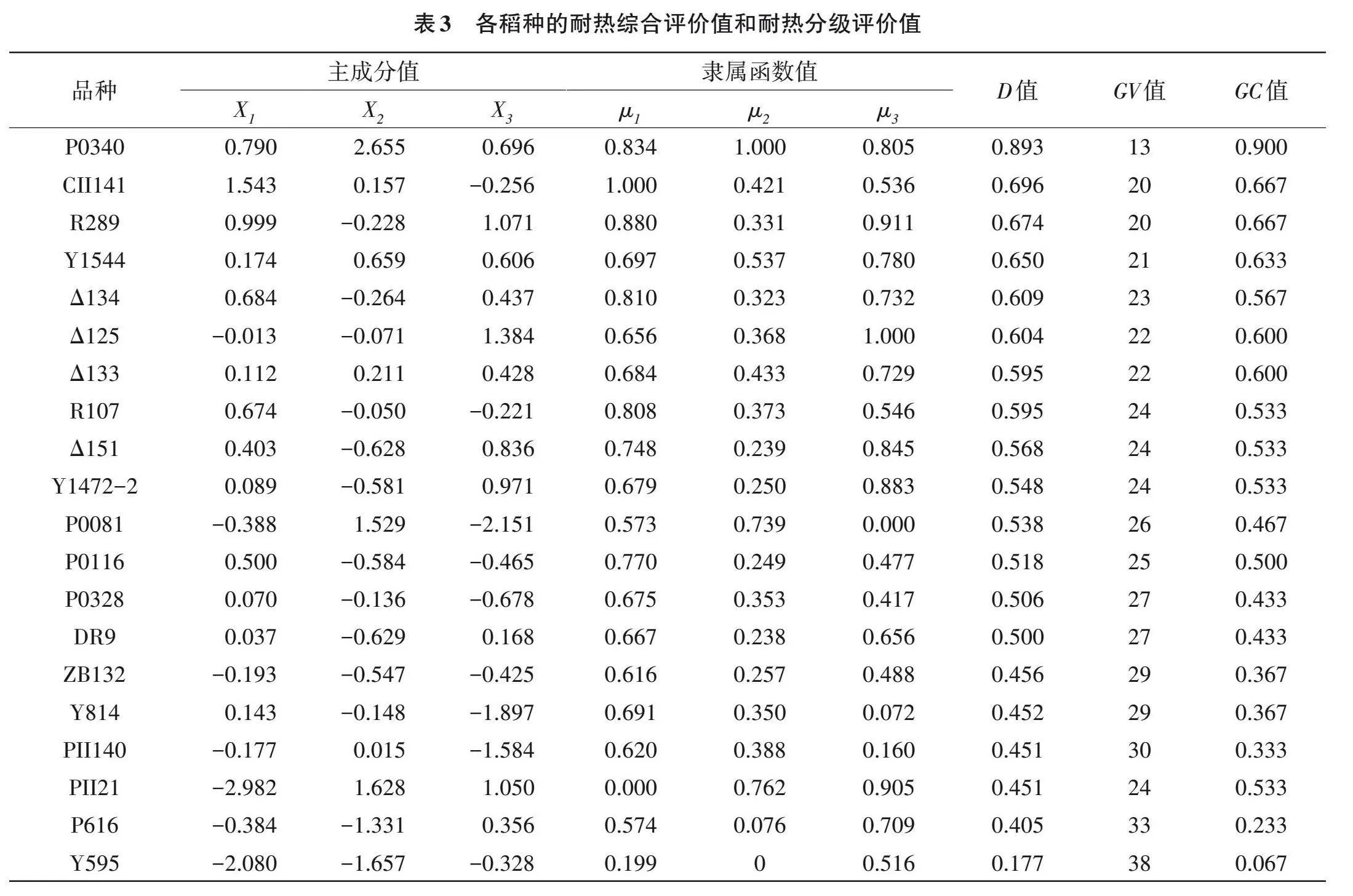
3個主成分的權重分別為44.122%、38.596%和17.282%(表2),主成分上的隸屬函數值和耐熱綜合評價值結果顯示(表3),稻種P0340 D值最高,為0.893,而Y595 D值最低,為0.177。此外,分級評價法結果顯示,P0340的GC值最高,為0.900,而Y595的GC值最低,為0.067。綜上,分級評價結果與隸屬函數的綜合評價法得出的結論相吻合,表明P0340耐熱性較強;Y595耐熱性較弱。
2.3 生長指標的相關性及回歸分析
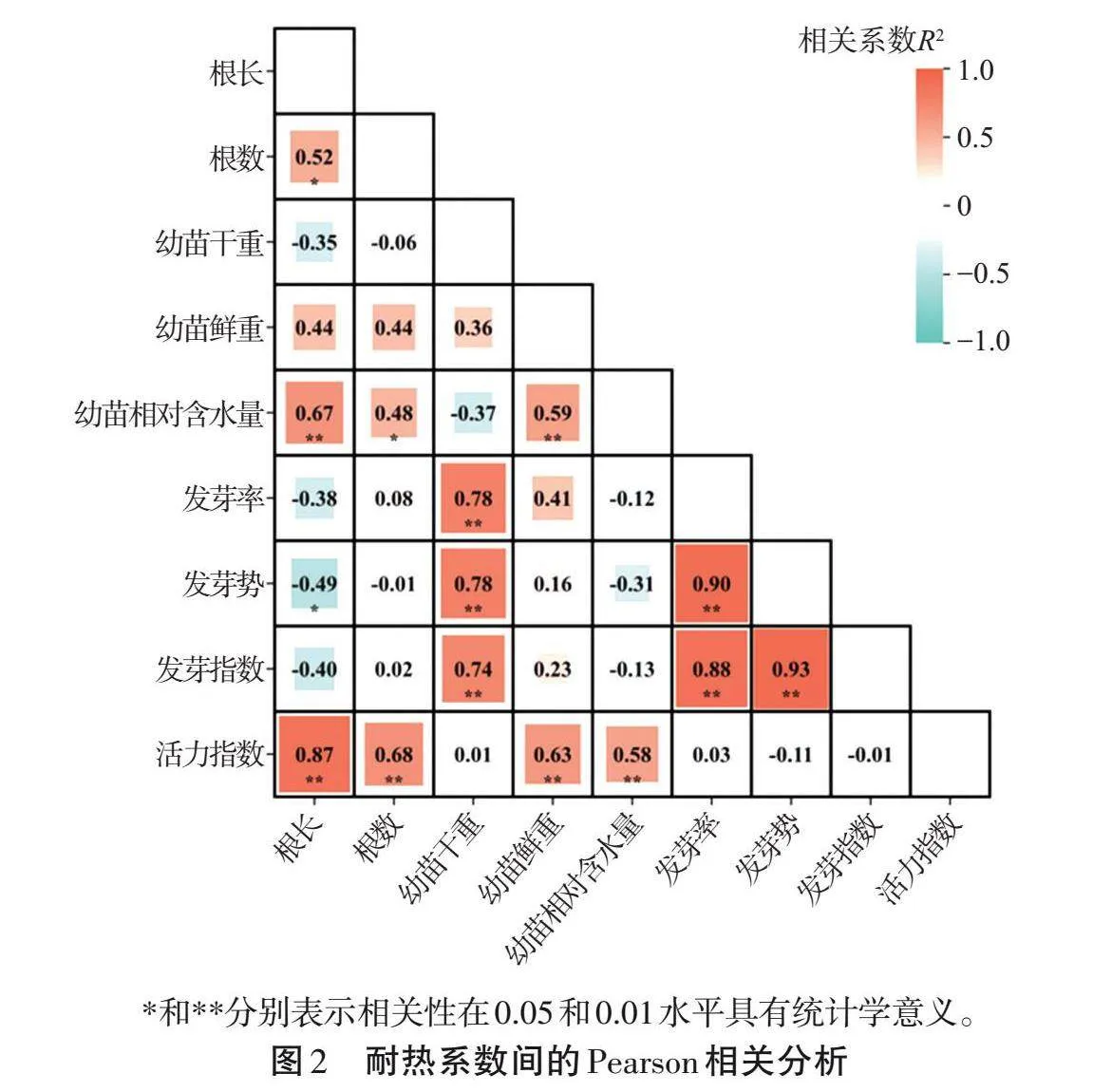
對萌發期的10個指標進行相關性分析,結果表明,發芽勢與發芽指數、發芽率呈正相關(Plt;0.01),相關系數分別為0.93和0.90,活力指數與根長呈正相關(Plt;0.01),相關系數為0.87(圖2)。相關系數較高意味著變量間存在信息的冗余現象,因此,在后續的多元回歸分析中,為了減少變量間的干擾,移除發芽勢、發芽指數和活力指數這3個變量。以D值為因變量,剩余7個指標為自變量進行逐步回歸分析,并建立最優D值的線性回歸模型:D=-0.903+0.611×發芽率+0.311×芽長+0.09×根數+0.441×幼苗干重+0.367×幼苗相對含水量(R2=0.97,Durbin-Watson=2.525,Plt;0.01,VIFlt;5)。該模型擬合度高(R2=0.97,接近1,Plt;0.01),各變量間不存在多重共線性(VIFlt;5),且誤差項間不存在序列相關(Durbin-Watson接近中值2),符合建模前提,該模型有效且有價值。從模型系數來看,發芽率和幼苗干重對高溫脅迫反應較為敏感,可作為耐熱性鑒定的重要指標,其值越高,D值越高,表明稻種耐熱性能越強。
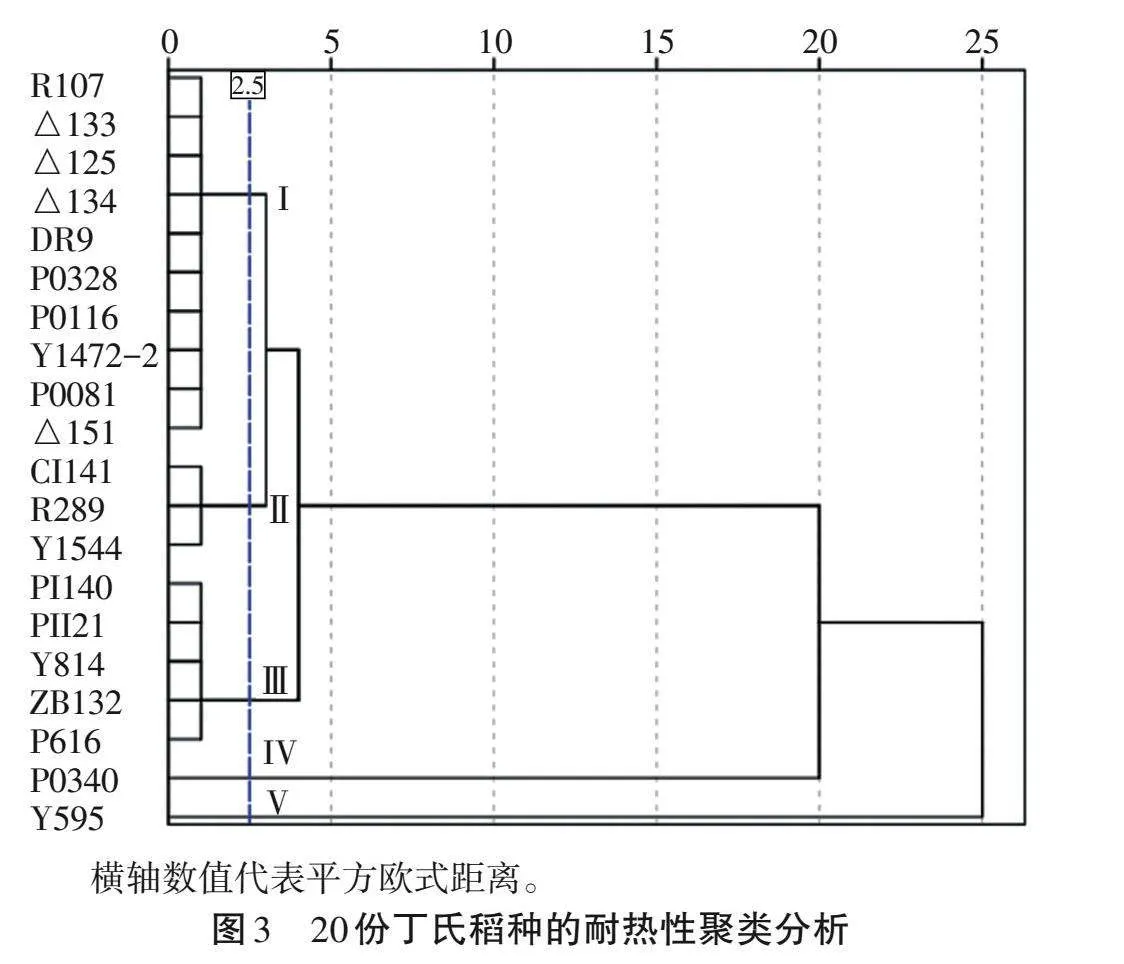
2.4 參試稻種耐熱能力的聚類分析
聚類分析可將20份稻種耐熱性劃分為極強、強、中等、弱和極弱5類(圖3)。第Ⅰ類群為耐熱性中等品種,包括R107、Δ133、Δ125、Δ134、DR9、P0328、P0116、Y1472-2、P0081和Δ151,共10個,占比50%;第Ⅱ類群為耐熱性強品種,為CII141、R289和Y1544,占比15%;第Ⅲ類群為耐熱性弱品種,包括PII140、PII21、Y814、ZB132和P616,共5個,占比25%;第Ⅳ類群為耐熱性極強品種,為P0340;第Ⅴ類群為耐熱性極弱品種,為Y595。
橫軸數值代表平方歐式距離。
2.5 高溫脅迫對水稻生理指標的影響
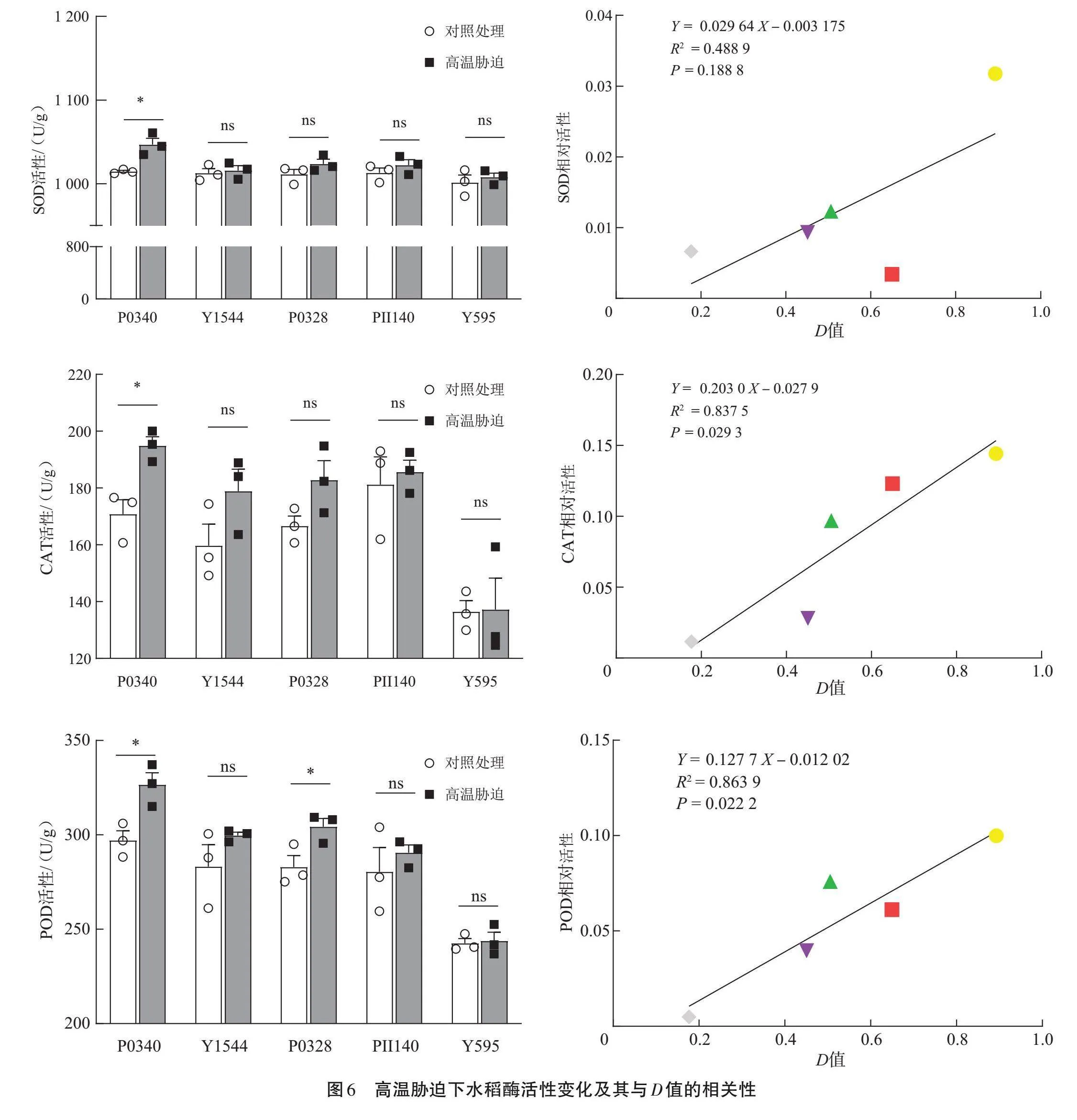
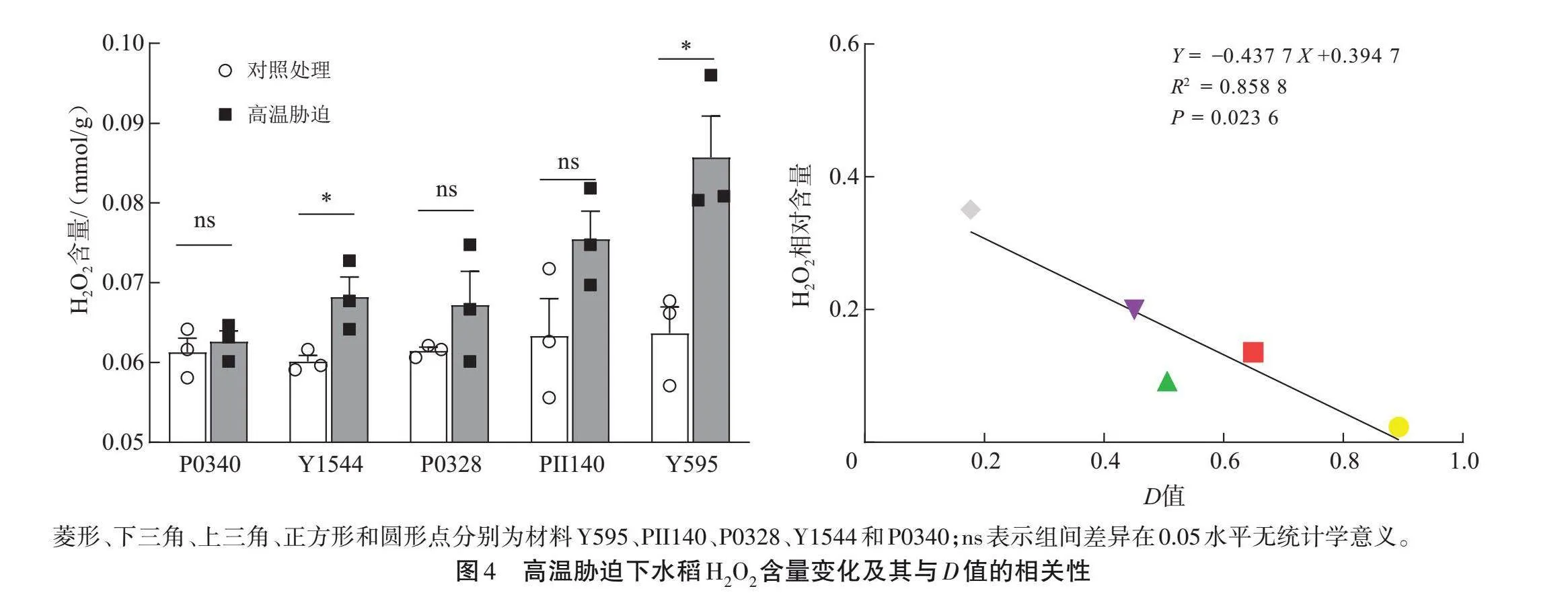
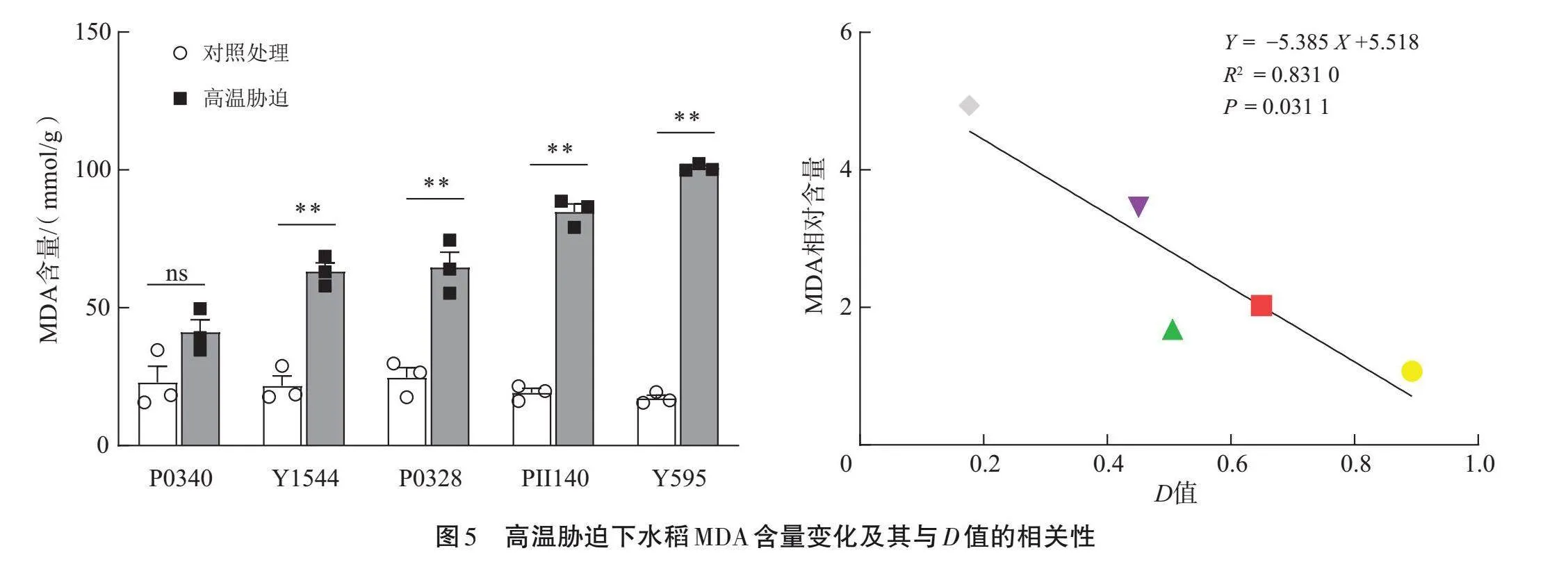
挑選P0340(極強)、Y1544(強)、P0328(中等)、PII140(弱)和Y595(極弱)5個稻種,測定H2O2和MDA含量,SOD、CAT和POD活性(圖4~5)。Y595幼苗的H2O2和MDA含量較對照顯著增加(Plt;0.05),而P0340幼苗的H2O2和MDA含量與對照組間的差異無統計學意義(Pgt;0.05);相關分析發現,H2O2和MDA相對含量與D值之間呈顯著負相關(Plt;0.05),相關系數R2分別為0.858 8和0.831 0。說明不同耐熱性稻種的H2O2和MDA含量存在差異,耐熱性強的稻種在高溫脅迫下MDA和H2O2含量變化較小。
SOD、CAT和POD的活性變化顯示(圖6),P0340幼苗的SOD、CAT和POD活性在高溫處理后顯著增加,而其他稻種的增加幅度不明顯;相關分析發現,各稻種的SOD、CAT和POD相對活性與D值呈正相關,其中POD和CAT相對活性與D值之間的相關性差異存在統計學意義(Plt;0.05)。說明耐熱性較強的稻種在高溫脅迫下CAT和POD活性增幅較大。
菱形、下三角、上三角、正方形和圓形點分別為材料Y595、PII140、P0328、Y1544和P0340;ns表示組間差異在0.05水平無統計學意義。
3 結論與討論
丁氏稻種資源豐富,其蘊含優良的抗逆基因,為水稻育種和種質創新提供了寶貴的物質材料[11]。本研究利用20份丁氏核心稻種,在其種子萌發期進行了高溫脅迫處理,發現品種間對高溫脅迫的響應存在明顯差異。采用綜合指標評價水稻耐熱性的方法,相較于單一指標評估,更能全面、準確地反映水稻的耐熱潛力,有效避免了評估的局限性。Zhang等[18]采用隸屬函數法對114份稻種進行耐鹽性篩選,得出耐鹽性較強的稻種日光。李其勇等[20]研究表明,分級評價法和隸屬函數法在稻種芽期耐旱性分析中展現出良好的鑒定能力。Yao等[21]基于該方法對6個水稻品種灌漿期的耐高溫性進行綜合評價,發現稻種黃華占耐熱能力最好。本研究利用隸屬函數法和分級評價法,對20份丁氏稻種進行耐熱性評價,發現兩種方法的評價結果高度一致,相互驗證了P0340稻種在耐熱性方面的優異表現。同時,本研究還構建了D值回歸方程:D=-0.903+0.611×發芽率+0.311×芽長+0.09×根數+0.441×幼苗干重+0.367×幼苗相對含水量,發現發芽率和幼苗干重在高溫脅迫下表現出極高的敏感性,即發芽率越高、幼苗干重越大,稻種的耐熱綜合評分值也相應越高。這2個指標不僅能夠反映種子的萌發狀態,還能有效反映稻種在萌發期的有效物質積累情況,為快速篩選和初步評估耐熱性稻種提供參考。
持續的高溫脅迫會導致活性氧(Reactive oxygen species,ROS)在細胞內過量積累,從而打破ROS穩態,引發氧化損傷,使水稻表現出生長遲緩、稻米白化及幼苗死亡等現象[22]。Zhao等[23]研究表明,高溫脅迫會損害抗氧化酶活性,尤其是SOD和CAT,其在植物體內具有清除ROS、維持細胞穩態等作用。本研究發現,在高溫脅迫下,候選稻種P0340的SOD、CAT和POD活性相較于對照顯著升高,且增長幅度較為顯著,表明稻種P0340在遭遇高溫脅迫時,可通過增強這些抗氧化酶的活性,提升其耐熱性。過量的ROS積累會進一步加劇膜脂過氧化和蛋白質氧化,損害生物膜的結構和功能,并導致過氧化物含量的增加。Bahuguna等[24]研究表明,稻種NERICA-L-44在高溫脅迫下具有較高的抗氧化酶活性和較低的過氧化物含量,在水稻營養和生殖階段表現出突出的耐熱能力,可作為耐熱性育種的新材料。本研究發現,候選稻種P0340在高溫脅迫下,其MDA和H?O?的含量在脅迫處理前后并未發生顯著變化,而稻種Y595的MDA和H?O?含量在高溫脅迫下顯著增加,說明稻種P0340在幼苗期表現出較好的耐熱能力。本研究不僅證實了稻種P0340在高溫脅迫下的耐熱性,還進一步驗證了利用耐熱綜合評價值D值來鑒定稻種萌發期耐熱能力的可靠性。
綜上,本研究利用綜合評價方法對20 份丁氏稻種資源進行耐熱性評價,通過耐熱綜合評價篩選出耐熱性強的水稻品種P0340,并通過活性氧含量和抗氧化能力分析進一步驗證了其耐熱能力。在后續的研究中,還需要進一步考證P0340在大田中的具體表現。此外,P0340可作為候選耐熱品種,與耐熱性極弱品種Y595進行雜交,構建F2代分離群體,從而對耐熱品種中攜帶的耐熱基因進行初步定位。另外,還可以將P0340與當前主導稻種進行回交,實現對主導稻種耐熱性的遺傳改良,培育新型耐熱稻種。
參考文獻
[1] ZHAO C,LIU B,PIAO S L,et al. Temperature increase reduces global yields of major crops in four independent estimates[J]. Proceedings of the National Academy of Sciences of the United States of America,2017,114(35):9326-9331.
[2] FAHAD S,BAJWA A A,NAZIR U,et al. Crop production under drought and heat stress:plant responses and management options[J]. Frontiers in plant science,2017,8:1147.
[3] LIU J,HASANUZZAMAN M,WEN H L,et al. High temperature and drought stress cause abscisic acid and reactive oxygen species accumulation and suppress seed germination growth in rice[J]. Protoplasma,2019,256(5):1217-1227.
[4] LIU J P,SUN X J,XU F Y,et al. Suppression of OsMDHAR4 enhances heat tolerance by mediating H2O2-induced stomatal closure in rice plants[J]. Rice,2018,11(1):38.
[5] LIU J P,ZHANG C C,WEI C C,et al. The RING finger ubiquitin E3 ligase OsHTAS enhances heat tolerance by promoting H2O2-induced stomatal closure in rice[J]. Plant physiology,2015,170(1):429-443.
[6] KILASI N L,SINGH J,VALLEJOS C E,et al. Heat stress tolerance in rice (Oryza sativa L.):identification of quantitative trait loci and candidate genes for seedling growth under heat stress[J]. Frontiers in plant science,2018,9:1578.
[7] WEI H,LIU J P,WANG Y,et al. A dominant major locus in chromosome 9 of rice (Oryza sativa L.) confers tolerance to 48 ℃ high temperature at seedling stage.[J].The journal of heredity,2013,104(2):287-94.
[8] 劉進,崔迪,余麗琴,等. 水稻苗期耐熱種質資源篩選及QTL定位[J]. 中國水稻科學,2022,36(3):259-268.
[9] 季平,劉經威,王欣婷,等. 不同水稻品種苗期葉片生理特性對高溫脅迫的響應[J]. 西北農林科技大學學報(自然科學版),2024,52(1):36-48.
[10] 葉嬋娟,陳可,周新橋,等. 4個秈稻品種苗期耐熱性評價及分子機理分析[J]. 華南農業大學學報,2023,44(6):906-914.
[11] 陳志雄,王蘭,吳錦文,等. 丁氏稻種資源有利基因挖掘與創新研究進展[J]. 華南農業大學學報,2023,44(5):649-658.
[12] SONG J Y,LI J Q,SUN J,et al. Genome-wide association mapping for cold tolerance in a core collection of rice (Oryza sativa L.) landraces by using high-density single nucleotide polymorphism markers from specific-locus amplified fragment sequencing[J]. Frontiers in plant science,2018,9:875.
[13] ZHANG P,ZHONG K Z,ZHONG Z Z,et al. Mining candidate gene for rice aluminum tolerance through genome wide association study and transcriptomic analysis[J]. BMC plant biology,2019,19(1):490.
[14] ZHONG K Z,XIE L H,HU S K,et al. Genome-wide association study of zinc toxicity tolerance within a rice core collection (Oryza sativa L.)[J]. Plants,2022,11(22):3138.
[15] GHOURI F,SHAHID M J,LIU J W,et al. Polyploidy and zinc oxide nanoparticles alleviated Cd toxicity in rice by modulating oxidative stress and expression levels of sucrose and metal-transporter genes[J]. Journal of hazardous materials,2023,448:130991.
[16] WANG Z F,WANG J F,BAO Y M,et al. Quantitative trait loci analysis for rice seed vigor during the germination stage[J]. Journal of Zhejiang university Science B,2010,11(12):958-964.
[17] 張娟偉,石亞飛,路旭平,等. 種子萌發期粳稻種質資源耐旱性綜合評價[J]. 核農學報,2022,36(11):2093-2103.
[18] ZHANG R,HUSSAIN S,WANG Y,et al. Comprehensive evaluation of salt tolerance in rice (Oryza sativa L.) germplasm at the germination stage[J]. Agronomy,2021,11(8):1569.
[19] 戴海芳,武輝,阿曼古麗·買買提阿力,等. 不同基因型棉花苗期耐鹽性分析及其鑒定指標篩選[J]. 中國農業科學,2014,47(7):1290-1300.
[20] 李其勇,朱從樺,李星月,等. 水稻芽期抗旱性綜合評價及鑒定指標鑒選[J]. 西北農業學報,2023,32(1):18-32.
[21] YAO D P,WU J,LUO Q H,et al. Comprehensive evaluation of high temperature tolerance of six rice varieties during grain-filling period based on key starch physicochemical indexes[J]. LWT,2021,148:111804.
[22] XU Y F,CHU C C,YAO S G. The impact of high-temperature stress on rice:challenges and solutions[J]. The crop journal,2021,9(5):963-976.
[23] ZHAO Q,ZHOU L J,LIU J C,et al. Involvement of CAT in the detoxification of HT-induced ROS burst in rice anther and its relation to pollen fertility[J]. Plant cell reports,2018,37(5):741-757.
[24] BAHUGUNA R N,JHA J,PAL M,et al. Physiological and biochemical characterization of NERICA-L-44:a novel source of heat tolerance at the vegetative and reproductive stages in rice[J]. Physiologia plantarum,2015,154(4):543-559.
(責任編輯:胡立萍)

