間充質干細胞條件培養基激活Nrf2/ARE通路對抗H2O2致H9c2細胞的氧化應激損傷*
董 曦,孫桂波,羅 云,陳素紅,孫曉波
(1中國醫學科學院北京協和醫學院藥用植物研究所,北京100193;2溫州醫科大學藥學院,浙江溫州325035)
?
間充質干細胞條件培養基激活Nrf2/ARE通路對抗H2O2致H9c2細胞的氧化應激損傷*
董曦1,2,孫桂波1△,羅云1,陳素紅2,孫曉波1△
(1中國醫學科學院北京協和醫學院藥用植物研究所,北京100193;2溫州醫科大學藥學院,浙江溫州325035)
[摘要]目的:探討間充質干細胞(MSC)條件培養基(MSCCM)對氧化應激損傷的心肌細胞的保護作用及機制。方法:用流式細胞術對MSC進行鑒定,再用MTT實驗確定MSCCM對抗H2O2氧化應激損傷的最佳孵育時間。將H9c2細胞分為正常組、模型組、模型+ MSCCM組和MSCCM組。模型+ MSCCM組和MSCCM組均用MSCCM進行預孵育24 h,模型組和模型+ MSCCM組用濃度為300 μmol/L的H2O2作用4 h模擬心肌細胞的氧化應激損傷。利用流式細胞術檢測損傷后心肌細胞的線粒體膜電位變化、凋亡比率等指標,通過熒光顯微鏡檢測細胞ROS產生的變化,Western blot檢測Nrf2/ARE通路的相關蛋白表達。結果: MSCCM組心肌細胞的線粒體膜電位、凋亡比率和ROS產生與正常組相比均無顯著差異(P>0.05) ;模型+ MSCCM組的線粒體膜電位、凋亡比例和ROS產生與模型組相比差異顯著(P<0.01) ;在0 h到24 h這段時間內,心肌細胞Nrf2/ARE通路中的Nrf2核轉位與HO-1表達均隨著MSCCM孵育時間延長而增加。結論: MSCCM可以保護心肌細胞,對抗H2O2誘導的氧化應激損傷,其機制可能與激活Nrf2/ARE通路有關。
[關鍵詞]間充質干細胞;條件培養基;心肌細胞;氧化應激
[修回日期]2015-03-25
MSC-conditioned medium activates Nrf2/ARE pathway to protect H9c2 cells against oxidative stress
DONG Xi1,2,SUN Gui-bo1,LUO Yun1,CHEN Su-hong2,SUN Xiao-bo1
(1Institute of Medicinal Plant Development,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100193,China;2School of Pharmaceutical Sciences,Wenzhou Medical University,Wenzhou 325035,China.E-mail: sunguibo@126.com; sun-xiaobo@163.com)
[ABSTRACT]AIM: To investigate the protective effect of mesenchymal stem cell (MSC) -conditioned medium (MSCCM) on myocardial cell line H9c2 and its mechanism.METHODS: Verification of MSC was performed by flow cytometry analysis,followed by MTT assay to determine the optimal incubation time of MSCCM with myocardial cells.The cells were divided into 4 groups: normal (N) group,model (M) group,M+ MSCCM group and MSCCM group.The cells in M+ MSCCM group and MSCCM group were pre-incubated with MSCCM for 24 h.The cells in M group and M+ MSCCM group were treated with 300 μmol/L H2O2for 4 h to imitate oxidative injury of myocardial cells.Mitochondrial membrane potential and apoptotic rate of injured myocardial cells were detected by flow cytometry.The ROS production was measured by fluorescence microscopy.The nuclear translocation of Nrf2 and expression of HO-1 was examined by Western blot.RESULTS: No difference of mitochondrial membrane potential,apoptotic rate or ROS production between MSCCM group and N group was observed (P>0.05).The mitochondrial membrane potential depolarization,apoptotic rate and ROS production in M+ MSCCM group were significantly lower than those in M group (P<0.01).The nuclear translocation of Nrf2 and expression of HO-1 in the myocardial cells were increased with MSCCM incubation time prolonged.CONCLUSION: MSCCM protects the myocardial cells against oxidative injury induced by H2O2.The anti-oxidative mechanism would be associated with the activation of Nrf2/ARE pathway.
[KEY WORDS]Mesenchymal stem cells; Conditioned medium; Myocardial cells; Oxidative stress
缺血性心臟病是指由于冠狀循環改變引起的冠狀動脈血流與心肌需求之間不平衡而導致的心肌損傷,又稱為冠狀動脈粥樣硬化性心臟病。缺血性心臟病的基本治療原則是恢復血流再灌,但當心肌缺血經過一定時期后,即使恢復血流再灌,心肌損傷反有加重,人們稱這種現象為心肌缺血/再灌注損傷(ischemia/reperfusion,I/R)[1]。在缺血階段,心臟的血液及養分供給不足,導致心肌細胞的凋亡及壞死。而當血液再灌注至缺血部位,由于氧供給的突然增加,缺血部位會產生過量的活性氧簇(reactive oxygen species,ROS),造成該部位的氧化損傷以及心肌細胞死亡[2]。有研究表明,再灌注過程中產生的過量ROS會導致心肌細胞死亡及心臟功能異常[3]。
間充質干細胞(mesenchymal stem cells,MSC)具有組織再生、修復以及旺盛的分泌能力,有關MSC的研究已經開展至臨床階段。更有研究指出MSC對心絞痛及心肌梗死等缺血性心臟病有著顯著的治療作用[4-5]。目前研究主要集中在MSC對心臟病的改善,而有證據表明MSC所分泌的因子是發揮修復作用的重要部分[6-7]。MSC條件培養基(MSC-conditioned medium,MSCCM)是指與MSC共孵育一段時間的培養基,MSC條件培養基內含有MSC分泌的各種因子,并被證實對氧化應激造成的損傷有治療作用[8]。
Nrf2/ARE是細胞抵抗氧化、化學等刺激的防御性轉導通路,并在缺血性心臟病中起著重要的治療作用[9]。在Nrf2/ARE通路中,活化的Nrf2轉錄因子可以促進細胞Ⅱ相解毒酶、抗氧化酶等的轉錄,清除過量的ROS,保持細胞內氧化還原狀態的平衡,并減輕ROS對細胞的損傷[10]。由于Nrf2通路具有突出的抗氧化作用,以及細胞氧化損傷是缺血性心臟病中重要的致病機制,許多文章都在研究Nrf2通路對于缺血性心臟病中細胞損傷的治療作用。這些研究結果表明,Nrf2通路可以緩解心肌細胞由于缺血再灌注產生的氧化損傷[11],降低氧化應激損傷誘導的心肌細胞凋亡[12],在心肌梗死中保護心肌細胞[13]。
然而,關于MSCCM對心肌細胞的抗氧化保護作用,以及MSCCM對Nrf2/ARE通路的調控的研究還比較少。因此,本研究將通過H2O2誘導的H9c2心肌細胞損傷模型,來探索MSCCM對心肌細胞氧化應激損傷的保護作用以及其對Nrf2/ARE通路的影響,以期了解MSCCM的作用機制并對臨床做出指導。
材料和方法
1實驗材料
DMEM培養基購自Gibco; MTT和胰酶購自Amresco; FBS購自四季青公司; ROS檢測試劑及凋亡檢測試劑購自Invitrogen; JC-1試劑購自ENZO; DMSO購自Sigma;流式抗體CD29、CD73、CD45和CD34購自BD; Western blot I抗Nrf2、HO-1、β-actin和lamin B購自Santa Cruz; Western blot相關II抗購自中杉金橋公司。
2間充質干細胞條件培養基制備
機械法分離人臍帶間充質干細胞,無菌條件下分離華通氏膠,剪碎后培養于含10% FBS血清的DMEM培養基中,2周后MSC從華通氏膠中爬出并貼壁,待細胞生長至80%融合時,消化并傳代。當細胞生長至3~4代,并80%融合時,向細胞培養皿中加入新鮮無血清培養基,然后收集孵育12 h、24 h和36 h的間充質干細胞條件培養基。
3實驗方法
3.1流式細胞術檢測間充質干細胞表型取培養至第3代的MSC,300×g離心5 min,棄上清,PBS洗2遍。用100 μL PBS重懸,加入5 μL熒光標記抗體,室溫避光孵育20 min,加入1 mL PBS,300×g離心5 min,然后用500 μL PBS重懸,用流式細胞儀檢測。
3.2 MTT法檢測細胞存活率取第3代的MSC,重懸至1×108/L,鋪在96孔平底板中,每孔200 μL。將實驗組分為5組,正常組內加入新鮮無血清DMEM培養基,0 h、12 h、24 h、36 h組分別加入新鮮無血清DMEM培養基(即模型組)、12 h間充質干細胞條件培養基、24 h間充質干細胞條件培養基、36 h間充質干細胞條件培養基后與H9c2細胞共孵育24 h。然后向0 h、12 h、24 h、36 h組加入無血清培養基配制的300 μmol/L H2O2并孵育4 h。孵育結束后,吸棄間充質干細胞條件培養基,并加入200 μL(1 g/L) MTT,孵育4 h。然后加入200 μL DMSO,混勻后在570 nm波長下測定吸光度。細胞存活率(%)=(實驗組光吸收值/對照組光吸收值)×100%。
3.3流式細胞術檢測線粒體膜電位及凋亡取培養至第3代的MSC,重懸至1×108/L,鋪在6孔平底板中,每孔2 mL。實驗組分為正常(normal,N)組、模型(model,M)組、M+ MSCCM組和MSCCM組。用步驟3.2中確定的最佳時點的MSCCM與M+ MSCCM組及MSCCM組的H9c2細胞共孵育24 h,用300 μmol/L H2O2溶液對模型組與M+ MSCCM組造模,其它2組換成新鮮無血清DMEM。4 h后消化細胞,用無血清DMEM配制的2 μmol/L JC-1探針與各組H9c2細胞于37℃下避光孵育15 min,再用PBS 洗2次,然后用500 μL PBS重懸細胞,流式細胞儀檢測;利用Annexin V/PI雙染法檢測細胞凋亡,先用試劑盒內的200 μL binding buffer重懸各組細胞,再用5 μL FITC標記的Annexin V工作液與1 μL PI工作液共同孵育細胞懸液15 min,然后用流式細胞儀檢測。
3.4熒光顯微鏡檢測細胞內活性氧自由基水平
按照步驟3.3中的方法處理細胞,然后向培養板中加入用無血清DMEM配制的25 μmol/L的ROS探針,與各組H9c2細胞于37℃下避光孵育30 min,再用PBS洗2次。用熒光顯微鏡進行觀察拍照。之后用Image-Pro Plus進行分析。
3.5 Western blot檢測細胞內蛋白表達按照步驟3.3中的方法處理各組細胞,用PBS洗滌細胞1次并消化,400×g 10 min離心細胞,并加入細胞裂解液400 μL重懸,于4℃裂解1 h。800×g 15 min離心,收集上清液,BCA法測定蛋白濃度。每組取20 μg的總蛋白,12% SDS-PAGE分離蛋白,用電轉移法將蛋白質轉移至PVDF膜,5%脫脂奶粉室溫封閉3 h,分別加入兔抗小鼠Nrf2、HO-1、β-actin和lamin B I 抗(均為1∶200稀釋),4℃孵育過夜; TBST溶液洗滌3次,每次15 min,加入辣根素過氧化酶標記的羊抗鼠II抗,室溫孵育4 h,TBST溶液洗膜3次,每次15 min,以增強化學發光法顯色、曝光,定量測定各條帶密度,以β-actin進行校正。
4統計學處理
所有實驗均重復3次,數據采用SPSS 17.0統計軟件進行分析,計量資料先進行正態性檢驗,正態分布資料采用單因素方差分析,非正態分布資料轉成正態分布后再采用單因素方差分析;計數資料采用非參數秩和檢驗,以P<0.05為差異有統計學意義。
結果
1 MSC的鑒定
間充質干細胞經過分離并培養至第3代,經鑒定其CD29和CD73表達為陽性,CD34和CD45表達為陰性,符合MSC特征,見圖1。
2 MSCCM對H2O2誘導的H9c2細胞損傷的保護作用
MTT結果顯示,孵育24 h的MSCCM對H2O2損傷的H9c2細胞有較好的保護作用,其與0 h相比有統計學意義(P<0.01) ; 36 h的MSCCM也對H9c2細胞具有保護作用(P<0.05) ;而其它時點的MSCCM對H2O2損傷的H9c2細胞無明顯作用(P>0.05),見圖1。
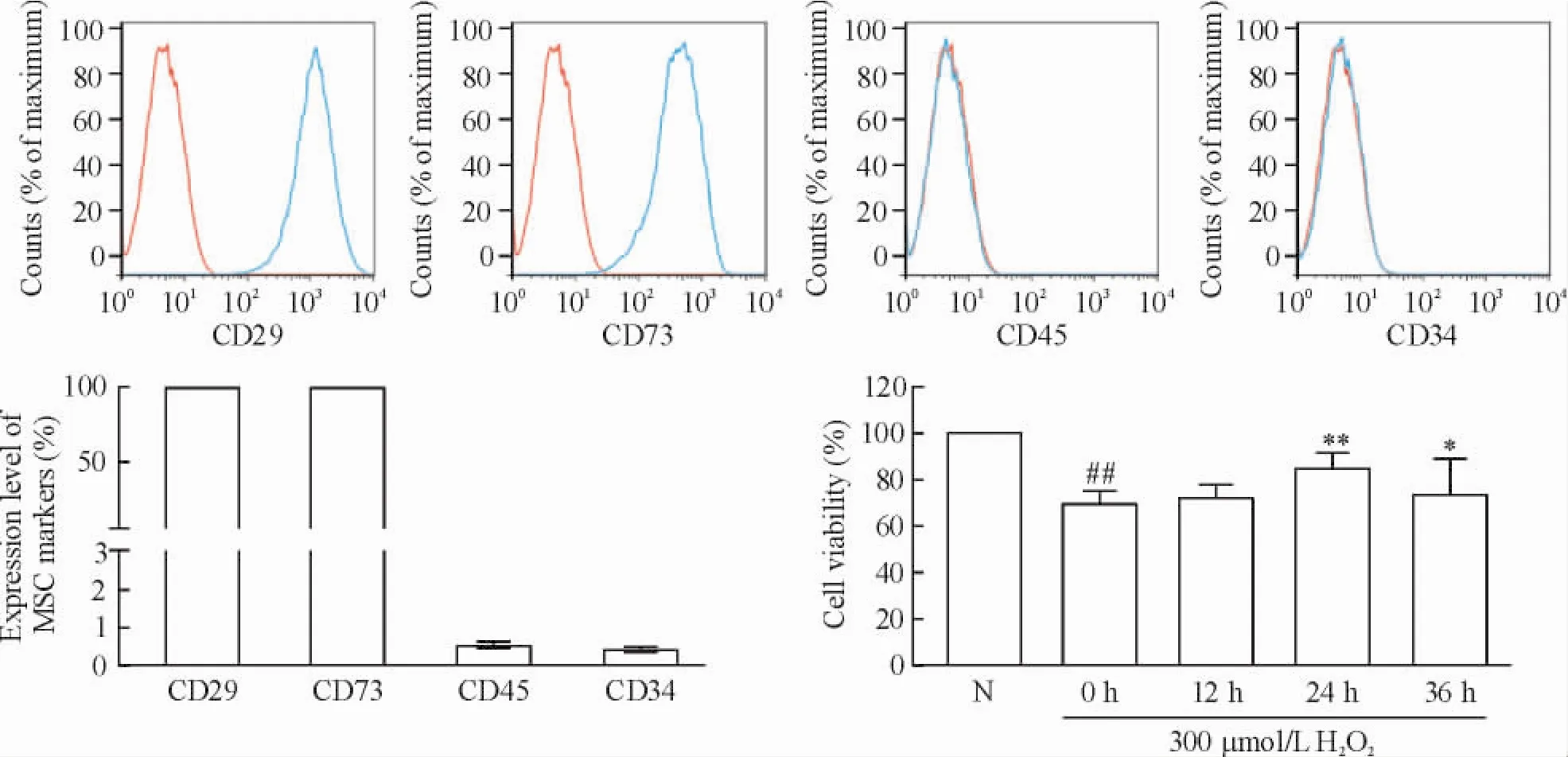
Figure 1.Identification of MSC and protective effect of MSCCM on oxidatively injured H9c2 cells.Mean±SD.n=3.##P<0.01 vs N group;*P<0.05,**P<0.01 vs 0 h group.圖1 MSC的鑒定與MSCCM保護受氧化損傷的H9c2細胞
3 MSCCM對H2O2誘導的H9c2細胞內線粒體膜電位及活性氧自由基水平變化的作用
本研究利用紅綠熒光的比例來表示線粒體膜電位(mitochondrial membrane potential,MMP)去極化的程度。與模型組相比,MSCCM可顯著緩解H9c2細胞的MMP去極化,M+ MSCCM組的紅綠熒光比值較模型組顯著升高(P<0.01),MSCCM組與正常組無顯著差異(P>0.05)。本研究又利用熒光顯微鏡觀察了MSC條件培養基對H2O2誘導H9c2細胞ROS產生的影響。熒光照片結果表明,與模型組相比,M+ MSCCM組的ROS產生顯著下降(P<0.01),而MSCCM組與正常組無顯著差異(P>0.05)。因此,孵育24 h的MSCCM對于H2O2誘導H9c2細胞的ROS產生和MMP去極化都有抑制作用,見圖2。
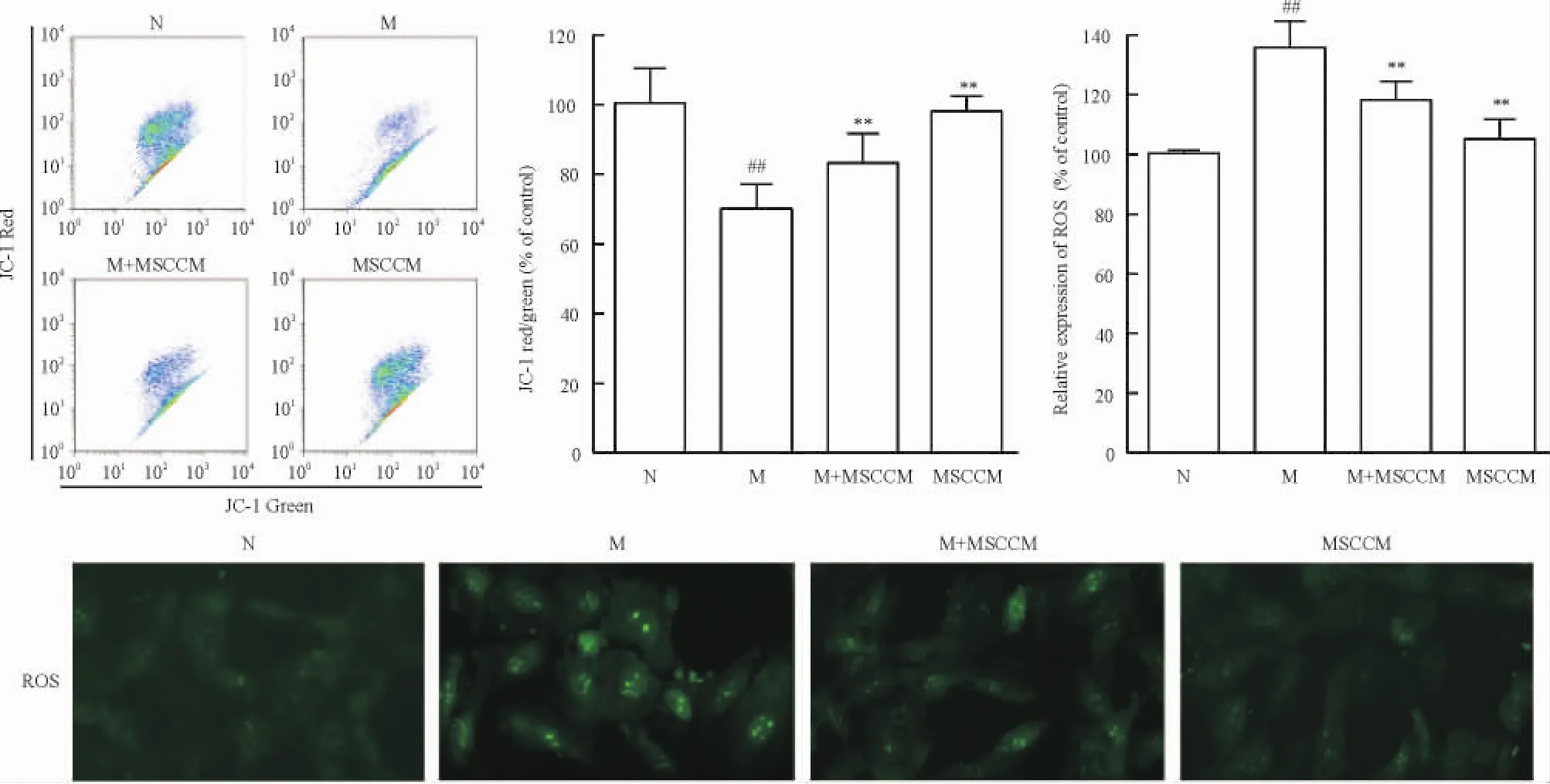
Figure 2.Protective effect of MSCCM on depolarization of MMP and ROS production in oxidatively injured H9c2 cells.Mean±SD.n=3.##P<0.01 vs N group;**P<0.01 vs M group.圖2 MSCCM對氧化損傷的H9c2細胞的線粒體膜電位去極化與ROS產生的影響
4 MSCCM對H2O2誘導的H9c2細胞凋亡的影響
與模型組相比,M+ MSCCM組的凋亡比例顯著降低(P<0.01)。而與正常組相比,MSCCM組細胞凋亡水平沒有顯著差異(P>0.05),見圖3。
5 MSCCM對H9c2細胞抗氧化通路蛋白表達的影響
根據Western blot的結果可知,24 h的MSCCM孵育H9c2細胞不同時間,從4 h到24 h,MSC條件培養基逐漸增加Nrf2的核轉位以及抗氧化酶HO-1的表達,見圖4。這表明MSCCM對H9c2細胞的保護至少部分是通過Nrf2/ARE通路來發揮作用的。
討論
在臨床上,缺血再灌注是心肌常見的損傷形式。盡管缺血再灌注的病理生理機制還未被完全闡明,氧化損傷被認為是啟動缺血再灌注損傷的重要因素。許多前臨床研究都指出,抑制ROS的生成可以有效地緩解缺血再灌注損傷[14]。我們的研究表明,MSCCM處理24 h可以保護H9c2細胞,對抗H2O2造成的氧化應激損傷。而其它時點沒有改善效果。這可能是由于MSC條件培養基內有效因子還未至起效濃度,或有害物質積累的原因。
氧化應激損傷所造成的嚴重影響之一是造成線粒體膜滲透性轉換孔(mitochondrial permeability transition pore,mPTP)的開放。mPTP位于線粒體膜上,其開放程度的改變會引起線粒體膜通透性的改變。當線粒體受到氧化應激損傷后,mPTP開放,引起線粒體膜電位去極化、細胞色素C釋放、caspase家族活化及細胞凋亡[15]。線粒體膜電位產生于呼吸氧化過程中,呼吸產生的能量以電化學勢能儲存于線粒體內膜,在內膜兩側造成質子及其它離子濃度的不對稱分布形成了線粒體膜電位。我們的實驗結果表明,MSCCM能夠顯著降低H9c2細胞線粒體膜電位去極化水平。在氧化應激情況下,ROS會攻擊心肌細胞內的生物分子,引起線粒體及細胞核損傷、脂質過氧化等,最終導致突變、蛋白變性。而線粒體損傷又是缺血再灌注后ROS上升的重要原因[16]。MSCCM能夠降低M+ MSCCM組的ROS產生,這些結果表明MSCCM可以對抗H2O2的氧化應激損傷,保護心肌細胞線粒體,減少線粒體因損傷而釋放的ROS。
細胞凋亡是引起心肌細胞死亡的另一重要機制,同時也是細胞線粒體損傷的后續事件。細胞凋亡是指為維持內環境穩定,由基因控制的細胞程序性死亡。細胞凋亡與細胞壞死不同,細胞凋亡不是一個被動的過程,而是主動過程,它涉及一系列基因的激活、表達以及調控等的作用。長期以來,人們普遍認為壞死是心肌細胞死亡的唯一方式,而后續研究則認為凋亡也是心肌細胞死亡的重要原因[17]。在臨床上,冠狀動脈介入是缺血性心臟病的重要診療手段。然而,在冠狀動脈介入術后,會發生缺血再灌注損傷,出現一過性低血壓、再灌注心律失常、心功能不全、心源性休克甚至是猝死。心肌細胞凋亡則被認為是這些缺血再灌注損傷的重要原因[18]。本研究用Annexin V/PI雙染法分析MSCCM對氧化損傷的H9c2細胞的保護作用,結果表明,MSCCM可以緩解心肌細胞的凋亡。這與MSCCM對線粒體的保護作用一起表明,MSCCM可以抑制因氧化應激而造成的依賴于線粒體的細胞凋亡,展現出治療缺血性心臟病的潛在能力。
MSCCM可激活MAPK及PI3K/Akt通路達到保護作用[19],本研究則嘗試根據MSCCM的抗氧化作用來探索它對Nrf2/ARE通路的影響。Nrf2/ARE通路是抗氧化的重要通路,Nrf2與Keap1以無活性的2聚體形式存在于細胞漿內,當受到外界氧化、化學刺激后,Nrf2與Keap1分離,轉位進入細胞核。在細胞核內Nrf2與Maf、抗氧化反應元件(antioxidant response element,ARE)結合并調控抗氧化酶的表達[16,20]。由Western blot的結果可知,隨著時間的推移,MSCCM可以促進Nrf2的核轉位以及其所調控的抗氧化酶HO-1的表達。這表明MSCCM可以活化Nrf2/ARE通路,并增加其下游抗氧化酶的表達。
綜上所述,本研究表明MSCCM可以保護心肌細胞,對抗心肌細胞的氧化應激損傷。目前,有大量的研究工作都集中在MSC對疾病的治療及組織的修復上,并發展到臨床階段。盡管關于MSCCM的研究已經逐漸走入科研工作者的視線,并在各領域都有所涉及。然而MSCCM對于心肌細胞的保護作用還鮮有研究,本結果提示這些條件培養基可能在臨床上具有潛在的治療價值。由于MSC具有旺盛的分泌能力,目前已知的MSC分泌因子已達數十種。相信除抗氧化外,MSCCM還具有其它的功能,對其妥善的應用也許可以使MSC的用途更加廣泛。
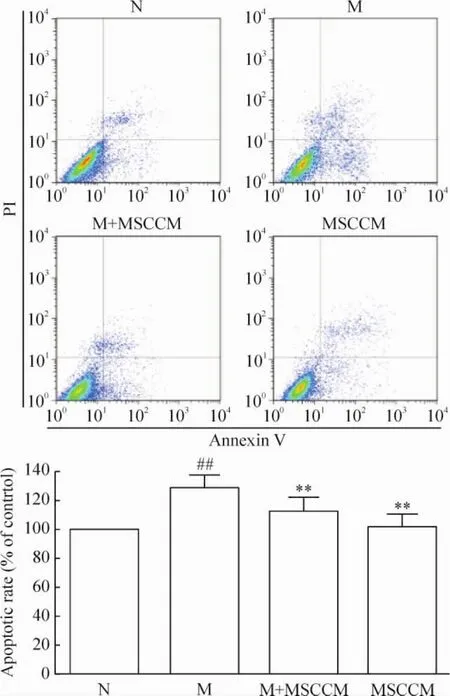
Figure 3.Protective effect of MSCCM on apoptotic rate of oxidatively injured H9c2 cells.Mean±SD.n=3.##P<0.01 vs N group;**P<0.01 vs M group.圖3 MSCCM對氧化損傷的H9c2細胞凋亡的影響
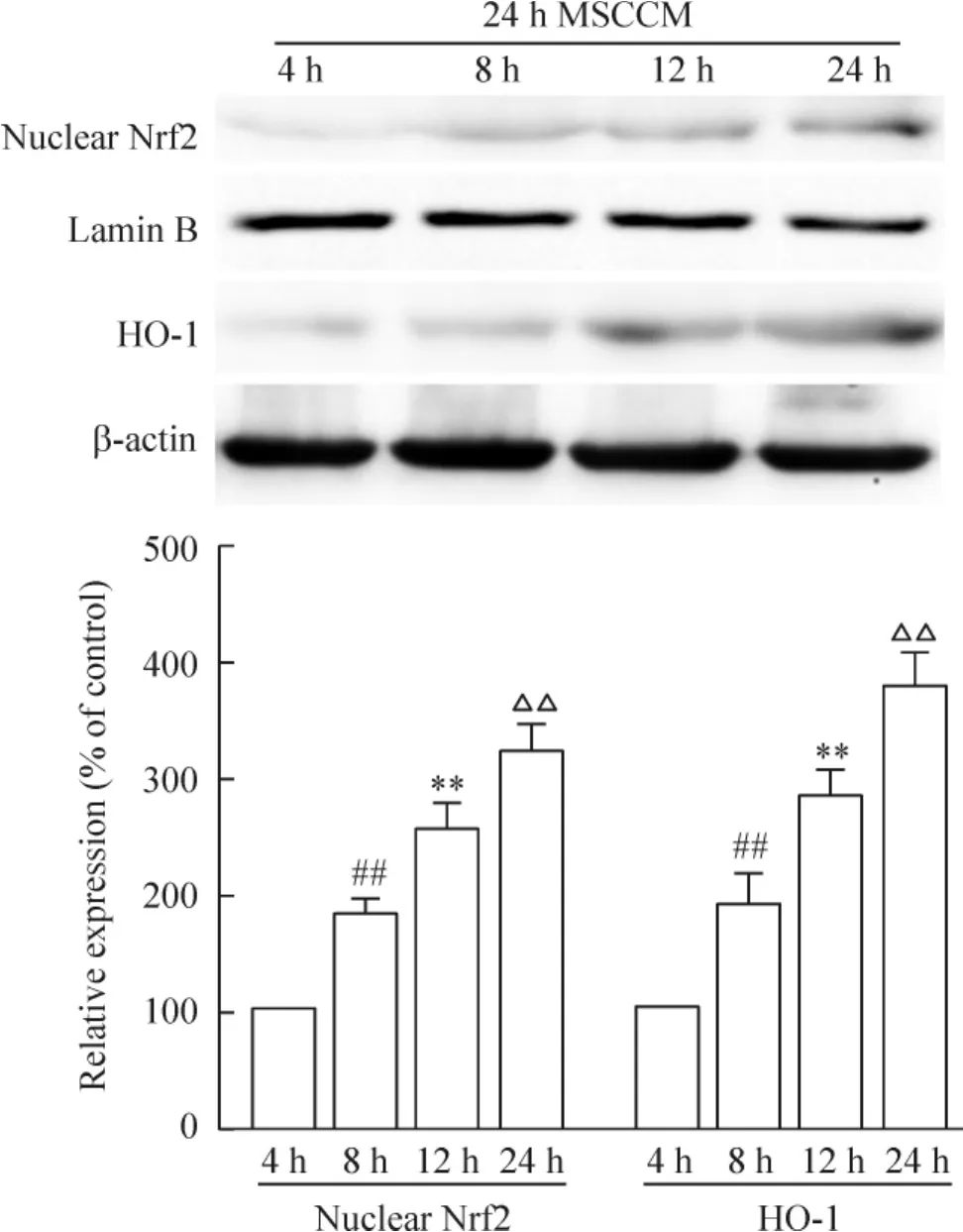
Figure 4.The effect of MSCCM on anti-oxidative signal pathway of H9c2 cells.Mean±SD.n=3.##P<0.01 vs 4 h group;**P<0.01 vs 8 h group;△△P<0.01 vs 12 h group.圖4 MSCCM對氧化損傷H9c2細胞抗氧化信號通路的影響
[參考文獻]
[1]譚元生,譚超,鄧圣明.中藥防治心肌缺血/再灌注損傷分子機理研究進展[J].中國中醫藥信息雜志,2004,11(2) :174-178.
[2]Frangogiannis NG,Smith CW,Entman ML.The inflammatory response in myocardial infarction[J].Cardiovasc Res,2002,53(1) :31-47.
[3]Circu ML,Aw TY.Reactive oxygen species,cellular redox systems,and apoptosis[J].Free Radic Biol Med,2010,48(6) :749-762.
[4]Dayan V,Yannarelli G,Billia F,et al.Mesenchymal stromal cells mediate a switch to alternatively activated monocytes/macrophages after acute myocardial infarction [J].Basic Res Cardiol,2011,106(6) :1299-1310.
[5]鄭黎鸝,孫雯,解慧琪,等.載銅微泡促進間充質干細胞歸巢至慢性心梗組織的研究[J].中國病理生理雜志,2012,28(11) : 2087.
[6]Kupcova Skalnikova H.Proteomic techniques for characterisation of mesenchymal stem cell secretome[J].Biochimie,2013,95(12) :2196-2211.
[7]莫世靜,童秀珍,鐘茜,等.骨髓間充質干細胞通過上調EPO表達減輕缺氧損傷引起的PC12細胞凋亡[J].中國病理生理雜志,2013,29(1) : 62-69.
[8]Liu L,Cao JX,Sun B,et al.Mesenchymal stem cells inhibition of chronic ethanol-induced oxidative damage via upregulation of phosphatidylinositol-3-kinase/Akt and modulation of extracellular signal-regulated kinase 1/2 activation in PC12 cells and neurons[J].Neuroscience,2010,167(4) :1115-1124.
[9]Bozaykut P,Karademir B,Yazgan B,et al.Effects of vitamin E on peroxisome proliferator-activated receptor gamma and nuclear factor-erythroid 2-related factor 2 in hypercholesterolemia-induced atherosclerosis[J].Free Radic Biol Med,2014,70:174-181.
[10]Alfieri A,Srivastava S,Siow RC,et al.Targeting the Nrf2-Keap1 antioxidant defence pathway for neurovascular protection in stroke[J].J Physiol,2011,589(Pt 17) : 4125-4136.
[11]Li W,Wu M,Tang L,et al.Novel curcumin analogue 14p protects against myocardial ischemia reperfusion injury through Nrf2-activating anti-oxidative activity[J].Toxicol Appl Pharmacol,2015,282(2) : 175-183.
[12]趙增光,劉應才.異鼠李素的心血管保護作用[J].醫學綜述,2008,14(15) : 2321-2323.
[13]Mitra A,Ray A,Datta R,et al.Cardioprotective role of P38 MAPK during myocardial infarction via parallel activation of alpha-crystallin B and Nrf2[J].J Cell Physiol,2014,229(9) :1272-1282.
[14]Xu B,Zhang J,Strom J,et al.Myocardial ischemic reperfusion induces de novo Nrf2 protein translation[J].Biochim Biophys Acta,2014,1842(9) : 1638-1647.
[15]Cai Q,Wei J,Zhao W,et al.Toxicity of Evodiae fructus on rat liver mitochondria: the role of oxidative stress and mitochondrial permeability transition[J].Molecules,2014,19(12) : 21168-21182.
[16]Ide T,Tsutsui H,Hayashidani S,et al.Mitochondrial DNA damage and dysfunction associated with oxidative stress in failing hearts after myocardial infarction[J].Circ Res,2001,88(5) :529-535.
[17]黃展勤,石剛剛.細胞凋亡與缺血性心臟病[J].汕頭大學醫學院學報,2001,14(2) :148-150.
[18]Wang Y,Zhang H,Chai F,et al.The effects of escitalopram on myocardial apoptosis and the expression of Bax and Bcl-2 during myocardial ischemia/reperfusion in a model of rats with depression[J].BMC Psychiatry,2014,14:349.
[19]Isele NB,Lee HS,Landshamer S,et al.Bone marrow stromal cells mediate protection through stimulation of PI3-K/Akt and MAPK signaling in neurons[J].Neurochem Int,2007,50(1) :243-250.
[20]劉江月.梓醇對糖尿病大鼠主動脈的保護作用與抗氧化機制研究[J].中國病理生理雜志,2014,30(6) : 1023-1028.
通訊作者△孫桂波Tel: 010-57833220; E-mail: sunguibo@126.com;孫曉波Tel: 010-57833013; E-mail: sun-xiaobo@163.com
*[基金項目]國家重大新藥創制項目(No.2012ZX09501001004; No.2012ZX09301002-001)
[收稿日期]2015-02-09
[文章編號]1000-4718(2015)06-0961-06
[中圖分類號]R363.2
[文獻標志碼]A
doi:10.3969/j.issn.1000-4718.2015.06.001

