氧化低密度脂蛋白通過CD36介導的氧化應激誘導巨噬細胞自噬*
姚樹桐,李嚴嚴,劉慶華,岳 峰,田 華,桑 慧,楊娜娜,秦樹存△(泰山醫學院動脈粥樣硬化研究所,山東省高校動脈粥樣硬化重點實驗室,基礎醫學院,附屬醫院檢驗科,泰安市中心醫院內分泌科,山東泰安7000)
?
氧化低密度脂蛋白通過CD36介導的氧化應激誘導巨噬細胞自噬*
姚樹桐1,2△▲,李嚴嚴1▲,劉慶華3,岳峰4,田華1,桑慧2,楊娜娜1,秦樹存1△
(泰山醫學院1動脈粥樣硬化研究所,山東省高校動脈粥樣硬化重點實驗室,2基礎醫學院,3附屬醫院檢驗科,4泰安市中心醫院內分泌科,山東泰安271000)
[摘要]目的:研究氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)對巨噬細胞自噬的誘導作用,并探討可能的分子機制。方法:體外培養RAW264.7巨噬細胞,給予抗CD36單克隆抗體(2 mg/L)、二亞苯基碘鎓(diphenyleneiodonium,DPI;5 μmol/L)、3-甲基腺嘌呤(3-methyladenine,3-MA; 3 mmol/L)或雷帕霉素(1 μmol/L)預處理1 h,再加入ox-LDL(100 mg/L)繼續培養12 h。采用MTT法檢測細胞活力,采用相應試劑盒測定培養液乳酸脫氫酶(lactic dehydrogenase,LDH)、細胞內煙酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶、超氧化物歧化酶(superoxide dismutase,SOD)活性以及活性氧簇(reactive oxygen species,ROS)和丙二醛(malondialdehyde,MDA)水平,以評價細胞膜完整性和氧化應激反應。采用免疫印跡技術檢測自噬標志分子beclin-1和微管相關蛋白1輕鏈3-II(microtubule-associated protein 1 light chain 3-II,LC3-II)表達變化。結果: ox-LDL誘導巨噬細胞自噬反應,表現為beclin-1和LC3-II上調;與自噬抑制劑3-MA相似,抗CD36單抗可顯著抑制ox-LDL所誘導的LC3-II和beclin-1表達。抗CD36單抗明顯抑制ox-LDL所誘導的氧化應激,包括抑制NADPH氧化酶活性和ROS、MDA水平以及升高SOD活性,其作用與NADPH氧化酶抑制劑DPI相似。另外,DPI顯著抑制ox-LDL所誘導的beclin-1和LC3-II表達,且ox-LDL所誘導的細胞活力降低和LDH漏出可被3-MA促進并可被自噬誘導劑雷帕霉素拮抗。結論: ox-LDL可誘導巨噬細胞自噬,其機制可能與CD36介導ox-LDL攝取進而觸發的氧化應激有關,且一定程度的自噬可減輕ox-LDL所誘導的巨噬細胞損傷。
[關鍵詞]自噬;氧化低密度脂蛋白; CD36;氧化應激;巨噬細胞
[修回日期]2015-03-03
▲并列第1作者
Oxidized low-density lipoprotein induces autophagy in macrophages via CD36-mediated oxidative stress
YAO Shu-tong1,2,LI Yan-yan1,LIU Qing-hua3,YUE Feng4,TIAN Hua1,SANG Hui2,YANG Na-na1,QIN Shu-cun1
(1Institute of Atherosclerosis,Key Laboratory of Atherosclerosis in Universities of Shandong,2College of Basic Medical Sciences,3Department of Clinical Laboratory,Affiliated Hospital,Taishan Medical University,4Department of Endocrinology,The Central Hospital of Taian,Taian 271000,China.E-mail: yst228@126.com; shucunqin@ hotmail.com)
[ABSTRACT]AIM: To investigate the effect of oxidized low-density lipoprotein (ox-LDL) on autophagy in macrophages and the underlying molecular mechanisms.METHODS: RAW264.7 macrophages were pretreated with 2 mg/L anti-CD36 monoclonal antibody (anti-CD36 mAb),5 μmol/L diphenyleneiodonium (DPI),3 mmol/L 3-methyladenine (3-MA) or 1 μmol/L rapamycin for 1 h and then treated with ox-LDL (100 mg/L) for 12 h.The viability of the cells was measured by MTT assay.The activities of lactic dehydrogenase (LDH) in the medium and nicotinamide adenine dinucleotide phosphate (NADPH) oxidase,superoxide dismutase (SOD) in the cells as well as the levels of intracellular reactive oxygen species (ROS) and malondialdehyde (MDA) were determined to characterize the membrane integrity and the oxidative stress,respectively.The protein levels of beclin-1 and microtubule-associated protein 1 light chain 3-II (LC3-II),2 important molecular markers of autophagy,were examined by Western blotting.RESULTS: ox-LDL induced autophagy inRAW264.7 macrophages as assessed by upregulation of beclin-1 and LC3-II.Similar to 3-MA,an autophagy inhibitor,anti-CD36 mAb significantly inhibited the ox-LDL-induced upregulation of beclin-1 and LC3-II.Anti-CD36 mAb suppressed the ox-LDL-induced oxidative stress as revealed by decreased NADPH oxidase activation,ROS and MDA generation as well as increased SOD activity.Similar results were observed in the cells pretreated with DPI,a NADPH oxidase inhibitor.Moreover,DPI significantly inhibited the ox-LDL-induced upregulation of beclin-1 and LC3-II.Inaddition,the decrease in the cell viability and increase in LDH release induced by ox-LDL were promoted by 3-MA and blocked by rapamycin (an autophagy inducer).CONCLUSION: ox-LDL induces autophagy in RAW264.7 macrophages,which may be involved in CD36-mediated ox-LDL uptake and subsequent activation of oxidative stress,and moderate activation of autophagy may protect macrophages from ox-LDL-induced injury.
[KEY WORDS]Autophagy; Oxidized low-density lipoprotein; CD36; Oxidative stress; Macrophage
動脈粥樣硬化(atherosclerosis,AS)作為心腦血管疾病的主要病理基礎,是一個復雜的多細胞參與的慢性炎癥性病理過程,其中修飾后的脂蛋白尤其是氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)所誘導的巨噬源性泡沫細胞形成和死亡是AS發展的核心環節和造成斑塊不穩定的決定性因素,進而導致急性心血管事件的發生,因此巨噬細胞已成為減緩AS進展尤其是降低心腦血管病事件發生率的重要治療靶點[1]。自噬是細胞將受損、變性的蛋白質以及損傷細胞器運輸到溶酶體進行消化降解,以胞質內出現自噬體為特征的細胞自我消化過程,是細胞在應激情況下用來維持細胞內環境穩定和存活的一種重要防御機制[2]。近年來研究表明,AS斑塊中存在巨噬細胞自噬[3],且自噬的激活可減輕AS病變,增強斑塊的穩定性[4],但其機制尚未完全闡明。CD36是介導ox-LDL大量攝取進而導致泡沫細胞形成的主要清道夫受體,本課題組既往研究證實,CD36可介導ox-LDL所誘導的巨噬細胞內質網應激反應[5],而槲皮素可通過下調CD36表達減輕ox-LDL所誘導的巨噬細胞脂質蓄積和氧化應激反應[6],但是ox-LDL是否通過CD36觸發巨噬細胞自噬尚不清楚。本工作以ox-LDL與鼠源RAW264.7巨噬細胞共同孵育,研究細胞內自噬關鍵分子beclin-1和標志分子微管相關蛋白1輕鏈3-II (microtubule-associated protein 1 light chain 3-II,LC3-II)表達變化及CD36和氧化應激在其中的作用,以探討ox-LDL對巨噬細胞自噬的誘導作用及機制。
材料和方法
1材料與試劑
ox-LDL購自北京協生生物科技有限公司; DMEM高糖培養基和胎牛血清為Gibco產品;2’,7’-二氯熒光素二乙酸酯(2’,7’-dichlorofluorescein diacetate,DCHF-DA)和抗CD36單克隆抗體(anti-CD36 mAb)分別購自Molecular Probes和Abcam; RIPA裂解液和BCA蛋白定量試劑盒為Solarbio產品;兔抗beclin-1和LC3多克隆抗體購自Santa Cruz;雷帕霉素、3-甲基腺嘌呤(3-methyladenine,3-MA)、二亞苯基碘鎓(diphenyleneiodonium,DPI)和兔抗β-actin抗體購自Sigma;辣根過氧化物酶標記山羊抗兔IgG為北京中杉金橋公司產品;四甲基偶氮唑藍[3-(4,5-dimeth-ylthiazol-2-y-l ) -2,5- diphenyl-2H-tetrazolium bromide,MTT]購自Genview;增強化學發光(enhanced chemiluminescence,ECL)試劑盒和PVDF膜分別為Pierce和Millipore產品;煙酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶測定試劑盒從上海杰美科技公司購買;乳酸脫氫酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)測定試劑盒購于南京建成生物技術公司;其余試劑均為分析純。
2方法
2.1細胞培養與實驗分組鼠源RAW264.7巨噬細胞購自中國科學院上海生物化學與細胞生物學研究所細胞庫,用含10%胎牛血清、1×105U/L青霉素和100 mg/L鏈霉素的DMEM高糖培養基在37℃、5% CO2的培養箱中培養。處理前換無血清DMEM培養基同步化12 h,然后隨機分為如下6組: (1)正常對照(control)組:培養液中常規培養; (2) ox-LDL 組:培養液中加入100 mg/L ox-LDL; (3)抗CD36單抗阻斷(anti-CD36 mAb+ ox-LDL)組:培養液中先加入2 mg/L anti-CD36 mAb預處理1 h,再加入100 mg/L ox-LDL; (4) NADPH氧化酶抑制劑DPI預處理(DPI+ ox-LDL)組:培養液中先加入5 μmol/L DPI預處理1 h,再加入100 mg/L ox-LDL; (5)自噬抑制劑3-MA預處理(3-MA+ ox-LDL)組:培養液中先加入3 mmol/L 3-MA預處理1 h,再加入100 mg/L ox-LDL; (6)自噬誘導劑雷帕霉素預處理(rapamycin+ ox-LDL)組:培養液中先加入1 μmol/L rapamycin預處理1 h,再加入100 mg/L ox-LDL。各組培養12 h后收集細胞。
2.2細胞活力和LDH測定將細胞接種于96孔板,細胞經處理后,按既往報道的MTT分析方法[7]檢測細胞活力。以正常對照組細胞活力為100%,其余各組細胞活力以其吸光度(A)值占對照組A值的百分比表示。
為進一步檢測細胞損傷程度,按照LDH活性檢測試劑盒說明書測定培養基中LDH水平。
2.3活性氧簇(reactive oxygen species,ROS)水平的測定細胞培養于6孔板中,處理后的細胞用PBS洗滌2次,加入用無血清DMEM培養基稀釋的終濃度為10 μmol/L的DCHF-DA,細胞培養箱中避光孵育30 min。收集洗滌細胞,并用PBS重懸,在流式細胞儀(Becton-Dickinson)上檢測細胞平均熒光強度。
2.4細胞內SOD活性和MDA含量的測定細胞經處理后,收集細胞,并重懸于0.5 mL裂解緩沖液中,用電動細胞破碎機裂解,1 500 r/min離心10 min,收集上清,根據試劑盒說明書檢測SOD活性和MDA含量,分別以1×103U/g蛋白和μmol/g蛋白表示。
2.5 NADPH氧化酶活性測定應用光澤精增強化學發光法測定細胞內NADPH氧化酶活性,具體方法依據試劑盒說明書操作。
2.6 Western blotting分析細胞用RIPA裂解緩沖液在冰浴中裂解并提取總蛋白,BCA法測定蛋白濃度。熱變性后,等量的各組總蛋白進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離(8%~10%分離膠),然后電轉印移到PVDF膜。室溫下5%脫脂奶粉封閉2 h后,I抗孵育4℃過夜。洗膜后,用辣根過氧化物酶標記的相應II抗室溫下孵育2 h。蛋白條帶通過ECL反應顯示,應用Chemi Q4800 mini型化學發光成像系統(上海歐翔科學儀器有限公司)進行圖像采集。采用Image-Pro Plus軟件分析蛋白條帶積分吸光度(integrated absorbance,IA)值,以靶蛋白IA值與β-actin IA值的比值反映靶蛋白相對表達水平。
3統計學處理
結果用均數±標準差(mean±SD)表示。用SPSS 13.0統計軟件進行單因素方差分析,組間兩兩比較應用SNK-q檢驗,以P<0.05為差異有統計學意義。
結果
1抗CD36單抗抑制ox-LDL所誘導的RAW264.7巨噬細胞自噬
Beclin-1是自噬啟動的關鍵分子;自噬發生后,LC3-I經泛素樣加工修飾形成LC3-II,進而整合到自噬體膜中,在自噬體形成中起重要作用,因此beclin-1和LC3-II可作為自噬的標志分子。以ox-LDL處理RAW264.7細胞12 h,LC3-II和beclin-1水平較對照組顯著增加(P<0.01),說明ox-LDL可誘導巨噬細胞自噬;與自噬抑制劑3-MA相似,抗CD36單抗阻滯清道夫受體CD36后,可顯著抑制ox-LDL所誘導的LC3-II和beclin-1表達(P<0.05),表明抗CD36抗體可抑制ox-LDL所誘導的巨噬細胞自噬,見圖1。
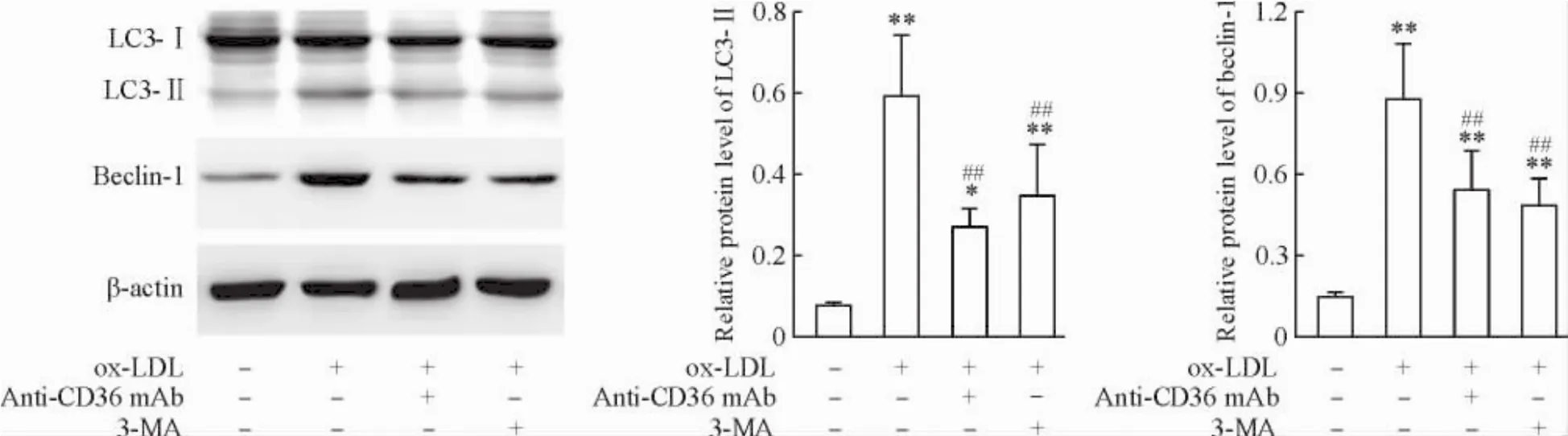
Figure 1.Anti-CD36 mAb inhibited ox-LDL-induced autophagy in RAW264.7 macrophages.Mean±SD.n=4.*P<0.05,**P<0.01 vs control group;##P<0.01 vs ox-LDL group.圖1抗CD36單抗抑制ox-LDL所誘導的RAW264.7巨噬細胞自噬
2抗CD36單抗抑制ox-LDL誘導的氧化應激反應
如圖2所示,ox-LDL組細胞內ROS和MDA水平較對照組均明顯升高,而SOD活性顯著降低(P<0.01) ;而與氧化應激抑制劑DPI相似,抗CD36單抗可抑制ox-LDL所誘導的氧化應激反應,表現為ROS 和MDA含量降低(P<0.05),SOD活性增加(P<0.05)。
3抗CD36單抗抑制ox-LDL所誘導的NADPH氧化酶活化
NADPH氧化酶是血管系統催化ROS生成導致氧化應激的主要酶。與NADPH氧化酶抑制劑DPI相似,抗CD36單抗可抑制ox-LDL所誘導的NADPH氧化酶活性上調,其活性較ox-LDL組降低21.7% (P<0.05)。以上結果表明,CD36介導ox-LDL所誘導巨噬細胞氧化應激和自噬反應,見圖3。
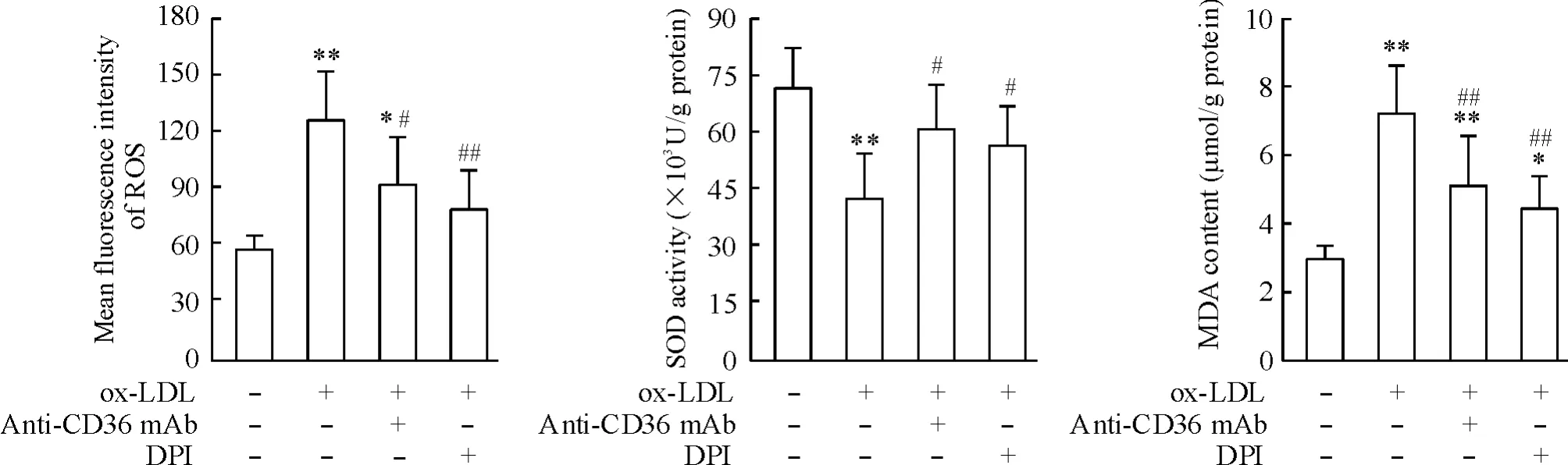
Figure 2.Inhibitory effects of anti-CD36 mAb on ox-LDL-induced oxidative stress in RAW264.7 macrophages.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs ox-LDL group.圖2抗CD36單抗抑制ox-LDL所誘導的氧化應激反應
4 DPI抑制ox-LDL所誘導的巨噬細胞自噬
為進一步證明氧化應激在ox-LDL所誘導的自噬反應中的作用,我們研究了DPI對ox-LDL所致自噬反應的影響。結果顯示,與ox-LDL組比較,DPI預處理組LC3-II和beclin-1蛋白水平分別降低了37.2%和40.0% (P<0.05),見圖4。
5 ox-LDL誘導細胞毒性的作用可被3-MA促進而被雷帕霉素拮抗
為了證明自噬在ox-LDL所致細胞損傷中的作用,研究了自噬抑制劑3-MA和自噬誘導劑雷帕霉素對ox-LDL所致細胞毒性的影響。如圖5所示,3-MA促進了ox-LDL所誘導的細胞損傷,表現為細胞活力降低和LDH漏出進一步加重(P<0.05) ;而雷帕霉素則可拮抗ox-LDL所誘導的細胞損傷,使細胞活力增加和LDH漏出減少(P<0.05),表明自噬可減輕ox-LDL所誘導的細胞損傷。
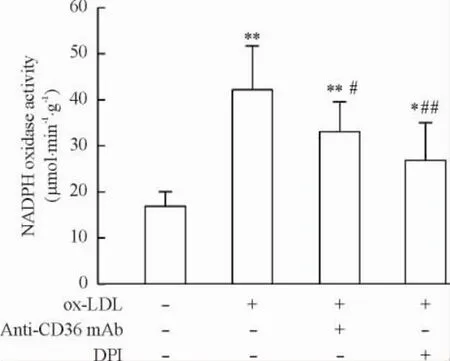
Figure 3.Anti-CD36 mAb inhibited ox-LDL-induced NADPH oxidase activation in RAW264.7 macrophages.Mean ±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs ox-LDL group.圖3抗CD36單抗抑制ox-LDL所誘導的NADPH氧化酶活化
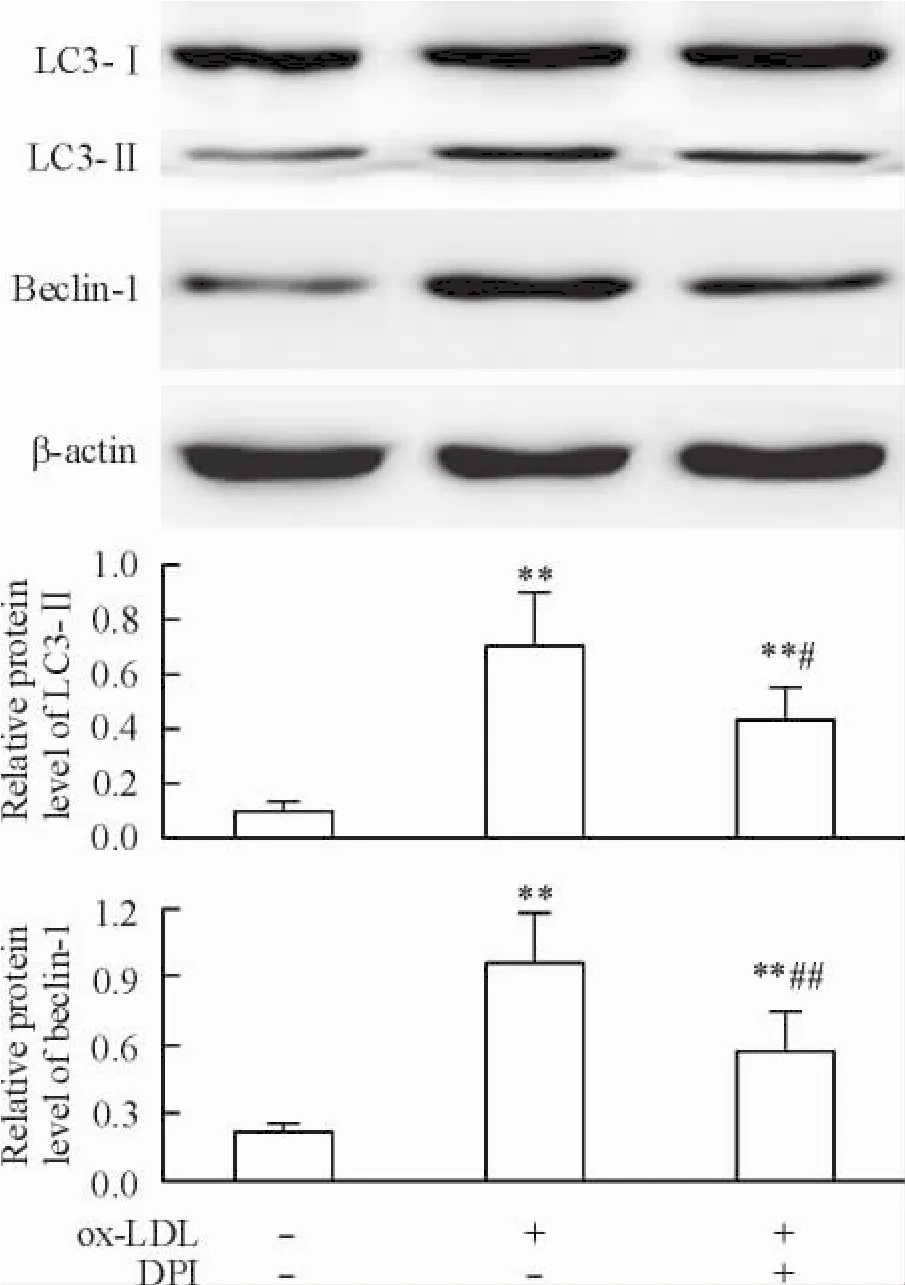
Figure 4.DPI inhibited ox-LDL-induced autophagy in RAW264.7 macrophages.Mean±SD.n=4.**P<0.01 vs control group;#P<0.05,##P<0.01 vs ox-LDL group.圖4 DPI抑制ox-LDL所誘導的巨噬細胞自噬
討論
自噬是一種細胞將受損蛋白和細胞器以溶酶體依賴性降解方式再利用的過程,該過程以包繞胞漿成分的具有雙層膜結構的小囊泡,即自噬體為主要特征,是維持細胞穩態、適應各種環境變化的重要機制。在饑餓、氧化應激、缺血等應激情況下,通過III型磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase,PI3K)/beclin-1途徑的激活啟動自噬,而該啟動過程受哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信號通路的負性調控。大約30多個自噬相關基因(autophagy-associated gene,ATG)參與了自噬的啟動及進展,其中ATG8,即LC3與磷脂酰乙醇胺(phosphatidyl-ethanolamine,PE)結合轉變成LC3-Ⅱ并與ATG5-ATG12-ATG16L整合于自噬體膜中,在自噬體的形成中起關鍵作用;進而自噬體與溶酶體融合形成自噬溶酶體,在溶酶體水解酶的作用下將需要降解的物質分解為各種營養物質供機體再利用[2]。近年來研究表明,自噬參與AS時細胞死亡和存活的調控。在AS斑塊中存在血管細胞自噬樣特性:髓鞘樣結構、細胞質中泛素化包涵體聚集以及空泡形成增多[8]。來自血管內皮和平滑肌細胞的研究表明,ox-LDL及其主要氧化成分7-酮膽甾醇(7-ketocholesterol,7-KC)均可誘導自噬[9-10],且在AS斑塊中存在巨噬細胞自噬現象[3-4]。本實驗結果顯示,RAW264.7巨噬細胞經ox-LDL處理12 h后,beclin-1和LC3-II水平均顯著上調,表明ox-LDL可誘導巨噬細胞自噬反應。
CD36是巨噬細胞表面主要識別、攝取ox-LDL 的B類清道夫受體,其結合和攝取的ox-LDL占巨噬細胞結合和攝取修飾脂質的50%以上,且不受細胞內膽固醇負反饋調節,造成大量脂質蓄積而導致泡沫細胞形成[11],然而抑制CD36表達則可減緩AS進展[12]。本課題組既往采用抗CD36單抗和基因沉默技術阻滯CD36功能,可顯著抑制ox-LDL所誘導的巨噬細胞內脂質蓄積,并減輕內質網應激反應[5,13],表明CD36在ox-LDL所觸發的巨噬細胞一系列生物學效應中具有重要作用。本實驗結果顯示,應用單克隆抗體阻斷CD36所介導的ox-LDL攝入可顯著減輕自噬反應,表現為beclin-1和LC3-II上調均受到明顯抑制。
氧化應激被認為是AS發病的一個關鍵機制[14]。來自血管平滑肌細胞的研究表明,抗氧化劑N-乙酰半胱氨酸和夾竹桃麻素可減輕7-KC對LC3-II的上調作用[10],提示氧化應激可能介導自噬的發生。ox-LDL誘導的氧化應激主要來自NADPH氧化酶衍生的ROS的生成過度和抗氧化酶活性的降低[15]。本實驗結果顯示,巨噬細胞經ox-LDL處理后,NADPH氧化酶活性增加,SOD活性下降,ROS和脂質過氧化產物MDA生成顯著增加。然而,與NADPH氧化酶抑制劑DPI相似,抗CD36單抗可拮抗上述變化,提示CD36介導的ox-LDL攝取可觸發巨噬細胞氧化應激反應。為了進一步證明CD36介導的氧化應激在巨噬細胞自噬激活中的作用,本實驗又探討了DPI對ox-LDL所致自噬反應的影響。結果顯示,DPI可顯著抑制ox-LDL所誘導的beclin-1 和LC3-II上調。以上結果表明,CD36介導的ox-LDL攝取可觸發氧化應激進而導致巨噬細胞自噬的發生。
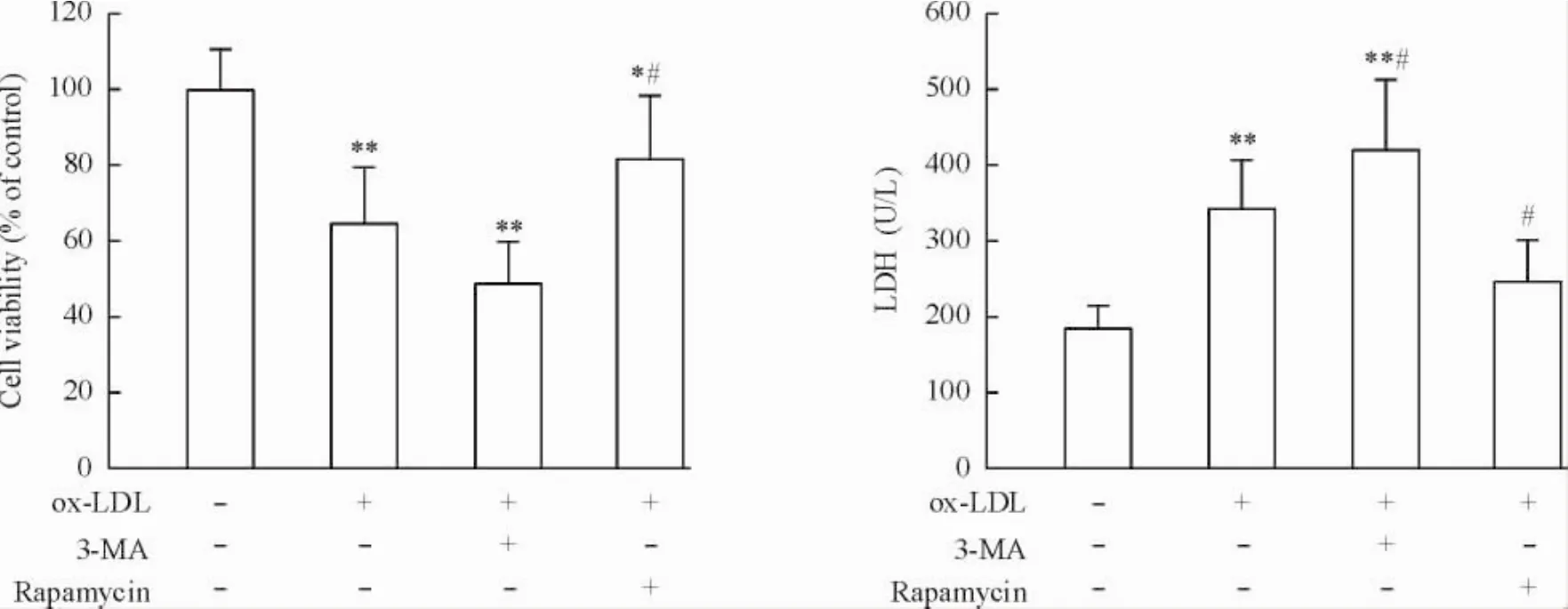
Figure 5.The cytotoxicity of ox-LDL on RAW264.7 macrophages was promoted by 3-MA and blocked by rapamycin.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05 vs ox-LDL group.圖5 ox-LDL誘導細胞毒性的作用可被3-MA促進而被雷帕霉素拮抗
近年來研究提示,自噬作為一種自適應及保護性反應,可延緩或減輕AS進展。自噬反應的增強可減輕血管內皮和平滑肌細胞死亡,而自噬缺陷(ATG5-/-、ATG5 siRNA)或自噬抑制劑3-MA可加重ox-LDL、7-KC和游離膽固醇等因素誘導的血管內皮細胞和平滑肌細胞損傷[9-10]。在巨噬源性泡沫細胞中,脂滴通過自噬途徑被運輸至溶酶體,在溶酶體酸性酯酶的作用下,膽固醇酯被水解,產生游離膽固醇,然后通過ATP結合盒轉運子A1 (ATP-binding cassette transporter A1,ABCA1)途徑流出[16]。小鼠和兔AS模型證實,ATG5缺陷可增加AS斑塊中巨噬細胞凋亡和氧化應激,促進斑塊壞死,而自噬誘導劑雷帕霉素則降低AS病變中巨噬細胞和膽固醇的含量,增強斑塊的穩定性[4,10,17]。本實驗結果顯示,3-MA促進了ox-LDL所誘導的細胞損傷,表現為細胞活力降低和LDH漏出進一步加重;而自噬誘導劑雷帕霉素則可拮抗ox-LDL所誘導的細胞損傷,使細胞活力增加和LDH漏出減少,表明自噬可減輕ox-LDL所誘導的巨噬細胞損傷。但是也有研究發現3-MA通過抑制III型PI3K活性抑制自噬而減輕香煙提取物所引起的血管內皮細胞死亡[18],mTOR激活劑3BDO可通過抑制自噬減輕ox-LDL所誘導的血管內皮細胞凋亡,穩定apoE-/-小鼠AS病變[19],提示自噬可加重香煙提取物和ox-LDL所誘導的血管內皮細胞死亡;另外通過自噬途徑清除瀕死的巨噬細胞可促進炎癥激活和炎癥因子的釋放[20]。因此,自噬的激活是有益的還是有害的可能取決于疾病不同階段細胞內底物負荷及細胞自噬降解的能力,其在AS發生發展中的作用及其調控機制還有待進一步闡明。
[參考文獻]
[1]Williams HJ,Fisher EA,Greaves DR.Macrophage differentiation and function in atherosclerosis: opportunities for therapeutic intervention?[J].J Innate Immun,2012,4 (5-6) :498-508.
[2]Mei Y,Thompson MD,Cohen RA,et al.Autophagy and oxidative stress in cardiovascular diseases[J].Biochim Biophys Acta,2015,1852(2) :243-251.
[3]Verheye S,Martinet W,Kockx MM,et al.Selective clearance of macrophages in atherosclerotic plaques by autophagy[J].J Am Coll Cardiol,2007,49(6) : 706-715.
[4]Liao X,Sluimer JC,Wang Y,et al.Macrophage autophagy plays a protective role in advanced atherosclerosis[J].Cell Metab,2012,15(4) :545-553.
[5]姚樹桐,桑慧,楊娜娜,等.氧化低密度脂蛋白誘導巨噬細胞內質網應激及CD36的可能作用[J].生理學報,2010,62 (5) :433-440.
[6]苗成,李金國,苗芳,等.槲皮素對ox-LDL所致的小鼠巨噬細胞脂質蓄積和過氧化的影響[J].中國病理生理雜志,2013,29(8) :1370-1374.
[7]趙莉,姚樹桐,陳軍,等.載脂蛋白A-I模擬肽D-4F對巨噬細胞源性泡沫細胞清道夫受體A1的抑制作用[J].中國病理生理雜志,2014,30 (10) : 1742-1747.
[8]Martinet W,De Meyer GR.Autophagy in atherosclerosis: a cell survival and death phenomenon with therapeutic potential[J].Circ Res,2009,104(3) : 304-317.
[9]張艷林,曹勇軍,尤壽江,等.自噬對氧化低密度脂蛋白損傷內皮細胞的保護作用[J].中華醫學雜志,2010,90(39) :2792-2796.
[10]He C,Zhu H,Zhang W,et al.7-Ketocholesterol induces autophagy in vascular smooth muscle cells through Nox4 and Atg4B[J].Am J Pathol,2013,183(2) : 626-637.
[11]Rahaman SO,Lennon DJ,Febbraio M,et al.A CD36-dependent signaling cascade is necessary for macrophage foam cell formation[J].Cell Metab,2006,4(3) : 211-221.
[12]Kuchibhotla S,Vanegas D,Kennedy DJ,et al.Absence of CD36 protects against atherosclerosis in ApoE knock-out mice with no additional protection provided by absence of scavenger receptor A I/II[J].Cardiovasc Res,2008,78 (1) :185-196.
[13]Yao S,Miao C,Tian H,et al.Endoplasmic reticulum stress promotes macrophage-derived foam cell formation by up-regulating cluster of differentiation 36 (CD36) expression[J].J Biol Chem,2014,289(7) :4032-4042.
[14]Li H,Horke S,Frstermann U.Vascular oxidative stress,nitric oxide and atherosclerosis[J].Atherosclerosis,2014,237(1) :208-219.
[15]Peluso I,Morabito G,Urban L,et al.Oxidative stress in atherosclerosis development: the central role of LDL and oxidative burst[J].Endocr Metab Immune Disord Drug Targets,2012,12(4) :351-360.
[16]Ouimet M,Franklin V,Mak E,et al.Autophagy regulates cholesterol efflux from macrophage foam cells via lysosomal acid lipase[J].Cell Metab,2011,13(6) : 655-667.
[17]Velikkakath AK,Nishimura T,Oita E,et al.Mammalian Atg2 proteins are essential for autophagosome formation and important for regulation of size and distribution of lipid droplets[J].Mol Biol Cell,2012,23(5) :896-909.
[18]Csordas A,Kreutmayer S,Ploner C,et al.Cigarette smoke extract induces prolonged endoplasmic reticulum stress and autophagic cell death in human umbilical vein endothelial cells[J].Cardiovasc Res,2011,92(1) :141-148.
[19]Peng N,Meng N,Wang S,et al.An activator of mTOR inhibits oxLDL-induced autophagy and apoptosis in vascular endothelial cells and restricts atherosclerosis in apolipoprotein E-/-mice[J].Sci Rep,2014,4: 5519.
[20]Petrovski G,Ayna G,Majai G,et al.Phagocytosis of cells dying through autophagy induces inflammasome activation and IL-1β release in human macrophages[J].Autophagy,2011,7(3) :321-330.
通訊作者△姚樹桐Tel: 0538-6225010; E-mail: yst228@ 126.com;秦樹存Tel: 0538-6237252; E-mail: shucunqin@ hotmail.com
*[基金項目]國家自然科學基金資助項目(No.81202949; No.81370381)
[收稿日期]2014-11-25
[文章編號]1000-4718(2015)06-1002-06
[中圖分類號]R363.2; R332
[文獻標志碼]A
doi:10.3969/j.issn.1000-4718.2015.06.007

