CHOPE與CHOPE—L方案治療65例外周T細胞淋巴瘤非特異型效果及預后影響因素分析
李佳 劉卓剛

[摘要] 目的 評價應用CHOPE與CHOPE-L方案治療外周T細胞淋巴瘤非特異型(PTCL-U)的效果及其預后影響因素。 方法 對2005年1月~2012年1月經中國醫科大學附屬盛京醫院病理及免疫組化確診的65例PTCL-U患者的資料進行回顧性分析,評價CHOPE與CHOPE-L方案的治療效果及其預后影響因素。 結果 20例應用CHOPE方案治療,完全緩解(CR)4例(20.0%),部分緩解(PR)5例(25.0%),總有效率(OR)為45.0%;1、2、3年的總生存率分別為75.0%、40.0%及15.0%。45例應用CHOPE-L方案治療,CR 12例(26.7%),PR 19例(42.2%),OR為68.9%;1、2、3年的總生存率分別為82.2%、62.2%及40.0%。Ann Arbor分期Ⅰ~Ⅱ期、結外侵犯0~1個、無骨髓侵犯、Ki-67≤50%及應用CHOPE-L方案的患者較Ann Arbor分期Ⅲ~Ⅳ期、結外侵犯≥2個、有骨髓侵犯、Ki-67>50%及應用CHOPE方案的患者化療有效率高,差異有統計學意義(P < 0.05)。一般狀況評分(ECOG評分)0~1分、國際預后指數(IPI)評分≤2分、Ki-67≤50%及應用CHOPE-L方案化療的患者較ECOG評分2~4分、IPI評分>2分、Ki-67>50%及應用CHOPE方案化療的患者3年生存率高,差異有統計學意義(P < 0.05)。多因素分析顯示,IPI評分是本組病例的獨立預后因素(P < 0.05)。 結論 PTCL-U是一類預后不良的疾病,左旋門冬酰胺酶(L-ASP)的應用提高了化療有效率及3年生存率,且安全性好,不良反應可耐受。Ann Arbor分期、結外侵犯、骨髓侵犯、Ki-67及化療方案是影響近期療效的重要因素。患者的ECOG評分、IPI評分、Ki-67及化療方案是影響患者預后的重要因素。
[關鍵詞] 外周T細胞淋巴瘤;CHOPE方案;左旋門冬酰胺酶;預后因素;治療
[中圖分類號] R734 [文獻標識碼] A [文章編號] 1673-7210(2015)06(b)-0055-05
Treatment response and prognostic factors in 65 patients with peripheral T cell lymphoma-unspecified treated by CHOPE and CHOPE-L chemotherapy
LI Jia LIU Zhuogang
Department of Hematology, Shengjing Hospital Affiliated to China Medical University, Liaoning Province, Shenyang 110022, China
[Abstract] Objective To investigate the treatment response and prognostic factors in patients with peripheral T cell lymphomas-unspecified (PTCL-U) treated by CHOPE and CHOPE-L chemotherapy. Methods The clinical data of 65 pathology and immunohistochemistry confirmed patients with PTCL-U in Shengjing Hospital Affiliated to China Medical University from January 2005 to January 2012 were retrospectively analyzed, in order to evaluate the treatment response and prognosic factors of CHOPE and CHOPE-L chemotherapy. Results Of 20 cases treated by CHOPE, complete remission (CR) rate was 20.0% (4/20), partial remission (PR) rate was 25.0% (5/20) and overall response (OR) rate was 45.0%.The overall survival rates of 1, 2 and 3 years was 75.0%, 40.0% and 15.0% respectively. Of 45 cases treated by CHOPE-L, CR rate was 26.7% (12/45), PR rate was 42.2% (19/45) and OR rate was 68.9%. The overall survival rates of 1, 2 and 3 years was 82.2%, 62.2% and 40.0% respectively. Ann Arbor stage Ⅰ-Ⅱ, extranodal involvement of 0-1, the patients without bone marrow involvement, Ki-67≤50% and the application of CHOPE-L chemotherapy had a better recent curative effect compared with Ann Arbor stage Ⅲ-Ⅳ, extranodal involvement of more than two, the patients with bone marrow involvement, Ki-67 > 50% and the application of CHOPE chemotherapy (P < 0.05). ECOG scoring 0-1, International prognostic index (IPI) ≤2, Ki-67≤50% and the application of CHOPE-L chemotherapy had a higher 3-year overall survival rate compared with ECOG scoring 2-4, IPI scoring >2, Ki-67 > 50% and the application of CHOPE chemotherapy (P < 0.05). Multi-factors analysis of IPI scoring was independent prognostic factors in this group of patients (P < 0.05). Conclusion PTCL-U is a kind of disease with poor prognosis. The use of L-asparaginase (L-ASP) improves the rate of response to chemotherapy and survival rate in 3 years. The security is good and the side effects can be tolerated. Ann Arbor stage, extranodal involvement, bone marrow involvement, Ki-67 and CHOPE-L chemotherapy are important factors affecting the recent curative effect. ECOG score, IPI score, Ki-67 and CHOPE-L chemotherapy are important prognostic factors.
[Key words] Peripheral T cell lymphoma; CHOPE chemotherapy; L-asparaginase; Prognostic factor; Treatment
非霍奇金淋巴瘤(NHL)近年來發病率明顯提高。與B細胞淋巴瘤相比,T細胞淋巴瘤具有更高的侵襲性[1],其中以外周T細胞淋巴瘤非特異型(PTCL-U)最為常見。近年來,立妥昔單抗的應用使得B細胞淋巴瘤的治療效果得到顯著提高,但T細胞淋巴瘤目前尚無最佳治療方案,CHOP方案仍作為最常用方案在臨床中廣泛應用。近年來研究發現,足葉乙苷[2]以及左旋門冬酰胺酶(L-ASP)[3]的療效在T細胞淋巴瘤中獲得肯定。本文回顧性分析了中國醫科大學附屬盛京醫院(以下簡稱“我院”)收治的經病理學及免疫組化確診的PTCL-U 65例,分析其疾病特征及治療效果,討論其預后影響因素。
1 資料與方法
1.1 一般資料
選擇2005年1月~2012年1月期間我院病理及免疫組化確診的65例PTCL-U患者。初治58例,復治7例;男38例,女27例,男女比例為1.4∶1;年齡為22~71歲,中位年齡49歲。臨床分期Ⅰ~Ⅱ期18例,Ⅲ~Ⅳ期47例。國際預后指數(international prognostic index,IPI)評分≤2分34例,>2分31例。
1.2 治療方法
20例患者應用CHOPE方案化療,用法:長春新堿1.4 mg/m2靜脈滴注第1日,阿霉素50 mg/m2靜脈滴注第1日,環磷酰胺750 mg/m2靜脈滴注第1日,潑尼松100 mg/m2日1次口服第1~5日,足葉乙苷100 mg靜脈滴注第1~5日。21 d為1個周期,中位療程數為6(4~8)個周期。45例患者應用CHOPE-L方案化療,用法:長春新堿1.4 mg/m2靜脈滴注第1日,阿霉素50 mg/m2靜脈滴注第1日,環磷酰胺750 mg/m2靜脈滴注第1日,潑尼松100 mg/m2日1次口服第1~5日,足葉乙苷100 mg靜脈滴注第1~5日,L-ASP 10 000 U,靜注,第6~12天,應用L-ASP期間囑患者低脂飲食。21 d為1個周期,中位療程數為6(3~8)個周期。
1.3 治療效果及不良反應評價
治療效果按照NHL國際療效判斷標準[4]分為完全緩解(CR)、部分緩解(PR)、疾病穩定(SD)和病情進展(PD)。總有效率(OR)=CR+PR。不良反應按照世界衛生組織(World Heath Organization,WHO)毒副反應分級標準[5]分為0~Ⅳ度。所納入病例均隨訪至2014年12月31日且均可進行療效評價。
1.4 觀察指標
一般狀況(ECOG)評分、B癥狀、Ann Arbor分期、IPI評分、巨大腫塊(>10 cm)、骨髓侵犯、肝臟侵犯、脾臟侵犯、結外侵犯、Ki-67、血清糖類抗原125(CA125)水平、β2微球蛋白(β2-MG)水平、乳酸脫氫酶(LDH)水平、淋巴細胞計數及化療方案。
1.5 統計學方法
應用SPSS 19.0統計學軟件進行數據分析,計數資料用率表示,組間比較采用χ2檢驗;生存分析采用Kaplan-Meier法;單因素分析采用Log-rank法;多因素分析采用Cox回歸法;以P < 0.05為差異有統計學意義。
2 結果
2.1 近期療效
65例PTCL-U患者,20例應用CHOPE方案治療后,CR 4例(20.0%),中位療程2(1~4)個周期獲得CR;PR 5例(25.0%),SD 4例(20.0%),PD 7例(35.0%),OR為45.0%。45例應用CHOPE-L方案治療后,CR 12例(26.7%),中位療程2(1~4)個周期獲得CR;PR 19例(42.2%),SD 4例(8.9%),PD 10例(22.2%),OR為68.9%。
2.2 PTCL-U患者近期療效的影響因素
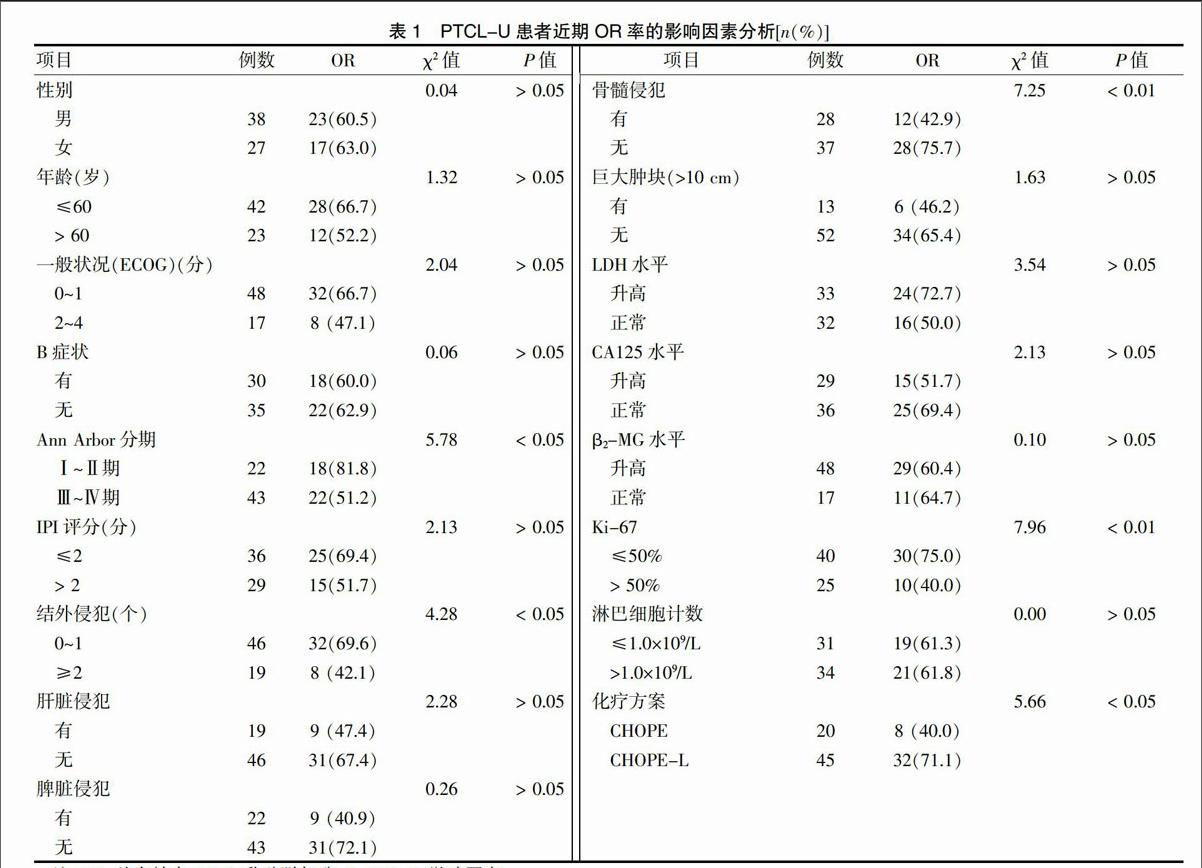
Ann Arbor分期Ⅰ~Ⅱ期、結外侵犯0~1個、無骨髓侵犯、Ki-67≤50%及應用CHOPE-L方案的患者較Ann Arbor分期Ⅲ~Ⅳ期、結外侵犯≥2個、有骨髓侵犯、Ki-67>50%及應用CHOPE方案的患者化療有效率高,且差異有統計學意義(P < 0.05);性別、年齡、ECOG評分、B癥狀、IPI評分、巨大腫塊(>10 cm)、肝臟侵犯、脾臟侵犯、CA125水平、β2-MG水平、LDH水平及淋巴細胞計數≤1.0×109/L與近期OR率無關(P > 0.05)。見表1。
2.3 遠期生存
65例PTCL-U患者,20例應用CHOPE方案治療后,17例死亡,其中16例死于腫瘤進展或復發,1例死于化療后骨髓抑制期血小板減少引起的腦出血。1、2、3年的總生存率(OS)分別達75.0%、40.0%及15.0%。中位生存時間(median survival time,MST)為17.5個月。CR患者1、2、3年OS分別達100.0%、75.0%、50.0%,MST為28個月。PR患者1、2、3年的OS分別達80.0%、40.0%、20.0%,MST為16個月。45例應用CHOPE-L方案治療后,27例死亡,其中25例死于腫瘤進展或復發,1例死于化療后骨髓抑制期感染性休克,1例死于呼吸衰竭。1、2、3年的OS分別達82.2%、62.2%、40.0%;MST為17個月。CR患者1、2、3年的OS分別達83.3%、66.7%、58.3%;MST為36個月。PR患者1、2、3年的OS分別達78.9%、57.9%、42.1%;MST為19個月。
2.4 PTCL-U患者遠期生存的影響因素
ECOG評分0~1分、IPI評分≤2分、Ki-67≤50%及應用CHOPE-L方案化療的患者較ECOG評分2~4分、IPI評分>2分、Ki-67>50%及應用CHOPE方案化療的患者3年OS高,且差異有統計學意義(P < 0.05)。性別、年齡、B癥狀、Ann Arbor分期、巨大腫塊(>10 cm)、骨髓侵犯、肝臟侵犯、脾臟侵犯、結外侵犯、CA125水平、β2-MG水平、LDH水平及淋巴細胞計數≤1.0×109/L與3年OS無關(P > 0.05)。見表2。Cox模型多因素分析顯示,IPI評分是影響本組病例生存的獨立預后因素(RR=0.675,P < 0.05)。
2.5 不良反應
對于血液學不良反應,20例應用CHOPE方案化療的患者,14例(70.0%)出現Ⅰ~Ⅱ度骨髓抑制,6例(30.0%)出現Ⅲ~Ⅳ度骨髓抑制,1例死于化療后Ⅳ度骨髓抑制血小板減少引起的腦出血。45例應用CHOPE-L方案化療的患者,29例(64.4%)出現Ⅰ~Ⅱ度骨髓抑制,16例(35.6%)出現Ⅲ~Ⅳ度骨髓抑制,1例死于化療后Ⅳ度骨髓抑制粒細胞缺乏引起的感染性休克。余患者應用粒細胞刺激因子、對癥輸注紅細胞懸液及機采血小板后病情好轉。對于非血液學不良反應,CHOPE方案化療的患者10例(50.0%)出現消化道反應,6例(30.0%)出現肝功能損傷,2例(10.0%)出現心臟毒性。CHOPE-L方案化療的患者28例(62.2%)出現消化道反應,10例(22.2%)出現肝功能損傷,4例(8.9%)出現心臟毒性。均經對癥治療后好轉,無不良事件發生。由L-ASP引起的特殊不良反應見表3。凝血功能異常者經輸注血漿及冷沉淀后獲得改善,而膽固醇及三酰甘油升高者經降脂治療,膽紅素及轉氨酶升高者經保肝治療后檢驗結果降至正常。2例誘發急性胰腺炎的患者經禁食水、抑酸、抑制胰酶分泌及補液等對癥支持治療后病情好轉。
表3 L-ASP相關不良反應
3 討論
PTCL是一種臨床表現及生物學行為均具有明顯異質性的淋巴系統腫瘤性疾病,它來源于胸腺不同階段的T細胞[6]。PTCL-U是PTCL中最常見的病理類型,包括了未能獨立分型的大部分淋巴結來源的PTCL[7]。針對PTCL-U的治療,CHOP方案仍作為最基礎化療方案在臨床中廣泛應用。但相關臨床研究顯示,CHOP方案的CR率不足20%,且緩解期短,3年生存率低[8]。本研究結果顯示,應用CHOPE與CHOPE-L方案化療的患者,其有效率及3年生存率均較CHOP方案有所提高,尤其L-ASP的應用,使得總有效率達68.9%,1、2、3年的總生存率分別達82.2%、62.2%及40.0%,應用CHOPE-L方案化療的患者,近期療效及遠期生存均較CHOPE化療組高,差異有統計學意義。L-ASP屬于酶制劑類抗腫瘤藥物,取自大腸埃希菌,其主要作用機制是將血清中的門冬酰胺水解為門冬氨酸和氨,使腫瘤細胞不能從血清中得到合成蛋白質所必須的門冬酰胺,從而抑制腫瘤細胞的增殖。L-ASP還可以通過干擾腫瘤細胞DNA及RNA的合成使得腫瘤細胞增殖受抑[9]。應用L-ASP也存在一定的不良反應,有報道顯示,L-ASP可誘發過敏性休克及急性重型胰腺炎等嚴重并發癥[10]。但本研究45例應用L-ASP,雖有凝血功能異常、肝功能損害、血脂異常等不良反應發生,經積極治療后,患者可耐受,受損情況可逆轉,并無危及生命的不良反應發生。因此L-ASP是治療PTCL-U安全有效的藥物。
國內外研究表明,影響化療有效率及長期生存的相關因素各有不同。劉婷等[11]研究表明,Ki-67≤50%的患者化療有效率較高。Abramson等[12]研究顯示,臨床分期是影響患者近期療效的重要因素。本研究亦證明了上述結論,同時也發現結外侵犯0~1個及無骨髓侵犯患者化療有效率較高,可能與疾病診斷相對較早、腫瘤負荷相對較低有關。吳國林等[13]研究發現,Ki-67表達≤80%及ECOG評分0~1分的PTCL-U患者2年生存率較高。由此可以看出,Ki-67無論在評價近期療效還是遠期生存方面都是重要的參考指標。Xie等[14]的研究顯示,IPI評分≤2分的患者3年生存率較高,與本研究結論相符。同時本文也通過Cox模型多因素分析得出IPI評分是影響本組病例生存的獨立預后因素,IPI評分>2分的患者較IPI評分≤2分的患者3年生存率明顯下降。
目前,PTCL-U尚無統一的治療標準,且療效尚不理想。歐洲一項新的研究結果顯示,CD52單抗阿侖單抗聯合氟達拉濱、米托蒽醌及環磷酰胺化療治療T細胞幼淋巴細胞白血病的總體有效率達92%[15],因此阿侖單抗有望成為治療PTCL-U新的靶向藥物,且阿侖單抗聯合化療治療PTCL的Ⅲ期臨床試驗正在進行中。姚遠等[16]的研究顯示,自體外周血造血干細胞移植支持下的大劑量化療將PTCL患者的5年生存率提升至58%。因此未來的研究重點應提高對疾病分子生物學的研究以及靶向藥物的研發,同時盡早行造血干細胞移植,以延長患者生存時間。
[參考文獻]
[1] Avilrs A,CastaPiede C,Neff N,et al. Results of a phase m clinical trial:CHOP versus CMED in peripheral T-cell ymphomas unspecified [J]. Med Oncol,2008,25(3):360.
[2] Schmitz N,Trtimper L,Ziepert M,et al. Treatment and prognosis of mature T-cell and NK-cell lymphoma:an analysis of patients with T-cell lymphoma treated in studies of the German High-Grade Non-Hodgkin Lymphoma Study Group [J]. Blood,2010,116(18):3418.
[3] Raetz EA,Salzer WL. Tolerability and efficacy of L-aspa-raginase therapy in pediatric patients with acute lympho-blastic leukemia [J]. J Pediatr Hematol Oncol,2010,32(7):554-563.
[4] Grillo Lopez AJ,Cheson BD,Homing SJ,et al. Response criteria for NHL:important of nomal lymph node size and correlations with response rates [J]. Ann Oncol,2000,11:399-408.
[5] Jackson G,Taylor P,Smith GM,et al. A multicentre,open,non-comparative phase II study of a combination of fludarabine phosphate,cytarabine and granulocyte colony-stimulating factor in relapsed and refractory acute myeloid leukemia and de novo refractory anemia with excess blasts in transformation [J]. Br J Haematol,2001,112:127-137.
[6] Savage KJ,Chhanabhai M,Gascoyne RD,et al. Character-ization of peripheral T-cell lymphomas in a single North American institution by the WHO classification [J]. Ann Oncol,2004,15:1467-1475.
[7] 吳瞳,雙躍榮.外周T細胞淋巴瘤非特指型的預后及治療的研究進展[J].實用癌癥雜志,2010,25(1):100-103.
[8] Niitsu N,Okamoto M,Nakamine H,et al. Clinico-pathologic features and outcome of Japanese patients with peripheral T-cell lymphomas [J]. Hematol Oncol,2008,26(3):152-158.
[9] 葉麗,虞國慧,潘明,等.左旋門冬酰胺酶治療急性淋巴細胞白血病不良反應[J].安徽醫藥,2011,15(3):365-366.
[10] 毛小紅.左旋門冬酰胺酶的不良反應及其診治[J].藥物流行病學雜志,2008,17(13):181-183.
[11] 劉婷,趙瑜,薄劍,等.CHOP與CHOP-L方案化療對45例外周T細胞淋巴瘤非特異型療效及預后分析[J].中華臨床醫師雜志,2013,7(18):87-90.
[12] Abramson JS,Feldman T,Kroll-Desrosiers AR,et al. Peripheral T-cell lymphomas in a large US multicenter cohort:prognostication in the modern era including impact of frontline therapy [J]. Ann Oncol,2014,25(11):2211-2217.
[13] 吳國林,汪曉虹,宋浩,等.CHOP及高強度方案EPOCH、HyperCVAD、硼替佐米聯合化療治療外周T細胞淋巴瘤-非特指型的臨床效果及預后因素分析[J].中國醫藥導報,2014,11(25):82-84.
[14] Xie W,Hu K,Xu F,et al. Significance of clinical factors as prognostic indicators for patients with peripheral T-cell non-Hodgkin lymphoma: A retrospective analysis of 252 cases [J]. Mol Clin Oncol,2013,1(5):911-917.
[15] Hopfinger G,Busch R,Pflug N,et al. Sequential chemo-immunotherapy of fludarabine,Mitoxantrone,and cyclop-hosphamide induction followed by alemtuzumab consoli-dation is effective in T-cell prolymphocytic leukemia [J].Cancer,2013,119(12):2258-2267.
[16] 姚遠,易平勇,劉晰宇,等.自體外周血造血干細胞移植支持下大劑量化療一線治療外周T細胞淋巴瘤[J].中國醫師雜志,2014,16(2):227-230.
(收稿日期:2015-03-07 本文編輯:程 銘)

