關于“化學反應速率”的課堂設計與應用反思
2015-09-10 07:22:44劉紅紅
考試周刊
2015年56期
劉紅紅
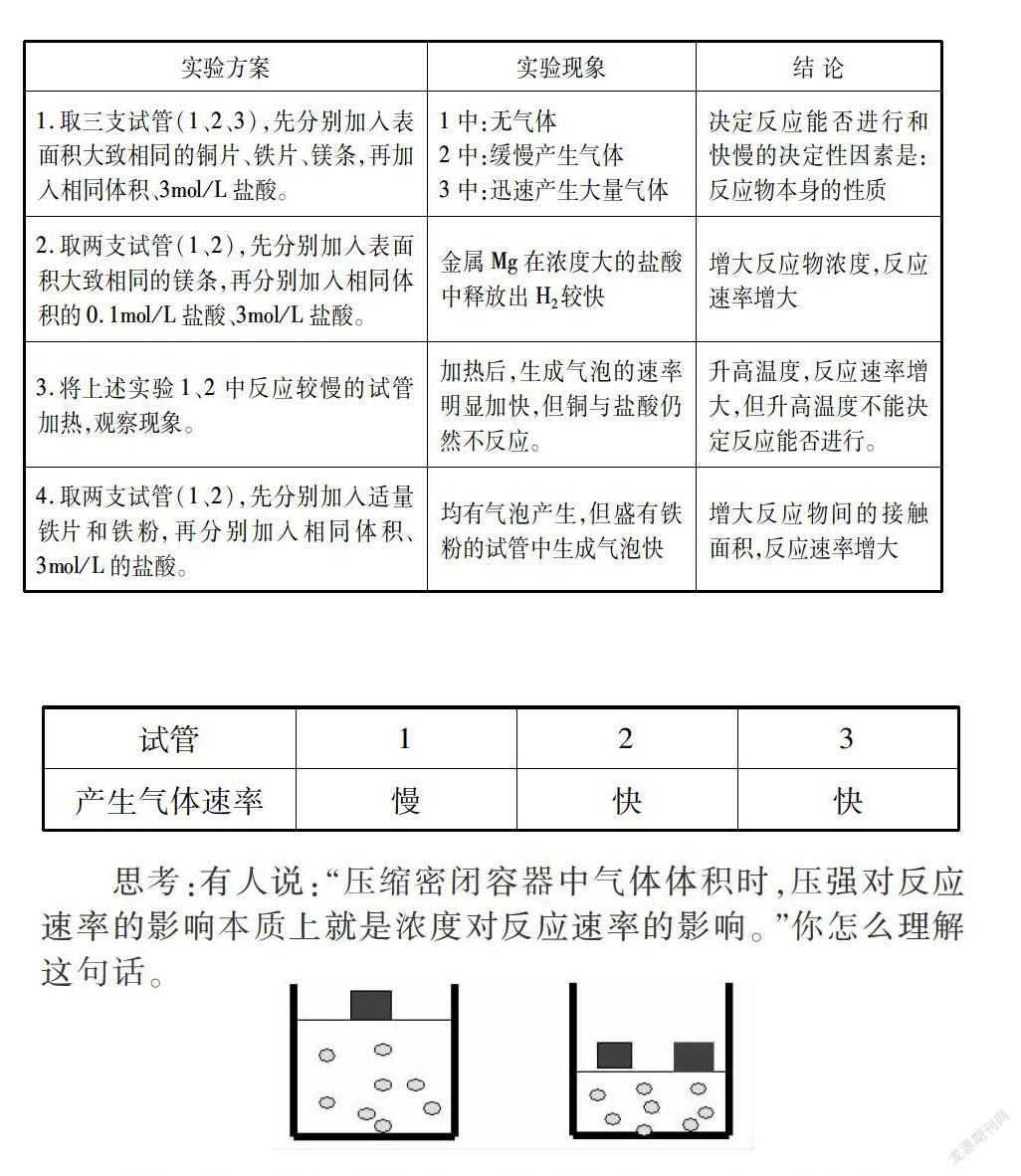
摘 要: “化學反應速率”是蘇教版化學2專題2第一單元的第一課時,本文以學情和教材地位為依據進行了課堂設計,并針對此設計做了反思,以期對教學有所幫助。
關鍵詞: “化學反應速率” 課堂設計 應用反思
“化學反應速率”包含化學反應快慢的衡量和計算,也隱含化學反應速率的影響因素,通過學生自己實驗探究和教師引導,有助于學生更透徹地理解知識,提高知識應用和遷移的能力。
在教案設計時應注意實驗設計的有效性和操作性,盡量簡化實驗操作,并對小組討論過程中學生認知情況的變化有充分的預計,既讓學生成為課堂的主角,又要掌握課堂的發展方向,恰當地引導,將探索引向深入,培養學生的創造性思維。
提高學生分析、解決問題能力的最好方法,就是在學生的實驗探究過程中增強對實驗結果的不確定性,將驗證類實驗與探究類實驗相結合。
一、設計的基本依據
1.教材地位
學好“化學反應速率”是學生更深入地認識化學反應的基礎。學生對化學反應的快慢和反應速率的影響因素的認識,是通過有限實驗現象的觀察和生活體驗感性地把握的。化學反應速率內容在高中必修模塊和選修模塊中均有安排,既有學習的階段性,又有必修、選修的層次性,本課時教學中要通過實驗,聯系已學知識幫助學生定性地認識外界條件對化學反應速率的影響,利用這一知識說明生產生活中有關反應速率的問題,不要求從理論上說明外界條件為什么會影響化學反應速率,也不要求定量地分析、描述外界條件對化學反應速率的影響[1]。……
登錄APP查看全文

